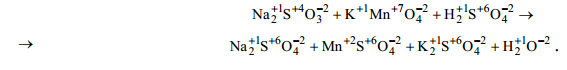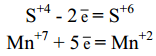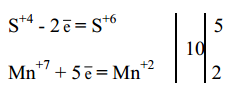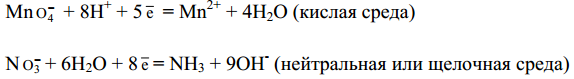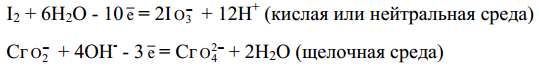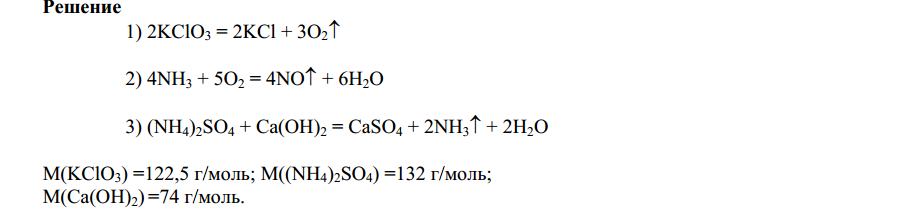Методика составления уравнений ОВР
Используют два метода: электронного баланса и полуреакций (электронно-ионный).
При составлении уравнений окислительно-восстановительных реакций с использованием метода электронного баланса следует:
1 В левой части записать формулы исходных веществ, а в правой - продуктов реакции. Для удобства и единообразия принято сначала в исходных веществах записать восстановитель, затем окислитель и среду (если это необходимо); в продуктах реакции- сначала продукт окисления восстановителя, продукт восстановления окислителя, а затем другие вещества.
Na2SO3+ KMnO4+ H2SO4 →Na2SO4+ MnSO4+ K2SO4+ H2O.
2 Определить окислительные числа элементов до и после реакции:
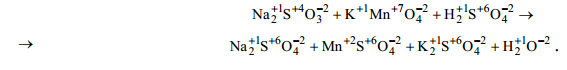
3 Определить окислитель и восстановитель. Сера в Na2SO3 повышает свою степень окисления, т.е. теряет электроны, в процессе реакции окисляется, значит Na2SO3 - восстановитель.
Марганец в KMnO4 понижает свою степень окисления, т.е. присоединяет электроны, в процессе реакции восстанавливается, значит KMnO4 - окислитель.
4 Составить электронный баланс, для этого записать в левой части начальное состояние серы и марганца, а в правой - конечное и определить число потерянных S+4 и принятых Mn+7 электронов:
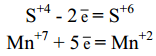
Общее число электронов, отданных всеми атомами восстановителя, должно быть равно общему числу электронов, принятых всеми атомами окислителя.
Определить общее число потерянных и принятых электронов (общее наименьшее кратное). Оно равно10. 10 электронов теряют 5 атомов серы и присоединяют 2 атома марганца.
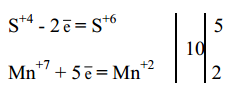
5 Перенести эти коэффициенты в уравнение реакции к окисленным и восстановленным формам восстановителя и окислителя:
5Na2SO3+ 2KMnO4+ H2SO4 →5Na2SO4+ 2MnSO4+ K2SO4+ H2O.
6 Подобрать и расставить коэффициенты для молекул других соединений, участвующих в реакции.
Определив количество кислотных остатков SO2−4, пошедших на солеобразование MnSO4 иK2SO4 (оно равно3), поставить коэффициент к H2SO4:
5Na2SO3+ 2KMnO4+ 3H2SO4 →5Na2SO4+ 2MnSO4+ K2SO4+ H2O
и по количеству моль-атомов водорода в H2SO4 определить количество моль H2O:
5Na2SO3+ 2KMnO4+ 3H2SO4= 5Na2SO4+ 2MnSO4+ K2SO4+ 3H2O.
Правильность расстановки коэффициентов проверить по равенству числа атомов кислорода в левой и правой частях уравнения.
При составлении уравнений ОВР с применением метода полуреакций следует:
1 Составить схему реакции с указанием исходных веществ и продуктов реакции, найти окислитель и восстановитель.
2 Составить схемы полуреакций окисления и восстановления с указанием исходных и образующихся реально существующих в условиях реакции ионов или молекул.
3 Уравнять число атомов каждого элемента в левой и правой частях полуреакций; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы H2O, ионы Н+ или ОН-.
4 Уравнять суммарное число зарядов в обеих частях каждой полуреакции; для этого прибавить к левой или правой части полуреакции необходимое число электронов.
5 Подобрать множители (основные коэффициенты) для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
6 Сложить уравнения полуреакций с учетом найденных основных коэффициентов.
7 Расставить коэффициенты в уравнении реакции.
Метод полуреакций(электронно-ионный)
Следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходят по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных- молекулами воды с образованием гидроксид-ионов, например:
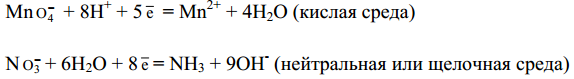
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде - за счет гидроксид-ионов с образованием молекул воды, например:
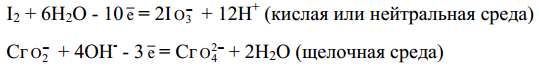
П р и м е р Закончите уравнение реакций окисления сероводорода хлорной водой, протекающей по схеме:
H2S + Cl2 + H2O →H2SO4+ HC1
Решение В ходе реакции степень окисления хлора понижается от 0 до -1 (Cl2 восстанавливается), а серы - повышается от -2 до + 6 (S-2 окисляется).
Уравнение полуреакции восстановления хлора:
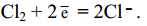
При составлении уравнения полуреакции окисления S-2 исходим из схемы:
H2S →SO42−.
В ходе этого процесса атом серы связывается с четырьмя атомами кислорода, источником которых служат четыре молекулы воды. При этом образуется восемь ионов Н+; кроме того, два иона Н+ высвобождаются из молекулы H2S. Следовательно, всего образуется десять ионов водорода:
H2S + 4Н2О →SO42− + 10H+.
Левая часть схемы содержит только незаряженные частицы, а суммарный заряд ионов в правой части схемы равен +8. Следовательно, имеет место равенство:

П р и м е р* Закончите уравнение реакции, протекающей по схеме:
As2S3+ HNO3 →H3AsO4+ H2SO4 + NO.


П р и м е р Используя метод полуреакций, составьте полные уравнения следующих окислительно-восстановительных реакций:
а) FeSO4 + KMnO4+ H2SO4 →
б) KClO3+ HCl →
в) Si + NaOH + H2O →
Решение

П р и м е р Рассчитайте содержание KMnO4 (ω,%) в техническом продукте, если при действии на него раствором соляной кислоты массой 25 г образуется такое количество хлора, которое способно вытеснить весь иод из раствора, содержащего KI массой 83 г.

П р и м е р При нагревании смеси нитратов натрия и свинца образовался PbO массой 22,3 г и выделился газ объемом 6,72 дм3(н.у.). Рассчитайте массу смеси исходных веществ.

П р и м е р К раствору иодида калия в кислой среде добавлено 200 см3 0,6 н раствора дихромата калия. Какая масса иода выделилась?

П р и м е р*
Какую массу KClO3 следует взять для получения кислорода необходимого для реакции каталитического окисления аммиака, образующегося при нагревании раствора (NH4)2SO4 массой 500 г (ω= 13,2 %) и Ca(OH)2 массой 100 г, содержащий примесь карбоната кальция (ω= 3,5 %).
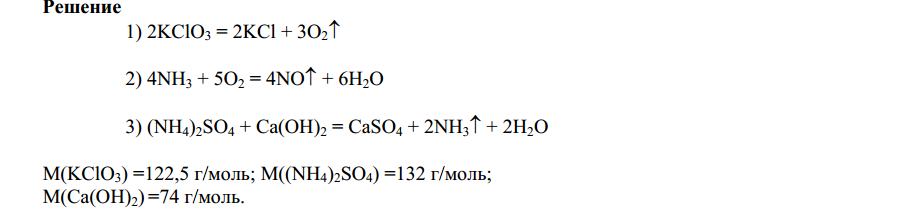

П р и м е р Объем газа, образовавшегося при полном разложении озона, больше объема, занимаемого чистым озоном на 4,48 дм3. Полученный после полного разложения озона газ смешали с H2S объемом 8,96 дм3 и сожгли. Продукты реакции растворили в 28,6 см3 раствораNaOH с массовой долей 40 % (ρ= 1,40 г/cм3). Рассчитайте количество и состав полученной соли. Определите объем разложившегося озона.

П р и м е р*
Через озонатор пропустили кислород, полученный при разложении бертолетовой соли массой 24,5 г, при этом 5 % кислорода превратилось в озон. Определите состав озонированного кислорода.

П р и м е р*
Смесь оксидов азота (II) и (IV) объемом 5,6 дм3 (н.у.) была смешана с
кислородом объемом 2,016 дм3 (н.у.) и после реакции пропущена через раствор, содержащий гидроксид калия массой 30 г. Определите состав исходной смеси газов в объемных процентах и вычислите массовые доли веществ в растворе, приняв, что конечная масса раствора составила1 кг и что после пропускания газов через раствор образовался остаток газов объемом 0,56 дм3(н.у.), не вступивших в реакцию.
Решение

П р и м е р Сколько граммов FeSO4 можно окислить в присутствии H2SO4 с помощью 0,25 н раствора K2Cr2O7 объемом100 см3?

П р и м е р Навеску руды массой 0,2133 г растворили в серной кислоте без доступа воздуха. Образующийся сульфат железа (II) оттитровали 0,1117 н раствором KMnO4 объемом17,20 см3. Определите содержание железа в руде (ω, %).

П р и м е р* К 2,50 см3 раствора KClO3 (ρ= 1,02 г/см3) прибавили 25,00 см3 0,12 н раствора FeSO4, избыток которого оттитровали 0,11 н раствором KMnO4 объемом 5,00 см3. Рассчитайте содержание KClO3(ω, %) в исходном растворе.

Задачи
505 Укажите, какие из указанных веществ могут проявлять только окислительные свойства, только восстановительные свойства, проявляют окислительно-восстановительную двойственность: а) MnO2, KMnO4, P2O5, Na2S; б) K2SO3, HNO3, H2S, NO2; в) Cr, Na2CrO4, KCrO2, K2Cr2O7; г) NH3,
KClO2, N2, KNO3, K2MnO4.
507 Реакции выражаются схемами:
а) Na2SO3+ KIO3+ H2SO4 →Na2SO4+ I2+ K2SO4+ H2O;
б) CrCl3+ H2O2+ NaOH →Na2CrO4+ NaCl + H2O;
в) MnSO4+ PbO2+ HNO3 →HMnO4+ PbSO4+ Pb(NO3)2+ H2O;
г) K2Cr2O7+ K2S + H2SO4 →K2SO4+ Cr2(SO4)3+ S + H2O.
Расставьте коэффициенты в окислительно-восстановительных реакциях. Укажите окислитель и восстановитель. Какое вещество окисляется, какое восстанавливается?
508 Напишите уравнения реакций, в результате которых можно осуществить превращения: а) углерод → карбид кальция → гидроксид кальция → хлорная известь → хлор → хлорат калия →кислород; б) сероводород → сера → диоксид серы → сернистая кислота → сульфит натрия → сульфат натрия.
509 Какие сложные вещества можно получить, имея в распоряжении: а) кремний, водород, кислород, натрий; б) азот, кислород, серебро и водород. Напишите уравнения реакций и назовите полученные продукты.
510 Напишите химические реакции, которые могут происходить между веществами: алюминием, диоксидом серы, дихроматом калия, щелочью и серной кислотой.
511 Какие химические соединения можно получить, осуществляя реакции между железом, серой и кислородом, а также с продуктами этих реакций. Напишите уравнения и условия протекания реакций.
512 Какую массу твердого дихромата калия надо взять, чтобы приготовит600 cм3 0,4 н раствора для реакций: а) обмена; б) окисления-восстановления?
513 Какую массу кристаллического перманганата калия надо взять для приготовления 500 см3 0,04 н раствора, предназначенного для окислительно-восстановительного титрования в кислой среде.
514 При растворении в горячей концентрационной серной кислоте металла, предварительно полученного восстановлением оксида металла (II) массой 48 г водородом, образовался сульфат металла и выделился газ объемом 13,44 дм3 (н.у.). Назовите металл?
515 Определите массу дихромата калия и объем раствора HCl c массовой долей 37 % (ρ= 1,19 г/cм3), необходимые для получения хлора, способного вытеснить весь бром из 266,4 cм3 раствора бромида калия с массовой долей 40 % (ρ= 1,34 г/cм3).
516 К 400 cм3 0,8 н раствора сульфата железа (II) приготовленного из расчета его обменного эквивалента, добавлено1600 cм3 воды. Определите эквивалентную концентрацию сульфата железа (II), как восстановителя, в полученном растворе.
517 На титрование 40 см3 раствора нитрита калия в кислой среде израсходовано 32 см3 0,5 н раствора перманганата калия. Вычислите эквивалентную концентрацию и титр раствора нитрита калия.
518 Какая масса сульфата железа (II) содержится в растворе, если при его окислении перманганатом калия в кислой среде получено100 см3
0,5 н раствора сульфата железа (III)?
519 При окислении в кислой среде 20 см3 раствора сульфита натрия потребовалось16,8 см3 0,5 н раствора перманганата калия. Определите массу сульфита натрия в исходном растворе.
520 Смесь оксидов железа (II иIII) массой 8,0 г растворили в избытке серной кислоты. Для реакции с полученным раствором затратили KMnO4 (ω= = 5 %) массой 31,6 г. Определите состав смеси(ω, %).
521*
Закончите уравнения окислительно-восстановительных реакций и расставьте коэффициенты. Укажите окислитель и восстановитель.
1 KI + H2O2+ HCl →I2+ ...
2 Na2FeO4+ HCl →
3 H2O2+ K2Cr2O7+ H2SO4 →O2+ ...
4 KMnO4+ H2O2+ H2SO4 →O2+ ...
5 MnO2+ H2C2O4+ H2SO4 →CO2...
6 FeSO4+ Pb3O4+ H2SO4 →PbSO4+ ...
7 K2S2O8+ Cr2(SO4)3+ H2O →K2Cr2O7+ ...
8 PbO2+ NaCrO2+ NaOH →
t
9 Mn3O4+ KClO3+ K 2CO3→K2MnO4+ ...
10 FeCl2+ KMnO4+ ... →MnSO4+ ...
11 Fe(OH)2+ Cl2+ KOH →K2FeO4+ ...
12 Cr2O 3+ KClO3+ KOH →K2CrO4+ ...
13 NaClO + KI + H2SO4 →NaCl + ...
14 Cl2+ PH3+ H2O →H3PO4+ ...
15 Cl2+ KOH →
t
16 Cl2+ KOH →
17 FeS + H2O2+ H2SO4 →
18 O3+ MnO2+ NaOH →Na2MnO4+ ...
19 O3+ NO2 →N2O5+ ...
20 O3+ CrCl3+ KOH →
t
21 Zn(NO3)2→
22 KIO3+ Cl2+ KOH →
t
23 K2Cr2O7+ Cизб→
24 Na2CrO4+ H2O2+ H2SO4 →
25 H2O2+ As2S3+ NH3 →(NH4)3AsO4+ ...
26 CuFeS2+ HNO3 →Cu(HSO4)2+ ...
27 Cr2(SO4)3+ NaBrO3+ H2SO4 →
28 K2Cr2O7+ KI + H2SO4 →
29 Cr2(SO4)3+ Br2+ KOH →
Ag+
30 Cr2(SO4)3+ K2S2O8+ H2O →
31 AlPO4+ Cизб →
32 PBr3+ KMnO4+ H2O →
33 H3AsO4+ KI + H2SO4 →
34 KMnO4+ H2C2O4+ H2SO4 →
35 AsH3+ AgNO3+ H2O →
36 P2S3+ KMnO4+ H2O →
37 CuI + KMnO4+ H2SO4 →
38 CuBr2+ KMnO4+ H2SO4 →
39 KH2CrO3+ Cl2+ KOH →
40 K2Cr2O7+ N2O4+ H2O →K[Cr(OH)4(H2O)2] + ...
41 Fe2O3+ O2+ KOH →K2FeO4+ ...
42 Zn + K2Cr2O7+ KOH →
43 Cu2S + HNO3(конц.) →H2SO4+ ...
44 K2Cr2O7+ H2SO4(конц.) →CrO3+
45 PbS + HNO3(разб.) →S + ...
46 Cu2O + HNO3(разб.) →
47 KClO3+ Na2SO3 →
48 H3AsO3+ KMnO4+ H2SO4 →
49 FeSO4+ KClO3+ H2SO4 →
50 FeCO3+ KMnO4+ H2SO4 →CO2+ ...
51 Fe(OH)2+ NaBrO + H2O →
52 Zn + KClO3+ KOH + H2O →
53 KNO3+ Al + KOH + H2O →
54 MnO2+ O2+ KOH →
55 MnO2+ KBr + H2SO4 →
56 KMnO4+ SO2+ H2O →
t
57 Fe(CrO2)2(тв) + K2CO3(тв) + O2→
58 KI(тв) + H2SO4(конц.) →
59 FeSO4+ Br2+ H2SO4 →
60 FeSO4+ KClO3+ H2SO4 →
61 HIO3+ H2S →
62 (NH4)2S + K2CrO4+ KOH + H2O →
63 Na3[Cr(OH)6] + Cl2+ NaOH →
64 Na2Cr2O7+ NaNO2+ H2SO4 →
65 K2Cr2O7+ K2S + H2SO4 →
66 CrCl3+ NaClO + NaOH →
67 Fe2(SO4)3+ KI →
68 NaNO2+ Cl2+ NaOH →
69 NH3+ Cl2 →
70 PH3+ KMnO4+H2SO4 →H3PO4+
522 При нагревании KClO3 часть ее разлагается с выделением кислорода, а часть с образованием перхлората и хлорида калия. Определите массу и состав остатка, если при нагревании KClO3 массой 44,1 г выделился кислород массой 9,6 г.
523 Колба с хлорной водой массой 250 г выставлена на солнечный свет. Выделившийся газ собран, его объем оказался равным 0,112 дм3 (н.у.) Определите массовую долю (ω, %) исходного раствора хлора.
524 Определите массу бромной воды, которая необходима для окисления сульфата железа (II) массой 15,2 г в сернокислом растворе, если при 20 °С в воде массой 100,0 г растворяется бром массой 3,6 г?
525* Диоксид серы пропустили через раствор NH3 массой 180 г с массовой долей 6,8%. Определите количество образовавшейся соли, если известно, что исходным количеством диоксида серы можно восстановить дихромат натрия массой 52,4 г, подкисленного H2SO4.
526 При растворении стали, массой 3 г содержащей серу в виде сульфида, образовавшейся сероводород отогнали и поглотили раствором иода. Определите содержание серы в стали (ω, %), если с H2S прореагировало15 см3 0,01 М раствора I2.
527 При обжиге минерала, состоящего из двух элементов, получили оксид, содержащий металл (III) с массовой долей 70 % и газообразный оксид, содержащий элемент (IV) с массовой долей 50 %, который количественно реагирует с дихроматом калия массой 117,6 г в сернокислой среде. Для
восстановления металла из полученного оксида необходимо затратить алюминий массой 16,2 г. Назовите минерал, определите его массу. Ответ подтвердите расчетами.
528 Газ, полученный при сжигании сероводорода в избытке кислорода, прореагировал с 250 см3 раствора гидроксида натрия с массовой долей 25 % (ρ= 1,28 г/см3) с образованием кислой соли. Рассчитайте объем израсходованного сероводорода.
529* Смесь трех газов смешали в замкнутом сосуде и взорвали. Какая кислота образовалась при этом и какова ее концентрация (ω, %) в растворе, если известно, что первый газ получен при действии избытка раствора соляной кислоты на цинк массой 42,8 г; второй - разложением нитрата натрия массой
51,0 г и третий - при реакции взаимодействия избытка раствора соляной кислоты с диоксидом марганца массой 5,2 г?
530 Используя метод полуреакций расставьте коэффициенты в уравнениях окислительно-восстановительных реакций:
1 NaOCl + KI + H2SO4 →I2 + NaCl + K2SO4+ H2O
2 Cr2O3+ KNO3+ KOH →K2CrO4+ KNO2+ H2O
3 Fe(OH)2+ NO2 →Fe(NO3)3 + NO + H2O
4 H2S + HNO3 →H2SO4+ NO + H2O
5 KI + H2SO4(конц) →I2 + S + K2SO4+ H2O
6 NaHSO3+ Cl2+ H2O →NaHSO4+ HCl
7 FeS2+ HNO3(конц) →Fe(NO3)3+ H2SO4+ NO + H2O
531* Восстановите левую часть уравнений.
1 →2K2CrO4+ 7KCl + 5H2O;
2 →2MnSO4+ 5I2+ 6K2SO4+ 8H2O;
3 →5S + K2SO4+ 2MnSO4+ 8H2O;
4 →NO + FeCl3+ NaCl + H2O;
5 →I2+ 2KNO3+ Pb(NO3)2+ 2H2O.
532 При обжиге минерала, состоящего из двух элементов, получили оксид металла (III), содержащий кислород с массовой долей 30 % и газообразный оксид, содержащий элемент (IV) с массовой долей 50 %, который при поглощении его избытком раствора NaOH образует соль массой 50,4 г. Для восстановления оксида металла (III) необходим оксид углерода (II) объемом 6,72 дм3(н.у.). Определите формулу минерала и его массу.
533 Через раствор NaOH объемом 36,7 см3 (ω= 20 %; ρ= 1,2 г/см3) пропустили газ, полученный при взаимодействии меди массой10 г с раствором HNO3 объемом 50 см3 (ω= 81 %; ρ= 1,45 г/см3). Определить состав веществ в растворе(ω, %).