МКОУ «Туруханская средняя школа №1»
Методическое пособие
«Окислительно-восстановительные реакции в заданиях единого государственного экзамена»
Разработала:
учитель химии высшей категории,
Гуськова В.А.
2020г.
Аннотация
Любая методическая продукция в образовательном пространстве предназначена для передачи положительного педагогического опыта и направлена прежде всего на профессиональное совершенствование работы педагогов и повышение качества образовательной подготовки обучающихся.
Данное методическое пособие предназначено для обучающихся 8-11 классов, выпускников, поступающих для дальнейшего обучения в химические и медицинские ВУЗы.
В методическом пособии даны рекомендации для самостоятельной подготовки обучающихся к урокам химии, заданиям единого государственного экзамена по вопросам окислительно-восстановительных реакций. В пособие включены задания для лучшего понимания темы
Данное пособие дополняет тот объем знаний по химии, которым должен владеть обучающийся, для успешной сдачи Единого государственного экзамена.
Введение
За годы работы я поняла, что не в количестве знаний заключается образование, а в полном понимании и умелом применении всего того, что знаешь, чему учишь. Каждый раз, уходя домой, думаешь, а что будет завтра, как сделать так, чтобы твой урок запомнился? Удивить, рассмешить или, может быть, напугать? Увы, сегодня химия для многих – предмет не первостепенной важности. Как найти и подобрать то, что поможет сделать процесс обучения интересным, творческим, запоминающимся? Уверена, что только вызвав светлые чувства и положительные эмоции, можно создать комфортный климат на уроке. Одним из основных понятий при изучении химии в школе является понятие «окислительно-восстановительные реакции». Это понятие является и наиболее сложным для восприятия обучающимися.
Задача учителя при формировании любого понятия, в том числе и понятия «окислительно-восстановительные реакции»: пройти «три» основные стадии, которые обозначил Э.Кант: «Наше познание начинается с восприятия, переходит в понимание и заканчивается причиной». Это высказывание в полной мере подходит к познанию химии как науки.
Но у обучающегося, как всегда, возникает вопрос «Зачем?». И результат во многом зависит от того, смог ли учитель на первых уроках доказать ученику, что ему необходимо изучать окислительно – восстановительные реакции. При этом, на мой взгляд, учитель постоянно должен подкреплять ответами этот вопрос из урока в урок, от этапа к этапу, от темы к теме. Ребенок ничего не берет на веру, во всем он должен видеть цель своего познания.
Содержание
Введение 2
1.Методические рекомендации по работе с пособием 5
2.Сущность окислительно-восстановительных реакций 5
3.Классификация окислительно - восстановительных реакций 7-8
4.Методы составления уравнений окислительно - восстановительных реакций (алгоритм) 9-12
5.Особые случаи составления окислительно-восстановительных реакций 12-15
6.Окислительно-восстановительные реакции в органике 16 7.Заключение 16-17
8.Глоссарий 17
9.Литература 19
10.Приложение 20-24
Методические рекомендации по работе с пособием
В настоящем методическом пособии изложены наиболее трудные вопросы по окислительно-восстановительным реакциям в органической и неорганической химии, которые в курсе школьной программы изучаются недостаточно глубоко и не в том объеме, которым должен владеть обучающийся для успешной сдачи Единого государственного экзамена и вступительного экзамена в ВУЗы. В этом заключается актуальность данного методического пособия. Оно позволяет ребенку самостоятельно дополнить свои знания по окислительно-восстановительным реакциям, проверить свои знания и определить уровень своей подготовки по данной области химии.
Новизна предлагаемого пособия заключается в том, что приводятся конкретные примеры по окислительно-восстановительным реакциям как в неорганической, так и в органической химии. Необходимость создания данного пособия возникает тогда, когда ты начинаешь сталкиваться с работой в профильных классах. Как правило, выпускники профильных классов продолжают обучение в химических, медицинских, технологических, аграрных, сельскохозяйственных институтах и др., связанных с химией.
Сущность окислительно-восстановительных реакций
Существует два типа химических реакций:
Реакции, протекающие без изменения степеней окисления атомов элементов, называющиеся РИО.
2. Реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав реагирующих соединений, называются окислительно-восстановительными реакциями (ОВР).
Zn + 2HCl → ZnCl2 + H2↑ (замещения)
N2 + 3H2 ↔ 2NH3 (соединения)
2KClO3 → 2 KCl + 3O2 (разложения)
В окислительно-восстановительных реакциях происходит перераспределение электронной плотности на атомах, вследствие этого изменяется степень окисления элементов.
Процесс отдачи электронов атомом, ионом или молекулой называется окислением. При этом степень окисления атома повышается:
H20 2e → 2H+
Cu0 2e → Cu+2
2Cl1 2e → Cl20
Процесс присоединения электронов атомом, ионом или молекулой называется восстановлением. При этом степень окисления атома понижается.
O20 + 4e → 2O2
S+6 + 2e → S+4
Br20 + 2e → 2Br1
Атомы, ионы или молекулы, отдающие электроны называются восстановителями, при этом сами они окисляются. В результате окисления степень окисления восстановителя увеличивается. Восстановителями могут быть частицы в низшей или промежуточной степени окисления.
Важнейшими восстановителями являются:
все металлы в виде простых веществ, особенно активные (Na, K, Ca, Fe);
неметаллы в виде простых веществ (C, P4, S, I2);
неметаллы в низших степенях окисления – летучие водородные соединения (N3H3, H2 S2, C4H4 , HCl);
неметаллы в промежуточных степенях окисления (C+2O, N+2O, N22H4);
металлы в промежуточных положительных степенях окисления галогениды металлов, гидриды металлов, нитриды и фосфиды металлов, катионы металлов ( SnCl2, FeCl2, KH, AlH3, Na3N, Li3P, MnSO4, Cr2(SO4)3),
углеводороды и многие органические вещества (спирты, углеводы).
Атомы, ионы или молекулы, принимающие электроны называются окислителями, при этом сами они восстанавливаются. В результате восстановления степень окисления окислителя уменьшается. Окислителями могут быть частицы в высшей или промежуточной степени окисления.
Важнейшие окислители:
простые вещества-неметаллы, обладающие высокой электроотрицательностью (F2, Cl2, O2),
неметаллы в промежуточных степенях окисления пероксид водорода ( Н2О21, N22H4);
металлы в высших степенях окисления перманганаты, хроматы и дихроматы ( KMn+7O4, K2Cr+6O4, Sn+4Cl4), оксиды ( CuO , PbO2 , Ag2O);
азотная кислота и нитраты, концентрированная серная кислота, царская водка (смесь концентрированных соляной и азотной кислот) (HNO3, NaNO3, H2SO4);
галогены в высших и промежуточных степенях окисления (HClO4, HBrO4, KClO3, NaBrO3);
органические нитросоединения ( CH(NO2)3).
Определить, в каком качестве химический элемент участвует в ОВР, какое количество электронов он принимает или теряет, поможет данная схема:
о тдача электронов, окисление, ne
тдача электронов, окисление, ne












 5 4 3 2 1 0 +1 +2 +3 +4 +5 +6
5 4 3 2 1 0 +1 +2 +3 +4 +5 +6
присоединение электронов, восстановление, +nе

Классификация окислительно-восстановительных реакций
Все ОВР можно разделить на несколько групп (типов):
Межмолекулярные реакции - в которых степень окисления изменяют атомы, входящие в состав разных исходных веществ:
N20 + 3H20 ↔ 2N3H3+1
окислитель восстановитель
Внутримолекулярные реакции – в которых атомы, изменяющие степень окисления входят в состав одного соединения (реже – это атомы одного элемента в разных степенях окисления) :
2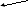
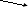 KCl+1O2 → 2KCl1 + O20
KCl+1O2 → 2KCl1 + O20
окислитель восстановитель
Реакции диспропорционирования ( самоокисления самовосстановления) – в которых атомы одного и того же элемента в определенной степени окисления являются как окислителями, так и восстановителями:
С
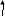

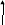 l20 + H2O = HCl1 + HCl+1O
l20 + H2O = HCl1 + HCl+1O
 окислитель
окислитель

восстановитель
Реакции диспропорционирования характерны для веществ, содержащих атомы в промежуточных степенях окисления.
Существуют также реакции смешанного типа. Например, к внутримолекулярной реакции контрпропорционирования относится реакция разложения нитрата аммония:
N


 3H4N+5O3 N+12O + 2H2O
3H4N+5O3 N+12O + 2H2O

 ОКИСЛИТЕЛЬ
ОКИСЛИТЕЛЬ
восстановитель
Методы составления уравнений окислительно-восстановительных реакций
Правильно написанное уравнение реакции является выражением законов сохранения массы веществ и зарядов. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Точно так же сумма зарядов исходных веществ должна быть равна сумме зарядов продуктов реакции.
Применяются два метода составления уравнений окислительно-восстановительных реакций: метод электронного баланса (метод Писаржевского) и метод полуреакций, или электронно-ионного баланса. Метод электронного баланса целесообразно применять, когда речь идет о реакциях, протекающих между газообразными или твердыми и газообразными веществами и реакциях в расплавах; метод электронно-ионного баланса — когда говорится о реакциях в растворах, а также реакциях с участием веществ, в которых трудно определить степени окисления элементов (например, KNСS, CH3CH2OH).
1.Метод электронного баланса
Основное требование при использовании метода электронного баланса — число отданных восстановителем электронов должно равняться числу электронов, присоединенных окислителем.
Алгоритм составления уравнений окислительно-восстановительных реакций методом электронного баланса
| Последовательность действий | Выполнение действий |
| 1.Запишите схему реакции | NH3 + O2 → H2O + NO |
| 2. В заданной схеме реакции определите степени окисления каждого химического элемента в формулах исходных веществ и продуктах реакции (если можете, то определите сразу те элементы, у которых степени окисления меняются). Подчеркните эти элементы. |
N3H3+1 + O20→ H2+1O2+ N+2O2 |
| 3. Выпишите знаки этих химических элементов с указанием исходной и конечной степеней окисления через стрелку.1 Определите окислитель и восстановитель. |
N3 → N+2 восстановитель O20 → 2O2 окислитель |
| 4. Покажите процессы отдачи электронов восстановителем и присоединения электронов окислителем. | N3 5е → N+2 окисление восстановитель O20 + 4е → 2O2 восстановление окислитель |
| 5.Составьте схему электронного баланса. Для этого между числами отданных и принятых электронов найдите наименьшее общее кратное и поделите его на число принятых и отданных электронов – найдите основные коэффициенты и вынесите их за черту слева. |  4 N3 5е → N+2 5 O20 + 4е → 2O2
Наименьшее общее кратное = 20 20 : 5 = 4 20 : 4 = 5 |
| 6. Перенесите основные коэффициенты в молекулярное уравнение и поставьте их перед окислителем и восстановителем. Оставшиеся коэффициенты подберите так: сначала перед металлами, затем перед кислотными остатками (неметаллами) и перед водородом и кислородом. |
4NH3 + 5O2 → 6H2O + 4NO
Коэффициент 6 подобрали так: в левой части атомов Н = 4 х 3 = 12, значит в правой 12: 2 = 6 |
| 7. Проверьте правильность расстановки коэффициентом, путем сравнения числа моль атомов кислорода в левой и правой частях уравнения. |
Число моль атомов кислорода: левая часть = правая часть 5 х 2 = 6 + 4 10 =10 |
| 8. Стрелку между частями уравнения замените знаком равенства (закон сохранения массы веществ выполнен). |
4NH3 + 5O2 = 6H2O + 4NO
|
1. Если окислитель или восстановитель в исходных веществах или продуктах реакции представлены двумя атомами (H2, Cl2, O2, N2O, K2Cr2O7 т.д.), то в электронных уравнениях надо брать сразу два атома. Цифру два ставят перед ионом или справа внизу (индекс) при записи молекулы.
Например: 2Н+1 +2е = Н20 , О20 + 4е = 2О-2 .
2.Метод полуреакций, или электронно-ионного баланса
Этот метод применяют для реакций, протекающих в растворах. В его основе лежит составление ионных уравнений для процесса окисления и процесса восстановления (частные уравнения) и последующее суммирование их в общее уравнение.
При составлении полуреакций соблюдают правила написания ионных уравнений:
формулы сильных электролитов записывают в виде ионов;
оксиды, гидриды, газы, осадки, средние и слабые электролиты на ионы не расписывают;
не вносят в схему ионы, не изменяющиеся в результате реакций.
При подборе стехиометрических коэффициентов уравнений ОВР этим методом необходимо учитывать кислотность среды, в которой протекает ОВР. В зависимости от характера среды число электронов, принимаемых окислителем или теряемых восстановителем, может изменяться.
При подведении материального баланса по О и Н:
в кислой среде используем только Н+ и Н2О (слева и справа);
(к окислителю добавить Н+, к восстановителю - Н2О);
в щелочной среде только ОН и Н2О (слева и справа);
(к окислителю добавить Н2О, к восстановителю - ОН);
в нейтральной среде слева только молекулы Н2О, тогда справа могут образовываться либо Н+, либо ОН.
(к окислителю добавить Н2О, к восстановителю - Н2О).
Особые случаи составления окислительно-восстановительных реакций
В некоторых ОВР одно и то же вещество может одновременно быть средой и окислителем, средой и восстановителем. Так при взаимодействии концентрированной серной и азотной кислот с металлами, кислоты выполняют функцию окислителя и среды. При взаимодействии хлороводородной кислоты с сильными окислителями (дихроматы, перманганаты и др.) кислота выполняет функцию восстановителя и среды.
В этих случаях найденные коэффициенты в схеме электронного баланса ставят в молекулярном уравнении только перед продуктом восстановления или окисления.
Окислительные свойства концентрированной серной кислоты
Химические свойства разбавленной и концентрированной серной кислоты отличаются: в разбавленной окислителем является ион Н+, в концентрированной шестивалентная сера. Общие химические свойства H2SO4 определяются ионом Н+, особые свойства наличием сульфат – иона SO42. Вывод: концентрированная серная кислота – сильный окислитель.
Состав продуктов восстановления определяется, главным образом, активностью восстановителя и концентрацией кислоты: чем большей восстановительной способностью обладает вещество, тем сильнее изменяется степень окисления серы.
Н2SO4


 S+4(SO2) S+6 S2(H2S), S0 ;S+4(SO2);
S+4(SO2) S+6 S2(H2S), S0 ;S+4(SO2);
С неметаллами. С металлами (до Н)
S+4(SO2)
С металлами после Н, кроме Au, Pt
H2SO4 (конц.) + Me = сульфат Ме + А + Н2О
где А – продукт восстановления серной кислоты (H2S, S, SO2).
Металлы – Al, Fe,Cr – пассивируются концентрированной серной кислотой на холоде (поэтому из этих металлов изготавливают цистерны для перевозки кислоты), однако при нагревании окисляются серной кислотой с образованием сульфатов этих металлов.
Примеры:
а). Серная кислота + щелочные металлы
H
 2S+6O4 + K0 → K2+1SO4 + S0↓ + H2O
2S+6O4 + K0 → K2+1SO4 + S0↓ + H2O
 среда
среда
 окислитель
окислитель
 6 K0 1e → K+1 (окисление)
6 K0 1e → K+1 (окисление)
восстановитель
1 S+6 +6e → S0 (восстановление)
Окислитель
4


 H2S+6O4 + 6K0 = 3K2+1SO4 + S0↓ + 4H2O
H2S+6O4 + 6K0 = 3K2+1SO4 + S0↓ + 4H2O
 среда
среда
окислитель

Из четырех молекул серной кислоты 1 молекула выполняет функцию окислителя, а 3 молекулы выполняют функцию среды.
в). Серная кислота + тяжелые металлы и Fe при t
t
H
 2S+6O4 + Fe0 → Fe2+3 (SO4)3 + S+4 O2↓ + H2O
2S+6O4 + Fe0 → Fe2+3 (SO4)3 + S+4 O2↓ + H2O
 Cреда
Cреда
 Окислитель
Окислитель
2 Fe0 3e → Fe+3 ( окисление)
Fe0 3e → Fe+3 ( окисление)
Восстановитель
3 S+6 + 2e → S+4 (восстановление)
Окислитель
6


 H2S+6O4 + 2Fe0 = Fe2+3 (SO4)3 + 3S+4 O2↓ + 6H2O
H2S+6O4 + 2Fe0 = Fe2+3 (SO4)3 + 3S+4 O2↓ + 6H2O
 Среда
Среда
 Окислитель
Окислитель
Из шести молекул серной кислоты 3 молекулы выполняют функцию окислителя и 3 молекулы выполняют функцию среды.
г). Серная кислота + неметаллы (C, P, S) при t
t
H2S+6O4 + C0 → S+4O2 ↑ + C+4O2 ↑ + H2O
о кислитель
кислитель
2 S+6 + 2e → S+4 (восстановление)
Окислитель
1 С0 4е → С+4 (окисление)
Восстановитель
2H2S+6O4 + C0 = 2S+4O2 ↑ + C+4O2 ↑ + 2H2O
Окислитель
2 молекулы серной кислоты выполняют только функцию окислителя.
Окислительно – восстановительные реакции в органической химии
В окислительно-восстановительных реакциях органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода, всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей.
Алкены
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Реакция этилена с перманганатом калия в нейтральной или слабощелочной среде протекает согласно уравнению:
3C2H2 = C2H2 + 2KMn+7O4 + 4H2O → 3HOC1H2C1H2OH + 2Mn+4O2 + 2KOH
 3 2C2 2e → 2C1 окисление
3 2C2 2e → 2C1 окисление
восстановитель
2 Mn+7 + 3e → Mn+4 восстановление
Oкислитель
Заключение
Я считаю, что пособие поможет обучающимся разобраться с понятиями темы. Использование представленного логического подхода, способов и методов работы над понятием будет способствовать более глубокому и осознанному восприятию материала и успешному применению его при выполнении экзаменационных заданий экзаменов как в 9 так и в 11 классе.
Сегодня перед учителем стоит не совсем простая задача — создать условия для развития творческих способностей, развивать у обучающихся стремление к творческому восприятию знаний, учить их самостоятельно мыслить, полнее реализовывать их потребности, повышать мотивацию к изучению предметов, поощрять их индивидуальные склонности и дарования. Необходимо чтобы обучающиеся научились не только отвечать на вопросы, которые ставит перед ними учитель, но и самостоятельно формулировать их для себя в процессе изучения материала.
Глоссарий
1.Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями (овр)
Окислительно-восстановительные реакции – это реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим, другими словами – это реакции, в результате которых изменяются степени окисления элементов.
2. Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций.
3. Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов.
4.Восстановитель- вещество, в состав которого входят атомы, отдающие во время химической реакции электроны.
5.Электронный баланс – метод, основанный на сравнении степеней окисления атомов в исходных веществах и продуктах ре акции и на балансировании числа электронов, смещаемых от восстановителя к окислител
Литература
Артеменко А.И. Органическая химия [Текст]: учебник для Вузов. – Москва.; Высшая школа,1980. 210 c. ISBN 5-09-003692-6
Егоров А.С. Химия [Текст]. Пособие-репетитор для поступающих в Вузы. – Ростов н/Д .; Феникс, 2001. 278 с. ISBN 5-221-03785-8
Егоров А.С. Как сдать ЕГЭ по химии на 100 баллов. – Ростов н/Д .; Феникс, 2003. 278 с. ISBN 5-222-03734-7
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии [Текст]: в 2-х томах. – Москва.; Экзамен, 2007. 370 с. ISBN 5-472-02772-1
Ушкалова В.Н., Иоанидис Н.В. Химия [Текст] . Репетитор. Конкурсные задания и ответы. – Москва.; Просвещение, 2000. 210 с. ISBN 5-09-008804-
Основы химии Интернет – учебник http://www.hemi.nsu.ru/index.htm
Решу ЕГЭ https://chem-ege.sdamgia.ru
Сетевое образовательное сообщество «Открытый класс http://www.openclass.ru/blogs/6335
ФИПИ. Открытый банк заданий. http://www.fipi.ru
| Приложение 1 |
| Типы заданий ОГЭ по химии по теме ОВР 1.В уравнении окислительно–восстановительной реакции
Cu + H2SO4 → CuSО4 + Н2О + SO2 коэффициент перед формулой восстановителя равен
1) 4 2) 3 3) 2 4) 1
2. В уравнении окислительно–восстановительной реакции NО2 + Mg → MgO + N2 коэффициент перед формулой окислителя равен 1) 4 2) 3 3) 2 4) 1
1.В химической реакции, уравнение которой SO2 + 2H2S = 3S + 2H2O
окислителем является
1) Н+1 в сероводороде 2) O–2 в оксиде серы (IV)
3) S–2 в сероводороде 4) S+4 в оксиде серы (IV)
2. Установите соответствие между схемой окислительно-восстановительной реакции и веществом-окислителем в ней. | СХЕМА РЕАКЦИИ | ОКИСЛИТЕЛЬ | | A) | 1)  | | Б) | 2)  | | B) | 3) | |
| 4) | |
| 5) | 3. Установите соответствие между схемой окислительно-восстановительной реакции и степенью окисления восстановителя в ней. | СХЕМА РЕАКЦИИ | СТЕПЕНЬ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ | | A) → | 1) 0 | | Б)  → → | 2) +1 | | B) → | 3) +2 | |
| 4) −1 | |
| 5) +6 | |
|
| |
|
| 4. Установите соответствие между схемой окислительно-восстановительной реакции и степенью окисления окислителя в ней. | СХЕМА РЕАКЦИИ | СТЕПЕНЬ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ | | A) | 1) 0 | | Б) | 2) −2 | | B) | 3) +2 | |
| 4) −4 | |
| 5) +4
| 5. Установите соответствие между схемой окислительно-восстановительной реакции и изменением степени окисления восстановителя в ней. | СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ | | A) | 1) +4 → +6 | | Б) | 2) +6 → +3 | | B) | 3) +6 → +4 | |
| 4) 0 → +4 | |
| 5) 0 → +6 | 6.Установите соответствие между схемой химической реакции и изменением степени окисления восстановителя в ней. | СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ | | A) | 1) 0 → +1 | | Б) | 2) -1 → 0 | | B) | 3) +2 → +3 | |
| 4) +3 → +2 | 7. Установите соответствие между схемой реакций и изменением степени окисления восстановителя в ней. | СХЕМА РЕАКЦИИ | | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ | | A) Б) В) | | 1) 2) 3) 4) 5) |
8. Используя метод электронного баланса, составьте уравнение реакции
P+HNO3 → H3PO4+NO2+H2O. Определите окислитель и восстановитель. Используя метод электронного баланса, составьте уравнение реакции
FeCl3+H2S → HCl+S+FeCl2 Определите окислитель и восстановитель. Используя метод электронного баланса, составьте уравнение реакции
S+HNO2 – H2SO4 + NO + H2O
Определите окислитель и восстановитель. |
Задание. Установите соответствие между схемой окислительно-восстановительной реакции и коэффициентом перед формулой восстановителя: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | | КОЭФФИЦИЕНТ |
| A ) NH3+CuO t N2+Cu+ H2O ) NH3+CuO t N2+Cu+ H2O Б ) NH3 + O2 t NO + H2O ) NH3 + O2 t NO + H2O В ) HNO3 +Cu Cu (NO3)2 +NO2+ H2O ) HNO3 +Cu Cu (NO3)2 +NO2+ H2O Г ) Li +N2 Li3N ) Li +N2 Li3N | | 1) 2 2) 6 3) 4 4) 1 5) 5 |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Задание. Установите соответствие между веществами, вступившими в реакцию, и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ | | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ |
| A ) NH3+O2 ) NH3+O2 Б ) NH3+O2 Pt ) NH3+O2 Pt B ) NO2+O2+ H2O ) NO2+O2+ H2O Г ) NH3+CuO t ) NH3+CuO t | | 1) HNO3 2) NO2+Cu+ H2O 3) N2 + H2O 4) N2+Cu+ H2O 5) NO+ H2O 6) HNO2+H2 |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
22






 тдача электронов, окисление, ne
тдача электронов, окисление, ne



 KCl+1O2 → 2KCl1 + O20
KCl+1O2 → 2KCl1 + O20

 l20 + H2O = HCl1 + HCl+1O
l20 + H2O = HCl1 + HCl+1O окислитель
окислитель 



















