|  | Государственное автономное профессиональное образовательное учреждение московской области «профессиональный КОЛЛЕДЖ «московия» |
Методическая разработка дидактических материалов преподавателя химии Дзаболовой Ирины Мурадичны
по теме
«Окислительно-восстановительные реакции»
2016г.
Методическая разработка дидактических материалов преподавателя химии Дзаболовой Ирины Мурадичны
по теме
«Окислительно-восстановительные реакции»
Данный дидактический материал по химии предназначен для использования на учебных занятиях и во внеурочное время для усвоения и закрепления знаний при изучении темы «Окислительно-восстановительные реакции».
Каждое задание дается в 10 вариантах, что дает возможность формирования у студентов прочного навыка в составлении схем электронного баланса для окислительно-восстановительных реакций и грамотной расстановки коэффициентов в предложенных уравнениях.
Самостоятельная работа при изучении темы «Окислительно-восстановительные реакции» состоит из нескольких элементов: изучение теоретического материала, выполнение контрольных и тестовых заданий по данному методическому указанию и индивидуальные консультации с преподавателем.
В результате самостоятельной работы необходимо освоить основные термины, определения, понятия и овладеть техникой химических расчетов. К выполнению контрольных и тестовых заданий следует приступать только после глубокого изучения теоретического материала и тщательного разбора примеров типовых заданий, приведенных в теоретическом разделе.

Цели:
образовательные:
Закрепить знания студентов об основных положениях теории окисления-восстановления, важнейших окислителях и восстановителях;
Совершенствовать умения определять степень окисления элемента в сложном веществе; использовать метод электронного баланса для составления окислительно-восстановительных реакций
развивающие:
Продолжить развивать у студентов умение анализировать, выделять главное, связывать уже имеющиеся знания с вновь приобретенными, обобщать изученный материал.
воспитательные:
Воспитание стремления к творческой познавательной деятельности через выполнение экспериментальных заданий.
Продолжить воспитание качеств, необходимых в профессиональной деятельности: аккуратность, точность выполнения задания, самостоятельность, ответственность за выполнение порученного задания.

Справочный материал к теме «Окислительно-восстановительные уравнения».
Степень окисления – условный заряд атома элемента в соединении, вычисленный из предположения, что оно состоит только из ионов,
или
это количество отданных или принятых электронов.
Правила определения степеней окисления элемента.
1. У свободных атомов и у простых веществ степень окисления равна 0.
2.Металлы во всех соединениях имеют положительную степень окисления (ее максимальное значение равно номеру группы):
а) у металлов главной подгруппы I группы +1; б) у металлов главной подгруппы II группы +2; в) у алюминия +3.
3. В соединениях кислород имеет степень окисления -2 ( исключения: OF2 пероксиды H2O2 , K2O2 .
4. В соединениях с неметаллами степень окисления у водорода +1, а с металлами -1.
5. В соединениях сумма степеней окисления всех атомов равна 0.
Валентность химического элемента способность образовывать определенное число химических связей.
Даже если абсолютные значения степени окисления и валентности элемента совпадают, их нельзя отождествлять.
1. Валентность, характеризующая число химических связей, не может иметь знака, а степень окисления имеет знак.
2. Валентность не может равняться нулю (по определению), степень окисления элемента может быть равна нулю.
3. Валентность не может быть дробным числом, а степень окисления элемента может выражаться дробным числом.
4. Степень окисления атома элемента может не соответствовать валентности данного элемента по абсолютному значению.
5. Степень окисления атомов химических элементов можно определять в любых веществах, а валентность имеет определенный предел применения.
Окислительно-восстановительный процесс – это процесс перехода электронов от одного элемента к другому.
Процесс восстановления – процесс принятия электронов частицей (атомом, молекулой, ионом). При восстановлении степень окисления элемента понижается.
Процесс окисления – процесс отдачи электронов данной частицей (атомом, молекулой, ионом). При окислении степень окисления элемента повышается.
Восстановители – частицы (атомы, молекулы, ионы), отдающие электроны.
Восстановители – доноры электронов (от лат. donare – дарить).
Окислители – частицы (атомы, молекулы, ионы), принимающие электроны.
Окислители – акцепторы электронов (от лат. acceptor – получатель).
процесс окисления
———————————————————→
повышение степени окисления
|—|—|—|—|—|—|—|—|—|—|—|—|—|—|—|—|→ -8 - 7 -6 -5 -4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8
Алгоритм для составления уравнений окислительно-восстановительных реакций методом электронного баланса.
1.Составить схему реакции.
2. Определить степени окисления элементов в реагентах и продуктах реакции.
3.Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов. В первом случае выполнить все последующие операции.
4. Подчеркнуть элементы, степени окисления которых изменяются.
5. Определить, какой элемент окисляется, какой – восстанавливается, и составить схемы перехода электронов в каждом случае
6. Сбалансировать число электронов между окислителем и восстановителем.
7. Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
8. Записать коэффициент перед формулой вещества, определяющего среду раствора.
9. Проверить уравнение реакции.
Метод электронного баланса уравнивания окислительно-восстановительных реакций заключается в выполнении следующего правила: число электронов, отданных всеми частицами восстановителей, всегда равно числу электронов, присоединенных всеми частицами окислителей в данной реакции.
Пример : Проиллюстрируем метод электронного баланса на примере окисления железа кислородом: 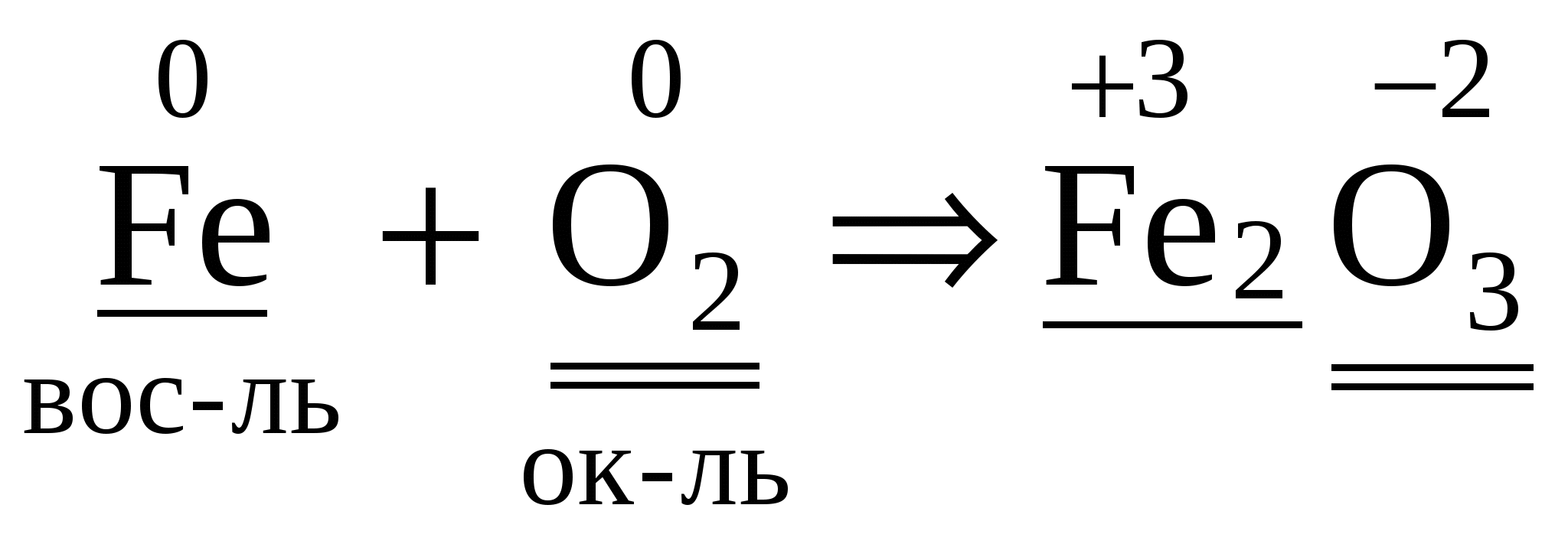 .
.
Fe0– 3ē =Fe+3 – процесс окисления;
O2+ 4ē = 2O–2– процесс восстановления.



с)


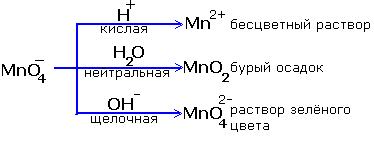





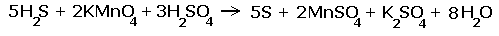
Задания для закрепления
Приложение №1
Дидактические карточки по теме «Окислительно-восстановительные реакции»
| Вариант I | Вариант II | Вариант III | Вариант IV | Вариант V |
| 1. H2 → 2H+ 2. S0 → S-2 3. Cu+2 → Cu0 4. N+3 → N+5 5. Sn+4 → Sn+2 | 1. N+5 → N+3 2. Cl2 → 2Cl- 3. Cs0 → Cs+1 4. O2 → 2O2- 5. Fe+2 → Fe+3 | 1. Mg +2 → Mg0 2. Cu0 → Cu+2 3. Cr+6→ Cr+3 4. Se0 → Se-2 5. Na+ → Na0 | 1.Al +3 → Al0 2. S+4 → S+6 3. Ni0 → Ni+2 4. Mn+7 → Mn+4 5. Ni+3 → Ni+2 | 1. S+4 → S-2 2.Cr0 → Cr+3 3.Cu+2 → Cu0 4. F02 → 2F- 5. C+4 → C+2 |
| Вариант VI | Вариант VII | Вариант VIII | Вариант IX | Вариант X |
| 1. Al+3 → Al0 2. N+4 → N+5 3. K0 → K+1 4. Mn+7→Mn+2 5. C+2 → C+4 | 1. Mn+7 → Mn+2 2. Li0 → Li+1 3. N-3 → N+5 4. C-4 → C+4 5. S-2 → S+4 | 1. O2 → 2O2- 2. Cа0 → Cа+2 3. Cr+6→ Cr+3 4. Ni+3 → Ni0 5. Mo+3 → Mo0 | 1. Al +3→ Al0 2.Si0 → Si+4 3. N-3 → N+4 4. C-4 → C+4 5. 2Cl- → Cl2 | 1. Cu+2 → Cu0 2.W+3 → W0 3. C0 → C+4 4. S0 → S-2 5. Si-4 → Si+4
|
I уровень
Задание №1. Какие из перечисленных ниже процессов представляют собой: окисление (О), какие – восстановление (В)? Определить число принятых и отданных электронов.
Задание №2.
Привести примеры окислительно-восстановительных реакций, составленных к 2-ум любым схемам заданного варианта.
Задание №3.
Определить в написанных уравнениях окислитель и восстановитель.
II уровень
Задание №1.
Написать уравнения реакций, характеризующих окислительные и восстановительные свойства простого вещества в варианте: I – серы; II – хлора; III – меди; IV – никеля; V – фтора; VI – калия; VII – лития; VIII – кислорода; IX – кремния; X – углерода.
Задание №2.
Определить в написанных уравнениях окислитель и восстановитель.
Задание №3. Составить схему перехода электронов для окислителя и восстановителя.
III уровень
Задание №1.
Написать уравнения реакций, характеризующих окислительные и восстановительные свойства простого вещества в варианте: I – серы; II – хлора; III – меди; IV – никеля; V – фтора; VI – калия; VII – лития; VIII – кислорода; IX – кремния; X – углерода.
Задание №2.
С помощью электронного баланса расставить коэффициенты в написанных уравнениях.
Задание №3.
Определить в написанных уравнениях окислитель и восстановитель.
Приложение №2
Дидактические карточки по теме «Окислительно-восстановительные реакции»
| Вариант I | Вариант II | Вариант III | Вариант IV | Вариант V |
| 1. H2 + O2 → 2. S + H2 → 3. Cu +HCl → 4. NO2 +O2 → 5. SnCl 2+ Fe → | 1. Na + H2O → 2. NaBr + Cl2 → 3.Cu + HNO3 (к) → 4. SO2 + O2 → 5. Fe + CuSO4 → | 1. Mg + N2 → 2.Cu + HNO3(к) → 3. Cr + O2 → 4. S + Al → 5. NaCl+ F2 → | 1.Al + Cr2O3 → 2. H2S + O2 → 3. Ni + CuCl2 → 4. Fe + HCl → 5. Na2S + O2 → | 1. S + O2 → 2.CH4 + O2→ 3.Al + Fe2O3 t→ 4. F2 +HBr → 5. Co + HCl → |
| Вариант VI | Вариант VII | Вариант VIII | Вариант IX | Вариант X |
| 1.Al + H2SO4 (к) → 2. NH3 + O2 Kt→ 3. KBr + Cl2 → 4. Mn2O3 + Al → 5. C2H4 + O2 → | 1. Cu +H2O → 2. Li + HNO3(р) → 3. NH3 + O2 → 4. KClO3 + S→ 5. P + HNO3 → | 1. SO2 + H2S → 2. Cа + H2O → 3. Ag NO3 → 4. Fe + H2O + O2→ 5. Al + HCl → | 1. N2 + Mg → 2.CO2 +Mg → 3. Na +H2 → 4. HCl +KMnO4 → 5.Fe + Cl2 → | 1. CuSO4 +Zn → 2.W2O3 +Al → 3. C +NO → 4. Zn +HNO3 (к) → 5. SO2 + H2S →
|
Задания к вариантам:
I уровень:
Закончить уравнения реакций. Расставить коэффициенты методом электронного баланса. Указать окислитель и восстановитель, процесс окисления и восстановления.
II уровень:
Закончить уравнения реакций. Расставить коэффициенты методом электронного баланса. Указать окислитель и восстановитель, процесс окисления и восстановления.
К какому типу относится каждая из приведенных реакций?
IIIуровень:
Закончить уравнения реакций. Расставить коэффициенты методом электронного баланса. Указать окислитель и восстановитель, процесс окисления и восстановления.
К какому типу относится каждая из приведенных реакций?
Какой коэффициент стоит перед окислителем и восстановителем в каждом уравнении варианта?
Определить сумму всех коэффициентов в каждом уравнении варианта?
Контрольная работа по теме «Окислительно-восстановительные реакции»
Вариант I
1. Степень окисления хрома в соединении, имеющем формулу K2Cr2O7 :
1) +7; 2) +4; 3) +5; 4) +6.
2.Степень окисления серы в серной кислоте равна:
1) +6 2) +4 3) -6 4) -4
3. Степень окисления марганца +7 в соединении:
1) H2MnO4 2) MnO2 3) MnSO4 4) KMnO4
4. Процесс окисления отражается схемой:
1) S+4 → S-2 2) Cr0 → Cr+3 3) Cu+2 → Cu0 4) F02 → 2F-
5. В уравнении 16 HCl +2KMnO4 → 5Сl2 + 2MnCl2 + 2KCl + 8H2O
процесс окисления отражается схемой:
1) Cl2 - 2е→ 2Cl- 2) Mn+7+ 5е → Mn+2 3) 2Cl- - 2е → Cl2 4) O2 +4е→ 2O2-
6. Сумма коэффициентов в уравнении реакции, схема которой
Al + HCl → AlCl3 + H2
равна 1) 6 2) 8 3) 10 4) 13.
7. В уравнении реакции, схема которой
Fe2O3 + H2 → Fe + H2O,
коэффициент перед формулой восстановителя равен
1) 1 2) 2 3) 3 4) 4
8. Хлор является и окислителем и восстановителем в реакции, уравнение которой:
1) MnO2 + 4HCl = MnCl2 +Cl2 + 2H2O 3) FeCl2 + Cl2 = 2FeCl3
2) Cl2 + H2O = HCl + HClO 4) 2Na + Cl2 = 2NaCl
9. Закончить уравнение реакции и расставить коэффициенты с помощью электронного баланса. Указать окислитель и восстановитель.
Cu + HNO3(к) →
10. Объем образовавшегося газа при растворении 100г меди, содержащей 10% примесей в концентрированной азотной кислоте:
1) 126л 2) 12,6л 3) 63л 4) 6,3л.
Контрольная работа по теме «Окислительно-восстановительные реакции»
Вариант II
1. Степень окисления фосфора в соединении, имеющем формулу (NH4)2HPO4:
1) +7; 2) +3; 3) +5; 4) -3.
2. Степень окисления марганца в перманганате калия равна:
1) +6 2) +4 3) +7 4) +5
3. Степень окисления серы -2 в соединении:
1) H2SO3 2) CuS 3) SO2 4) MnSO4
4. В уравнении 6KOH+3S=2K2S+K2SO4+3H2O
процесс восстановления отражается схемой:
1) 2O2-- 4е→ O2 2) S0 – 6e → S+6 3) S0 + 2e → S-2 4) K0 - e → K+1
5. Процесс восстановления отражается схемой:
1) Mn+7 → Mn+2 2) Li0 → Li+1 3) N-3 → N+5 4) C-4 → C+4
6. Сумма коэффициентов в уравнении реакции, схема которой
CO + O2→ CO2
равна 1) 3 2) 4 3) 5 4) 6.
7. В уравнении реакции, схема которой
WO3 + H2 → W + H2O,
коэффициент перед формулой восстановителя равен
1) 3 2) 2 3) 1 4) 4
8. Кремний проявляет восстановительные свойства в реакции, уравнение которой:
1) SiO2 + 2Mg = 2MgO + Si 3) Si + O2 = SiO2
2) SiO2 + 4Mg = Mg2Si + 2MgO 4) SiO2 + MgO = MgSiO3
9. Закончить уравнение реакции и расставить коэффициенты с помощью электронного баланса. Указать окислитель и восстановитель.
Fe + H2O + O2→
10. Масса гидроксида железа (III), образовавшегося при полном окислении 150 г железа, содержащего 25% примесей:
1) 215г 2) 235г 3) 23,5 4) 21,5г
Ответы к контрольной работе по теме «Окислительно-восстановительные реакции»
За каждый верный ответ в заданиях 1-8 ставится 1 балл.
| Вариант 1 | Вариант 2 |
| Номер вопроса | Верный ответ | Номер вопроса | Верный ответ |
| 1 | 4 | 1 | 3 |
| 2 | 1 | 2 | 3 |
| 3 | 4 | 3 | 2 |
| 4 | 2 | 4 | 3 |
| 5 | 3 | 5 | 1 |
| 6 | 4 | 6 | 3 |
| 7 | 3 | 7 | 1 |
| 8 | 2 | 8 | 3 |
| 9 |
| 9 |
|
| 10 | 3 | 10 | 1 |
За выполнение заданий 9- 10 может быть поставлено от 0 до 2 баллов. Если задание выполнено верно, полностью, ставится 2 балла, если допущена одна ошибка – 1 балл, если допущено более одной ошибки – 0 баллов
Решение:
Iвариант II вариант
6. 2Al + 6HCl → 2AlCl3 + 3H2 6. 2CO + O2→ 2CO2
Сумма коэффициентов 13 (4) Сумма коэффициентов 5 (3)
7. Fe2O3 + 3H2 → 2Fe + 3H2O 7. WO3 + 3H2 → W + 3H2O
3 (3) 3 (1)
9. Cu + 4HNO3(к) → Cu(NO3)2 + 2NO2 + 2H2O 9. 4Fe + 6H2O + 3O2→ 4Fe(OH)3
10. w(Cu) = 1-0,1=0,9 10. w(Fe)=1-0,25=0,75
m(Cu) = 0,9x100=90г m(Fe)=0,75x150=112,5г
n(NO2)=2 n(Cu)=2x(90/64)=2,8125моль n(Fe(OH)3)= n(Fe)= 112,5/56=2,00893 моль
V(NO2)= 2,8125x22,4= 63л (3) m(Fe(OH)3)= 2,00893x107=214,9555 215г (1)
| Количество баллов | Оценка |
| 0 - 4 | 2 (неудовлетворительно) |
| 5 -6 | 3 (удовлетворительно) |
| 7 -8 | 4 (хорошо) |
| 9 - 10 | 5 (отлично) |
Литература:
Основная литература:
Габриелян О.С, Остроумов И.Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
Габриелян О.С, Остроумов И.Г., Остроумова Е.Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю.М., Ковалева И.Б. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю.М., Ковалева И.Б. Химия для профессий и специальностей технического профиля. Электронный учебно-методический комплекс. — М., 2014.
Дополнительная литература
Габриелян О.С, Лысова Г.Г..Введенская А.Г. «Химия 11 класс: Настольная книга для учителя». Часть 1 – М.: Дрофа, 2003 год.
Габриелян О.С, Лысова Г.Г., Введенская А.Г. «Химия 11 класс: Настольная книга для учителя». Часть 2 – М.: Дрофа, 2003 год.
Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М. Практикум: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Габриелян О.С, Лысова Г.Г. Химия. Тесты, задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю.М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю. М. Сборник тестовых заданий по химии: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.