СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Методические рекомендации для выполнения практических работ для технического цикла
Методические рекомендации для выполнения практических работ для профессий и специальностей технического цикла включают технику безопасности, 28 практических работ, список литературы
Просмотр содержимого документа
«Методические рекомендации для выполнения практических работ для технического цикла»
Государственное бюджетное профессиональное образовательное учреждение
Ростовской области
«Новошахтинский автотранспортный техникум имени Вернигоренко И.Г.»
Методические рекомендации
по выполнению практических работ
Учебная дисциплина
Химия
Составлены в соответствии с требованиями Государственного стандарта и уровня подготовки обучающихся по профессиям:
23.01.07 «Машинист крана (крановщик)»
15.01.05 «Сварщик (электросварочные и газосварочные работы)»
23.01.15 «Автомеханик»
г. Новошахтинск
2015 г.
ВВЕДЕНИЕ
Дисциплина ОУДБ. 09 «Химия» является общеобразовательной дисциплиной, в процессе изучения которой обучающиеся должны приобрести знания о свойствах веществ, их превращениях, способах получения и областях применения.
Наряду с изучением теоретического материала по дисциплине «Химия» большое внимание должно быть уделено практическим занятиям. Последние представляют собой весьма важную часть в общем объеме дисциплины. Выполнение обучающимися практических работ направлено на:
- обобщение, систематизацию, углубление, закрепление полученных теоретических знаний
- формирование умений применять полученные знания на практике, реализацию единства интеллектуальной и практической деятельности;
- выработку при решении поставленных задач таких значимых качеств, как самостоятельность, ответственность, точность, творческая инициатива.
ОБЩИЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ И УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ РАБОТ
Подготовка к практической работе
Для выполнения практических работ необходимо руководствоваться следующими положениями:
1. Каждый обучающийся должен знать правила по технике безопасности при работе в химической лаборатории.
2.Внимательно ознакомиться с описанием соответствующей практической работой и установить, в чем состоит основная цель и задача этой работы.
3. По лекционному курсу или краткому изложению учебного материала в методических рекомендациях изучить теоретическую часть, относящуюся к данной работе.
Выполнение практических работ
Успешное выполнение практических работ может быть достигнуто в том случае, если обучаемый представляет себе цель выполнения практической работы. Поэтому важным условием является тщательная подготовка к работе.
Прежде чем приступить к выполнению химических опытов, обучающиеся обязаны изучить описание работы и внимательно выслушать объяснения преподавателя.
Если возникнут какие-либо затруднения, которые невозможно разрешить самостоятельно, обучающиеся должны обратиться за помощью к преподавателю.
Работая в химической лаборатории, необходимо соблюдать большую осторожность, приступать к выполнению задания после указания преподавателя, соблюдать «Правила по технике безопасности при проведении лабораторных и практических работ».
Проведя запланированный эксперимент, обучающиеся кратко записывают всё, что делали и что при этом наблюдали, то есть описывают условия протекания и признаки химических реакций. Составляют уравнение реакций, которые провели. Если в ходе опыта протекало несколько химических реакций, уравнение записывается для каждой реакции.
При необходимости зарисовывается прибор, которым пользовались обучающиеся. Рисунок должен быть четким, с пояснительными надписями.
Вывод обучающиеся формулируют после каждого опыта (или работы). Повторное описание своих действий или наблюдений не может считаться выводом.
В завершение обучающиеся письменно отвечают на вопросы.
Оформление практических работ
Оформление практических работ является важнейшим этапом выполнения. Каждую работу выполняютруководствуясь следующими положениями:
1. С новой строки указать название и порядковый номер практической работы, а также кратко сформулировать цель работы;
2. После проведения практических занятий составляется отчет о проделанной работе. Практическая работа должна быть написана разборчивым подчерком и выполнена в тетради с полями для проверки работы преподавателем.
Итогом выполнения является письменная защита работы, по вопросам которые прописаны в конце каждой работы.
СОДЕРЖАНИЕ
Введение
Правила техники безопасности при проведении практических работ
Первая помощь при несчастных случаях
Знаки, обозначающие правила техники безопасности при выполнении химических опытов, их расшифровка
Практическая работа №1 «Приготовление суспензии карбоната кальция. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем»
Практическая работа №2 «Моделирование построения периодической таблицы химических элементов»
Практическая работа № 3 «Распределение электронов по орбиталям для различных элементов»
Практическая работа №4 «Приготовление раствора заданной концентрации»
Практическая работа №5 «Исследование солей индикаторами»
Практическая работа №6 «Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами»
Практическая работа №7 «Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями. Взаимодействие кислот с солями»
Практическая работа №8 «Исследование гидролиза солей»
Практическая работа №9 «Распознавание типов химических реакций»
Практическая работа№ 10 «Окислительно-восстановительные реакции»
Практическая работа№11 «Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди(II) с серной кислотой от температуры»
Практическая работа№12 «Химическое равновесие»
Практическая работа№13 «Реакция замещения меди железом в растворе медного купороса. Реакции, идущие с образованием осадка, газа или воды»
Практическая работа № 14 «Ознакомление со структурами серого и белого чугуна. Распознавание руд железа».
Практическая работа №15 « Исследование свойств галогенов»
Практическая работа№16 «Получение газов – неметаллов (водорода, аммиака, углекислого газа)»
Практическая работа№17 «Ознакомление с коллекцией образцов нефти и продуктов ее переработки»
Практическая работа№18 «Ознакомление с коллекцией каучуков и образцами изделий из резины»
Практическая работа №19«Получение этилена и опыты с ним»
Практическая работа№20 «Растворение глицерина в воде и взаимодействие с гидроксидом меди(II)»
Практическая работа№21 «Свойства уксусной кислоты, общие со свойствами минеральных кислот»
Практическая работа№22 «Получение этилового эфира уксусной кислоты»
Практическая работа№23 «Получение мыла из жира»
Практическая работа№24 «Качественные реакции на кислородосодержащие органические вещества (Доказательство непредельного характера жидкого жира. Взаимодействие глюкозы и сахарозы с гидроксидом меди(II). Качественная реакция на крахмал)»
Практическая работа№25 «Окрашивание х/б тканей анилиновым красителем»
Практическая работа № 26«Денатурация белка. Цветные реакции белков»
Практическая работа№27 «Распознавание пластмасс»
Практическая работа№28 «Распознавание волокон»
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
ПРИ ПРОВЕДЕНИИ ПРАКТИЧЕСКИХ РАБОТ
При работе в химической лаборатории существуют общие правила, которые необходимо строго соблюдать.
1. Перед каждой лабораторной работой следует изучить по учебнику относящийся к ней теоретический материал. Тогда лабораторные занятия будут полезными и продуктивными.
2. Начинать опыты, только внимательно прочитав полное описание работы и уяснив технику ее выполнения.
3. Все лабораторные работы выполнять индивидуально или парами по указанию преподавателя.
4. Приступать к выполнению задания только после разрешения преподавателя.
5. Внимательно прочесть надпись на этикетке, прежде чем взять вещество.
6. Не брать реактивы в большем количестве, чем требуется для опыта.
7. Опыт производить всегда в чистой посуде.
8. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку.
9. Не следует путать пробки от разных склянок, а также пипетки для взятия реактивов. Чтобы внутренняя сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
10. Не уносить реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место немедленно после использования.
11. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щелочи и не переносить их на рабочее место.
12. Все опыты, сопровождающиеся выделением ядовитых летучих и дурно пахнущих веществ, проводить только в вытяжном шкафу.
13. Нагревая пробирки, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
14. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
15. Реактивы не пробовать на вкус.
16. При работе с газоотводной трубкой убирать спиртовку из-под пробирки с реакционной смесью нужно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удален из нее. В противном случае жидкость засосет в реакционную пробирку, и может произойти растрескивание пробирки.
17. Осторожно пользоваться спиртовками. Спиртовку нельзя зажигать, наклоняя ее к другой горящей спиртовке. Чтобы погасить спиртовку следует накрыть ее сверху колпачком.
18. Реактивы не брать руками. После окончания эксперимента руки тщательно вымыть.
19. Не загромождать свое рабочее место лишними предметами, содержать рабочее место в чистоте.
ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицинской помощи, – порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо немедленно обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
Основные правила первой помощи сводятся к следующему:
1. При ранении стеклом удалите осколки из раны, смажьте рану раствором иода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо раствором соды (в случае ожога кислотой), либо разбавленной уксусной кислотой (в случае ожога щелочью), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог питьевой содой и забинтовать.
4. При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды, а затем промыть разбавленным раствором питьевой соды (при попадании кислоты) или 1 % раствором борной кислоты (при попадании щелочи).
После ознакомления с правилами техники безопасности при работе в химической лаборатории каждый учащийся должен расписаться в журнале по технике безопасности.
Знаки, обозначающие правила техники безопасности
при выполнении химических опытов, их расшифровка
|
|
Запрещается брать вещество руками |
|
|
Запрещается оставлять вещества открытыми |
|
|
Едкое вещество-кислота! Разрушает и раздражает кожу, слизистые оболочки. |
|
|
Едкое вещество-щелочь! Разрушает и раздражает кожу, слизистые оболочки. |
|
|
Токсичное и физиологически опасное вещество.
|
|
|
Токсичное и физиологически опасное вещество.
|
|
|
Токсичное и физиологически опасное вещество.
|
|
|
Токсичное и физиологически опасное вещество.
|
|
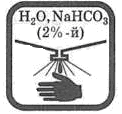
| Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды (NaHCO3).
|
|
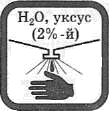
| Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором уксусной кислоты.
|
|
| Определяя вещество по запаху, не наклоняйтесь к сосуду, а направляйте к себе газ рукой, не делайте глубокого вдоха |
|
| Пробирку закрепляйте в пробиркодержателе у отверстия. |
|
| Зажигайте спиртовку спичкой. Гасите спиртовку, накрывая пламя колпачком |
|
| Нагревайте сначала всю пробирку или стеклянную пластину, затем, не вынимая ее из пламени, ту часть, где находится вещество.
|
|
| Нагревайте вещества в верхней части пламени, так как она самая горячая.
|
|
| Используйте для удерживания нагреваемых предметов (фарфоровой чашки, металлической, стеклянной и фарфоровой пластинок) тигельные щипцы.
|
|
| Используйте шпатель для твердых веществ |
|
| Перемешивание растворов в пробирке проводите быстрым энергичным встряхиванием или постукиванием.
|
|
| Для перемешивания веществ в химическом стакане используйте стеклянную палочку, на которую надет небольшой отрезок резиновой трубки, совершая ею круговые движения, чтобы не разбить дно сосуда.
|
Практическая работа №1
Тема: Приготовление суспензии карбоната кальция. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем.
Цель:Овладение умениями приготовления дисперсионных систем, навыками определения их свойств и работы с микроскопом.
Задача: Закрепить знания по теме « Строение вещества».
Реактивы и оборудование: Карбонат кальция (мел), моторное масло, вода. Химические стаканы, стеклянные палочки, микроскопы.
Теоретические основы
Дисперсные (раздробленные) системы являются гетерогенными, в отличие от истинных растворов (гомогенных). Они состоят из сплошной непрерывной фазы – дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсной фазы.
Обязательным условием существования дисперсных систем является взаимная нерастворимость диспергированного вещества и дисперсионной среды.
Дисперсные системы классифицируют:
1. по степени дисперсности;
2. по агрегатному состоянию дисперсной фазы и дисперсионной среды;
3. по интенсивности взаимодействия между ними;
4. по отсутствию или образованию структур в дисперсных системах.
В зависимости от рамеров частиц дисперсной фазы дисперсные системы бывают в виде взвесей и коллоидов.
Взвеси (размер дисперсной фазы более 100нм) ─ эмульсии, суспензии, аэрозоли.
Коллоидные растворы (размер дисперсной фазы от 1 до 100нм) – гели, золи.
Агрегатное состояние дисперсных систем бывает разным и обозначается двумя буквами.
Например: аэрозоль обозначается Г-Ж.
Г – газообразная дисперсионная среда, Ж – жидкая дисперсная фаза.
Выполнение работы
1. Приготовление суспензии мела.
В химический стакан поместите небольшое количество порошка мела и прилейте немного воды. Все тщательно перемешайте. Запишите наблюдения.
Поместите каплю, суспензии на стеклянную пластину и рассмотрите под микроскопом.
Запишите наблюдения.
Сформулируйте вывод о свойствах суспензии и схематически запишите агрегатное состояние дисперсной системы.
2. Приготовление эмульсии моторного масла.
В химический стакан поместите небольшое количество моторного масла и прилейте немного воды. Все тщательно перемешайте. Запишите наблюдения.
Поместите каплю, эмульсии на стеклянную пластину и рассмотрите под микроскопом.
Запишите наблюдения.
Сформулируйте вывод о свойствах суспензии и схематически запишите агрегатное состояние дисперсной системы.
Контрольные вопросы
1. Что такое смеси? Какими бывают смеси?
2. Выпишите в один ряд природные смеси, а в другой чистые вещества:
мел, карбонат натрия, песок, известь, оксид кремния, гидроксид натрия, мрамор, гипс, железная руда.
3. Какие смеси называются дисперсными?
4.Что показывает степень дисперсности?
5. Что такое монодисперсная и полидисперснаясистема?
6.Какие дисперсные системы называются свободнодисперсными и связнодисперсными?
7.Какие агрегатные состояния бывают у дисперсных систем, как называют и схематически записывают такие дисперсные системы?
Ответ на 7 вопрос оформите в виде таблицы:
| Название дисперсной системы | Дисперсионная среда | Дисперсная фаза | Обозначение агрегатного состояния | Примеры дисперсных систем |
|
|
|
|
|
|
Сформулируйте вывод по работе.
Практическая работа №2
Тема: Моделирование построения периодической таблицы химических элементов.
Цель: Овладение умением по моделированию периодической таблицы химических элементов.
Задача: Закрепить знания по теме «Периодический закон Д.И. Менделеева и периодическая система химических элементов».
Обеспечивающие средства: Периодическая система элементов.
Теоретические основы
Д.И. Менделеев определил, что общее у всех элементов – атомная масса. Свойства элементов зависят периодически от атомных масс. Учение о строении атомов вскрыло глубокий физический смысл периодического закона. Главной характеристикой атома является не атомная масса, а положительный заряд ядра атома. Теория строения атомовобъясняет периодическое изменение свойств элементов. Свойства химических элементов и свойства их соединений находятся в периодической зависимости от заряда ядра атома.Периодический закон записан графически в виде таблицы. Периодическая таблица химических элементов имеет горизонтальные ряды – периоды, в которых прослеживается периодичность изменения свойств элементов от металлическихсвойств к неметаллическимсвойствам. А также вертикальные ряды – группы, в которых объеденены химические элементы, соединения которых имеют сходные свойства.
При моделировании построения периодической таблицы необходимо рассмотрите периодичность изменения свойств химических элементов в ряду: H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar. Затем разбейте этот ряд на горизонтальные и вертикальные ряды согласно вопросам задания. В итоге объедините эти ряды в прямоугольную таблицу, укажите номер периода, группы, порядковый номер химического элемента.
Задание:
1. Расположите в порядке возрастания заряда ядра атома химические элементы 1,2,3 периодов.
2. Установите зависимость изменения химических свойств элементов от увеличения заряда ядра атома.
3. Расположите химические элементы в горизонтальные ряды в зависимости от увеличения заряда ядра атома и периодичности изменения свойств химических элементов.
1ряд ………..
2 ряд……….
3 ряд……….
4. Расположите химические элементы в вертикальные ряды в зависимости от числа электронов на последнем энергетическом уровне.
1 ряд 2 ряд 3 ряд
: : :
5. Постройте модель периодической таблицы для данных химических элементов. Укажите номер периода, группы и порядковый номер химического элемента.
6. Установите зависимость изменения химических свойств элементов и их соединений от заряда ядра атома в периодах и группах.
Контрольные вопросы
1 уровень
1. Какой ряд называется периодом? Какое число периодов имеет периодическая таблица?
2. Какой физический смысл имеет порядковый номер химического элемента и номер периода с точки зрения строения атома?
3. Как изменяются свойства химических элементов в группах главных подгруппахи в периодах?
4. Что объединяет химические элементы, входящие в одну группу? Какое число групп имеет периодическая таблица?
2 уровень
1.Запишите современную формулировку периодического закона.
2. Какое строение атома имеют химические элементы неметаллы и металлы?
3. Объясните, почему с ростом заряда ядра атома в периодах растут неметалические свойства элементов, а металлические уменьшаются?
4. Объясните, какой элемент Na или K обладает большими металлическими свойствами?
3 уровень
1. Какой химический элемент обладает большими неметаллическими свойствами сера или хлор, сера или кислород? Ответ сформулируйте с точки зрения строения атома и периодического закона.
2. Запишите электронные формулы строения атомов с порядковым номером 17 и 20. Какие свойства проявляют эти элементы? Какова их валентность?
Сформулируйте вывод по работе.
Практическая работа № 3
тема: «Распределение электронов по орбиталям для различных элементов»
Строение электронной оболочки атомов и ионов изображают электронной или электронно-графической формулой. Электронная формула показывает распределение электронов в атомах по энергетическим уровням и подуровням, где уровни обозначают цифрами 1,2,3,4,…, подуровни – буквами s,p,d.f. Электронно-графическая формула изображает атом элемента в виде совокупности орбитами или квантовых ячеек. На примере марганца покажем написание электронной 25Mn 1s² 2s² 2p6 3s² 3p6 3d5 4s² и электронно-графической формулы: 25Mn.
Распределение электронов в атомах по энергетическим уровням и орбиталях определяется тремя основными положениями:
Принципом Паули, который устанавливает, что в атоме не может быть 2-х электронов с одинаковым значением всех четырех квантовых чисел;
Принципом наименьшей энергии последовательность заполнения электронами уровней и подуровней должна отвечать наибольшей связи электрона с ядром, т.е. электрон должен наименьшей энергией;
Правило Хунда, согласно которому определяется порядок заполнения орбиталей. Орбитам в пределах электронного подуровня сначала заполняется все по одному электрону, затем их занимают вторые электроны.
Выполнение работы
Написать схемы распределения электронов в атомах:
Вариант № 1. Na, AI, Si, S, Ar, Ce.
Вариант № 2. K, Sc, V, Cr, As, Br, He.
Вариант № 3. Li, Cu, Ge, Se, Br, Kr, Ho.
Вариант № 4. Rb, Zn, Ti, Fe, Se, Xe, Gd.
Вариант № 5. Cs, Sr, B, O, Tc, Mo, Ne, Sm.
Вариант № 6. Fr, Ag, C, I, W, CI, Er.
Вариант № 7. H, Au, P, At, Nb, Rn, Es.
Вариант № 8. Mg, Be, V, Br, Ni, Rn, Nd.
Вариант № 9. Ba, Ti, Te, Ni, N, Ne, U.
Вариант № 10. Fr, As, Mg, Se, Co, Xe, Am.
Практическая работа №4
Тема: Приготовление раствора заданной концентрации.
Цель:Овладение навыками приготовления растворов определенной концентрации, с соблюдением правил техники безопасности.
Задача: Закрепить знания по теме « Вода. Растворы. Электролитическая диссоциация».
Реактивы и оборудование: Хлорид натрия (NaCl), 60% конценрированная серная кислота, дистиллированная вода, весы, бюксы, мерная колба (100мл).
Теоретические основы
Раствор – гомогенная система, состоящая из растворенного вещества и растворителя.
При решении задач пользуются формулами:
WР.В. = mР.В. / m Р-РА.
mр-ра = m Р.В. + mН2О
mР-РА – масса раствора, г.
mР.В. – масса растворенного вещества, г.
m Н2О – масса воды, г.
WР.В. - массовая доля растворенного вещества.
10% раствор вещества содержит 10г растворенного вещества и 90г воды в 100г раствора.
Например: Определите массовую долю растворенного вещества, если 10 г его содержится в 100 г раствора. Какая масса воды содержится в растворе.
Дано: mР.В. =10 г; mр-ра = 100 г
Найти: WР.В.; m Н2О
Решение:
1. WР.В. =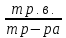 ; WР.В. =
; WР.В. = 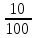 = 0,1
= 0,1
2. mн2о = mр-ра – mр.в.; mн2о = 100 – 10 = 90 г
Ответ: 0,1; 90 г
Выполнение работы
1.Приготовление 2% раствора соли.
Взвесьте в бюксе 2г хлорида натрия и пересыпьте через воронку в колбу на 100мл. Затем в колбу добавьте воды до метки. Полученный раствор имеет 2% концентрацию NaCl в 100г раствора или 0,02 массовую долю NaCl в 100г раствора.
2. Приготовление 100 мл 10% раствора серной кислоты.
Раствор готовят из 60% концентрированного раствора серной кислоты плотностью 1,5 г/мл. Для этого мензуркой отмеряют 11 мл 60% концетрированной серной кислоты и мерным цилиндром 100-11=99 мл воды. Воду выливают в колбу, а затем добавляют из мензурки кислоту. Полученный раствор содержит 0,1 массовую долю H2SO4.
Контрольные вопросы
1. Что такое растворы?
2.Из чего складывается масса раствора?
3. Как определяется массовая доля растворенного вещества в растворе?
4. Как приготовить10% раствор щелочи NaOH? Какая масса NaOH и воды содержится в таком растворе?
5. Решите задачу
1 уровень
1вариант:
Определите массовую долю растворенного вещества, если 20 г его содержится в 150 г раствора?
2 вариант:
Чему равна масса раствора, если 10г вещества растворили в100г воды?
2 уровень
1 вариант:
Определите массовую долю (%) KOH в растворе, если 40г KOH растворили в воде массой 160г.
2 вариант:
Чему равна масса растворенного вещества, если в200 г раствора массовая доля вещества составляет 0,2.
3 уровень
1 вариант:
К 200 граммам раствора, содержащего 0.3 массовые доли растворенного NaCl, добавили 100 граммов воды. Вычислите массовую долю NaCl в полученном растворе.
2 вариант:
Определите массу воды, которая содержится в растворе массой 300 г с массовой долей растворенного вещества равной 0,5?
Сформулируйте вывод по работе.
Практическая работа №5
Тема: «Исследование солей индикаторами»
Цели работы:
Научиться определять реакцию среды растворов солей различных типов.
Исследовать растворы различных солей на протекание реакций гидролиза.Отработать навыки составления уравнений реакций гидролиза.
Отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Краткие теоретические сведения.
Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией. Электролиты – вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества, имеющие ионную связь: соли, основания, полярные молекулы кисло. Классификация электролитов приведена в таблице 1. Вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока, называются неэлектролитами.
| Таблица 1. Классификация электролитов
Гидролиз соли - взаимодействие ионов соли с водой, когда образуется слабый электролит[H+] = [OH-] - среда нейтральная, [H+] [OH-] - среда кислая, [OH-] [H+] - среда щелочная. В зависимости от своего состава соли по-разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей, которые представлены в таблице 2. | |||||||||||||||||||||||||||||||||||
Таблица 2. Типы гидролиза солей
| 1. Соль образована катионом слабого основания и анионом сильной кислоты. (CuCl2, NH4Cl, Fe2(S04)3 — гидролиз по катиону) CuCl2 Cu2+ + 2Сl- Н2О Н+ + ОН- Cu2+ + 2Сl- + Н+ + ОН-CuОН+ + Н++ 2Сl- Выводы: [ Н+] [ОН-] pH среда раствора кислая окраска индикаторов изменяется | 2. Соль образована катионом сильного основания и анионом слабой кислоты. (К2С03, Na2S — гидролиз по аниону) К2С03 2К+ + С032- Н2О Н+ + ОН- 2К+ + С032-+ Н+ + ОН - НСО3-+ 2К+ + ОН- Выводы: [ Н+] -] pH 7 среда раствора щелочная окраска индикаторов изменяется |
| 3. Соль образована катионом слабого основания и анионом слабой кислоты.((NH4)2CO3, CH3COONH4,Na2CO3 — гидролиз по катиону и по аниону) Fe2 (C03)3 2Fe 3+ + 3C032- Н2О Н+ + ОН- 2Fe 3+ + 3C032-+ Н+ + ОН-Fe (ОН)3+ C02 + Н2Оидёт до конца | 4. Соль образована катионом сильного основания и анионом сильной кислоты.(гидролизу не подвергаются (NaCl, К2SО4, Ba(N03)2). NaClNa+ + Сl- Н2О Н+ + ОН- Na+ + Сl- + Н+ + ОН-Na+ + Сl- + Н+ + ОН Выводы: [ Н+] = [ОН-] pH = 7 среда раствора нейтральная окраска индикаторов не изменяется |
Приборы и реактивы:
- растворы солей: карбонат калия, карбонат натрия, нитрат калия, сульфат алюминия, сульфат железа (III), сульфат меди (II), хлорид железа (III), хлорид натрия, хлорид цинка;
- универсальная индикаторная бумажка, штатив с пробирками, предметные стёкла, пипетка, стеклянная палочка.
Порядок выполнения работы.
Опыт № 1. Испытание растворов солей индикатором. Гидролиз солей.
Ход работы: На полоску универсальной индикаторной бумаги нанести пипеткой по одной капли раствора каждой соли (из списка реактивов).
Оформление отчета: результаты наблюдений занести в таблицу №3.
Таблица 3. Определение среды растворов солей
|
Формула соли
| Цвет индикатора | Какими основаниями и кислотами
сильными () или слабыми () соль образована:
| |||
| Нейтральная | Кислая | Щелочная |
| ||
| 1. К2СО3 |
|
| синий | kt основания и an кислоты | |
| 2.Na2CO3 |
|
|
|
| |
| 3. KNO3 |
|
|
|
| |
| 4. Al2(SO4)3 |
|
|
|
| |
| 5.Fe2(SO4)3 |
|
|
|
| |
| 6.CuSO4 |
|
|
|
| |
| 7.FeCl3 |
|
|
|
| |
| 8.NaCl |
|
|
|
| |
| 9.ZnCl2 |
|
|
|
| |
Опыт № 2. Экспериментальная задача.
Ход работы:В трёх, пронумерованных, пробирках находятся растворы солей: K2SO3, Al(NO3)3, NaCl. Определите, в какой пробирке находятся данные соли.
Алгоритм проведения опыта по определению веществ:
1. Дотронуться стеклянными палочками из пронумерованных пробирок до индикаторной бумага,записать цвет индикаторной бумага и сделать заключение о реакции среды раствора.
2. Записать уравнение гидролиза предложенных солей и сделать выводы (назовите среду раствора каждой соли).
3. Сопоставить формулы солей и цвет индикаторной бумаги.
Оформление отчета: записать наблюдения и уравнение гидролиза в таблицу:
| Формулы солей | Цвет индикаторной бумаги | Уравнение гидролиза, среда раствора |
| 1. K2SO3 |
|
|
| 2. Al(NO3)3 |
|
|
| 3.NaCl. |
|
|
Выводы по работе (ответить на вопрос).
Как реакция среды растворов зависит от типов солей?
Практическая работа №6
Тема: Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами.
Цель:изучить реакцию универсального индикатора на присутствие кислоты в растворе
Оборудование:пробирка с раствором серной кислоты,пробирка с раствором гидроксида натрия, универсальный индикатор.
Краткие теоретические сведения
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Различают кислоты бескислородные (HCl, HI, H2S, HCN) и кислородсодержащие (HNO3, H2SO4, H2SO3, H3PO4).
Кислоты получают растворением кислотных оксидов в воде: P2O5 + 3H2O = 2H3PO4
или по реакции обмена соли с кислотой: Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот.
По окраске индикаторов определяют присутствие кислоты. Индикаторы лакмус и метиловый оранжевый окрашиваются растворами кислот в красный цвет.
Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Концентрированные кислоты с металлами ведут себя иначе, чем разбавленные:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой.
Последовательность выполнения работы:
1. Впробирку с раствором серной кислоты и в пробирку с гидроксидом натрия опустите универсальную индикаторную бумагу.
2. Опишите наблюдаемое явление. Записи внесите в таблицу по форме:
| Что делали | Что наблюдали | Уравнения реакций | Вывод |
|
|
|
|
|
3.Сформулируйте вывод
Контрольные вопросы:
1. Что собой представляют индикаторы?
2. Как с помощью индикатора обнаружить кислоту и щелочь в растворе?
Внимание:Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
| Что делали | Что наблюдали | Уравнения реакций | Вывод |
|
|
|
|
|
Уравнения запишите в молекулярном и ионном виде!!!
ОПЫТ 2.
1. В пустую пробирку налейте 1 мл раствора соляной кислоты и опустите гранулу цинка.
2. Опишите наблюдаемое явление
3. Сформулируйте вывод
Практическая работа №7
Тема: Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями. Взаимодействие кислот с солями
Цель:изучить реакцию нейтрализации
Оборудование:пробирки с растворами: соляной кислоты, гидроксида калия, карбоната натрия, серной кислоты, цинк в гранулах, фенолфталеин, пустые пробирки, стеклянные трубки колбы с водой.
Краткие теоретические сведения
Кислоты обладают разнообразными химическими свойствами и взаимодействуют с металлами, основаниями, солями и оксидами металлов.
Для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Реакция между кислотой и основанием называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Кислота + основание =соль +вода
Например:
H2SO4 + Ca(OH)2=CaSO4 +2 H2O
H3PO4+Fe(OH)3 =FePO4+3 H2O
2 H3PO4 +3 Ca(OH)2=Ca3(PO4)2 +6 H2O
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми
основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH.
Кислоты вступают в реакции солями. При химических реакциях кислот с солями обязательно надо учитывать основные признаки химических реакций, а именно, химическая реакция пройдёт, если будет выделяться газ, выпадет осадок, и т.д.
В реакции между карбонатами и кислотами выделяется углекислый газ CO2
Например, Nа2CO3 + 2HCl = 2NaCl + CO2 + H2O. Конечно, если говорить точно, то образуется слабая угольная кислота (H2CO3), которая сразу же распадается на углекислый газ и воду. Приведенная реакция является качественной на карбонаты.
При этих реакциях образуется соль и другая кислота (менее слабая). Таким способом в лаборатории получают многие слабые кислоты.
Результатом взаимодействия кислот с солями так же могут быть осадки: например при реакции серной кислоты с солями бария, соляной кислоты с нитратом серебра и другие. Реакции между кислотами и солями часто используют как качественные.
Последовательность выполнения работы:
Внимание:Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
| Что делали | Что наблюдали | Уравнения реакций | Вывод |
|
|
|
|
|
Уравнения запишите в молекулярном и ионном виде!!!
ОПЫТ 1.
1. В пробирку с гидроксидом калия добавьте фенолфталеин до появления малиновой окраски индикатора, затем с помощью стеклянной трубки медленно добавляйте соляную кислоту до исчезновения окраски.
2. Опишите наблюдаемое явление
3. Сформулируйте вывод
ОПЫТ 2.
1. В пробирку с раствором карбоната натрия добавьте немного раствора серной кислоты.
2. Опишите наблюдаемое явление.
3. Сформулируйте вывод
Контрольные вопросы:
1. Как называются реакции между кислотой и основанием?
2. С какой целью в реакции используется индикатор?
3. При взаимодействии соляной кислоты с какой солью образуется нерастворимое вещество?
4. Перечислите условия, при которых металлы вступают в реакцию с кислотами
Практическая работа №8
«Исследование гидролиза солей»
Оборудование: штатив с пробирками, спиртовка, держатель для пробирки, спички.
Реактивы: индикаторы, растворы солей: хлорида натрия, хлорида алюминия, ацетата натрия.
Цель: научиться самостоятельно проводить химический эксперимент, обобщить знания учащихся о классификации солей и их свойствах.
Ход работы
Задача 1.
Налейте в пробирку раствор хлорида натрия. Добавьте 1 каплю индикатора (метилоранжа).
Что наблюдаете? Полученные наблюдения запишите в таблицу.
Задача 2.
Налейте в пробирку 1-2 мл раствора хлорида алюминия, капните 1 каплю индикатора (метилоранжа). Что наблюдаете? Объясните происходящее. Напишите уравнение гидролиза.
Задача 3.
Налейте в пробирку 1-2 мл раствора хлорида алюминия, прилейте к нему 1 мл раствора сульфида натрия. Какие изменения наблюдаете? Запах какого вещества ощущается? Объясните наблюдаемые явления и запишите уравнения реакций.
Задача 4.
Налейте в пробирку 1-2 мл раствора ацетата натрия, капните 1 каплю индикатора (метилоранжа). Что наблюдаете? Объясните происходящее. Напишите уравнение гидролиза.
Задача 5.
Налейте в пробирку 1-2 мл раствора хлорида железа (III), присыпьте немного порошка цинка. Какие изменения наблюдаете? Объясните это явление и подтвердите необходимыми уравнениями реакции.
Для фиксации наблюдений используйте таблицу:
| Соли, взятые для опыта | Происходящие изменения | Анализ наблюдений. Уравнения реакций. Выводы. |
| хлорид натрия |
|
|
| хлорид алюминия |
|
|
| ацетат натрия |
|
|
| хлорид железа (III) |
|
|
Для формулирования выводов используйте ответы на следующие вопросы:
Каким основанием и какой кислотой образованы данные соли?
Что образуется при гидролизе с хлоридом алюминия и хлоридом железа (III)?
Почему индикатор меняет свой цвет в растворах солей?
Дополнительное задание.
1. Дайте характеристику следующим химическим процессам:
2С2Н2(г) + 5О2(г) 4CO2(г) + 2H2O(г) + Q;
t°
2NH3(г) N2(г) + 3H2(г) – Q.
2. Составьте молекулярные и ионные уравнения реакций между веществами:
КОН и MgCI2;
NaOH и H2SO4.
Практическая работа №9
Тема: Распознавание типов химических реакций
Цель работы: экспериментально осуществить реакции разных типов; исследовать условия и признаки химических реакций.
Оборудование и реактивы: спиртовка, спички, держатель, штатив с пробирками,, штатив лабораторный, медная проволока, малахит, железные опилки, раствор сульфата меди(II), растворсоляной кислоты, раствор гидроксида натрия, фенолфталеин.
Ход работы:
1 часть
В пробирку налейте 1 мл раствора гидроксида натрия и прибавьте 1-2 капли фенолфталеина. Что наблюдаете?
Затем приливайте по каплям раствор серной кислоты, периодически взбалтывая содержимое пробирки. Что наблюдаете? Потрогайте пробирку рукой, где находится раствор. Какой вывод можно сделать? Напишите уравнение реакции.
Ответьте на вопросы: - произойдет ли реакция нейтрализации, если приливать не кислоту к щелочи, а, наоборот, щелочь к кислоте? - к какому типу реакций относится реакция нейтрализации? По итогам проведенных опытов заполните таблицу, сделайте вывод.
Образец оформления работы:
| Что делали? | Что наблюдали? | Выводы |
| В пробирку с гидроксидом натрия прилили фенолфталеин | Индикатор окрасился в малиновый цвет | Щелочи распознаются по изменению окраски индикатора - фенолфталеина |
| К раствору щелочи прилили раствор серной кислоты | Малиновая окраска исчезла; пробирка в месте, где находится раствор разогрелась | 2NaОH + H2SO4 = Na2SO4 + H2O реакция нейтрализации относится к реакциям обмена и протекает с выделением теплоты |
Вывод: экспериментально осуществили реакцию нейтрализации, изучили условия и признаки реакции.
2 часть
1. Медную проволоку закрепить в держателе, внести в пламя спиртовки. Что наблюдаете? Укажите тип реакции, отметьте условия и признаки реакции.
2. В пробирку поместите немного малахита, закрепите пробирку в лапке лабораторного штатива, прогрейте спиртовкой и начните нагревание малахита. Что наблюдаете? Укажите тип реакции, отметьте условия и признаки реакции.
3. В пробирку налейте 2 мл раствора сульфата меди(II) и поместите в раствор железные опилки. Что наблюдаете? Укажите тип реакции, отметьте условия и признаки реакции.
По итогам проведенных опытов заполните таблицу, сделайте вывод.
Образец оформления работы
| Что делали? | Что наблюдали? | Выводы |
| Медную проволоку закрепили в держатели и внесли в пламя спиртовки | Окраска проволоки изменилась с красной на черную | Произошла химическая реакция, о чем свидетельствует изменение окраски 2Cu + O2 = 2CuO это реакция соединения |
| Нагреваем пробирку с кусочком малахита | Окраска изменилась с зеленой на черную, на стенках пробирки появились капельки воды | Произошла реакция разложения, о чем свидетельствует изменение окраски и выделение газа (CuOH)2CO3 = CO2↑ + H2O + 2CuO это реакция разложения |
| В пробирку с сульфатом меди () поместили железные опилки | Изменение окраски с серой на красную | Произошла реакция, о чем свидетельствует изменение окраски CuSO4 + Fe = FeSO4 + Cu это реакция замещения |
| В пробирку с карбонатом натрия прилили соляную кислоту | Выделение пузырьков газа | Na2CO3 + 2HCl= 2NaCl + H2O+CO2↑ это реакция обмена |
Вывод: на практике осуществили реакции изученных типов, исследовали условия и признаки химических реакций.
Практическая работа№ 10
«Окислительно-восстановительные реакции»
Цель работы:
Проделать окислительно-восстановительные реакции;
Научиться составлять уравнения окислительно- восстановительных реакций.
Оборудование: фарфоровая чашка,пробирки,реактивы.
Теоретическая часть.
Составление уравнений окислительно-восстановительных реакций методом электронно-ионного баланса.
Составить схему реакции с указанием исходных и образующих веществ; отметить элементы, изменяющие степень окисления окисления; найти окислитель и восстановитель.
Составить схемы полуреакций окисления и восстановления с указанием исходных и образующихся реально существующих в условиях реакции ионов или молекул.
Уравнять число атомов каждого элемента в левой и правой частях
полуреакций; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы Н2О, ионы Н+ или ОН-.
Избыток кислорода в кислой среде связывается ионами водорода с образованием молекул воды, а в нейтральной и щелочной – молекулами воды с образованием гидроксид-ионов, например:
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O (кислая среда),
NO3- + 6H2O + 8e- = NH3 + 9OH- (нейтральная или щелочная среда). Присоединение кислорода восстановителем осуществляется в кислой и
нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды, например:
I2 + 6H2O - 10e- = 2IO3- + 12H+ (кислая или нейтральная среда),
CrO2- + 4OH- - 3e- = CrO42- + 2H2O (щелочная среда).
Уравнять суммарное число зарядов в обеих частях каждой полуреакции.
Подобрать множители (основные коэффициенты) для поуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
Сложить уравнения полуреакций с учетом найденных основных коэффициентов.
Расставить коэффициенты в уравнении реакции.
Ход работы:
Опыт1.
К раствору KJ добавить по каплям хлорной воды ( хлорная вода — вода, насыщенная хлором). Наблюдать выделение иода и его исчезновение в результате дальнейшего окисления до JO3.
Задания:
Написать уравнения реакции выделения иода из раствора иодида калия.
Определить окислитель и восстановитель, расставить коэффициенты методом электронного баланса.
Записать наблюдения и ионное уравнение данной реакции (в
полном и сокращенном видах) Опыт №2.

Поместить в пробирку 2-3 кусочка гранулированного цинка и подействовать на него раствором РЬ(СН3СОО)2.Набдлюдать выделение кристаллов металлического свинца.
Задания:
Написать уравнение реакции вытеснения свинца из раствора его соли.
Определить окислитель и восстановитель, расставить коэффициенты методом электронного баланса.
Записать наблюдения и ионное уравнение данной реакции (в полном и сокращенном видах) .
Опыт №3

В пробирку с раствором CuSO4 внести очищенную от ржавчины железную проволочку или гвоздик. Наблюдать выделение меди.
Задания:
Написать уравнение реакции выделения меди из раствора ее соли.
Определить окислитель и восстановитель, расставить коэффициенты методом электронного баланса.
Записать наблюдения и ионное уравнение данной реакции (в полном и сокращенном видах)
Опыт 4. (групповой)

В раствор Нg(NО3)2 опустить предварительно обезжиренную промыванием в бензоле десятикопеечную монету. Наблюдать выделение ртути. (Опыт проводится поя наблюдением преподавателя.Монету,
покрытую ртутью, сдать лаборанту).
Задания:
1.Написать уравнение реакции выделения ртути из ее соли.
2.Определить окислитель и восстановитель, расставить коэффициенты методом электронно-ионного баланса.
3.Записать наблюдения и ионное уравнение данной реакции (в полном и сокращенном видах).
0пыт№5 (проводится в вытяжном шкафу).
В две пробирки положить маленькие кусочки меди, затем добавить в одну пробирку 1 мл.разбавленной азотной кислоты, а другую - по каплям концентрированную азотную кислоту. Отметить выделения газа.
Задания:
Написать уравнения реакций, взаимодействия меди с разбавленной
концентрированной азотной кислотой, учитывая, что разбавленнаяHNO3, восстанавливается медью до оксида азота (П), а концентрированная - до оксида азота (IV).
2.Определить окислитель и восстановитель, расставить коэффициенты методом электронно-ионного баланса.
3.Записать наблюдения.
Опыт №6.

6.1.Поместить в пробирку около 2 мл.разбавленной серной кислоты (среда), 2 мл. раствора Na2SO3 и 4-5 капель раствора КМnО4. Наблюдать изменения окраски раствора до полного его обесцвечивания.
6.2.К раствору КМnО4 прибавить равный объем конц. КОН, а затем по каплям добавить раствор Na2SO3. Наблюдать появление зеленой окраски.
6.3.К раствору КМnО4 добавить несколько капель расвтораNa2SO3.Наблюдать выделение бурого осадка МnО2.
На характер протекания и состав продуктов окислительно-восстановительных реакций влияет среда, в которой эта реакция осуществляется. Особенно наглядно это прослеживается в поведении перманганата калия как окислителя. В кислой среде он образует свои соли MnSO4; МnС12 (в зависимости от кислоты, взятой для подкисления).внейтральной среде восстановление КМnО4сопровождается образованиемМnО2. а в сильнощелочной среде - К2Мn04.
Задания:
Написать уравнения реакций окисления КМnО4 сульфитом натрия в кислой, щелочной и нейтральной средах.
Определить окислитель и восстановитель, расставить коэффициенты методом электронно-ионного баланса.
Записать наблюдения.
Контрольные вопросы:
Какие реакции называются окислительно-восстановительными?
Что называется степенью окисления?
Что называется окислением (восстановлением)?
Что называется окислителем (восстановителем)?
Как меняется степень окисления элемента: а) претерпевающего окисление (восстановление), б) выполняющего функцию окислителя (восстановителя)?
Какова степень окисления: а) азота в соединениях KNO3; NaNO2; N2; NH3, б) хлора в соединениях НС1; НСl; С12; НСlO4, в) хрома в соединениях СгС13;CrO3; K2Cr207; Na2Cr04.
Проставьте степени окисления атомов элементов в соединениях:
К2В4О7; CaMnO4; NaCIO4; Sn(SO4)2.
8. В следующих уравнениях реакций определите окислитель и восстановитель, их степень окисления, расставьте коэффициенты:
| Р + HNO3 + Н2О | Н3РО4 + N0 | ||
| Ni + HNO3 | | Ni(NO3)2 + NO + Н20 | |
| Аl + NaOH + Н20 | NaAlO2 + Н2 | ||
| МпО2 + КСlO3 + КОН | K2MnO4 + KCI + Н20 | ||
| NaCrO2 + Br2 + NaOH | NaBr + Na2Cr04 + Н2О | ||
| K2Mn04 + Н2О KMnO4 + MnO2 +KOH | |||
| Zn + H2SO4 | ZnSO4 + H2S + H20 | ||
Практическая работа№11
Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди(II) с серной кислотой от температуры.
Цель: Овладение умениями проведения химических реакций и навыками определения зависимости скорости химической реакции от концентрации, температуры и от природы вещества.
Оборудование и реактивы: Металлы Mg, Zn, Fe; растворы кислот 5% HCl,10% HCl, 20% HCl, H2SO4; оксид CuO (II). Штатив с пробирками, держатель, горелка, градусник.
Теоретические основы
Химические реакции происходят во времени и поэтому характеризуются той или иной скоростью. Многие химические реакции протекают мгновенно, т.е. превращение одних веществ в другие заканчивается в десятитысячные и миллионные доли секунды. Часто скорость одной и той же химической реакции изменяется в зависимости от условий.
Чтобы судить о скорости химической реакции, надо знать, как изменяется концентрация в определенные промежутки времени. Концентрацию в данном случае выражают числом молей вещества, содержащегося в одном литре раствора. Если в течение промежутка времени (t) концентрации одного из реагирующих веществ уменьшилась от С1 до С2, то средняя скорость реакции за этот промежуток времени была:
V═
Скорость химических реакций зависит от концентрации участвующих в них веществ, температуры, катализатора, природы реагирующих веществ,
величии поверхности соприкосновения веществ.
Давление влияет на скорость химических реакций не непосредственно, а
через увеличение концентрации реагирующих веществ, находящихся в
газообразном состоянии.
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ. Этот закон, открытый Гульдбергом и Ваге в 1867 голу получил название закона действующих масс.
Так для реакции: А + В = С
V ═ K[A] · [Β], где
V – скорость;
К – коэффициент пропорциональности или константа скорости,
[A] и [Β] – концентрации веществ А и В.
Константа скорости – величина постоянная для данной реакции. Она не зависит от времени и концентрации, а зависит от природы реагирующих веществ и температуры.
Известно, что многие химические процессы значительно ускоряются при повышении температуры, рост которой усиливает скорость движения молекул, увеличивая тем самым число столкновений между ними.
Как правило, в большинстве случаев повышение температуры на 100 скорость увеличивается от двух до четырех раз (правило Вант – Гоффа). Число, характеризующее ускорение реакции при нагревании на 100, называется температурным коэффициентом скорости.
Vt═ Vt1 · γ ,
где Vt1 – скорость реакции после повышения температуры до t2
Vt – начальная скорость реакции при температуры t1
γ – температурный коэффициент реакции, т.е. число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 10 градусов.
В обратимых реакциях, когда скорость прямой реакции равна скорости обратной реакции называетсяхимическим равновесием. Переход из одного состояния равновесие в другое называется смещением химического равновесия.Правило смещения химического равновесия под влиянием давления, температуры и концентрации веществ сформулировал Ле-Шателье ( принцип Ле-Шателье): Если на систему, находящуюся в равновесии, произвести внешнее воздействие, то равновесие сместится в сторону, препятствующее этому воздействию.
Выполнение работы
1. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы.
1.1. В пробирку поместите небольшое количество порошка Mg и прилейте 2мл
раствора HCl. Запишите наблюдения и химическую реакцию.
1.2. В пробирку поместите гранулу Zn и прилейте2мл раствора HCl. Запишите наблюдения и химическую реакцию.
1.3. В пробирку поместите небольшое количество опилокFe и прилейте2мл раствора HCl. Запишите наблюдения и химическую реакцию. Сформулируйте зависимость скорости химической реакции от природы вещества.
2. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации.
В три пробирки налить растворы: в первую 3мл серной кислоты, во вторую 2мл серной кислоты и 1мл воды, в третью 1мл кислоты и 2мл воды. В каждую пробирку опустить гранулу цинка.
Запишите наблюдения. Сформулируйте зависимость скорости химической реакции от концентрации реагирующих веществ.
3. Зависимость скорости взаимодействия серной кислоты с оксидом меди (II) от температуры.
В две пробирки поместите небольшое количество порошкаCuO и прилейте 2мл раствора H2SO4 в каждую пробирку. Одну из пробирок нагрейте. Запишите наблюдения и химическую реакцию. Сформулируйте зависимость скорости химической реакции от температуры реагирующих веществ.
Контрольные вопросы
1 уровень
1. Дайте определение скорости химической реакции?
2. Перечислите факторы, влияющие на скорость химической реакции.
3. Запишите выражение для скорости прямой и обратной реакции в химическом уравнении: 2SO2 + O2 ↔ 2SO3
2 уровень
1. Дайте определения закона действия масс.
2. Во сколько раз увеличится скорость в химической реакции
2SO2 + O2 ↔ 2SO3, если концентрацию реагирующих веществ увеличить в 3 раза?
3. Сформулируйте принцип Ле-Шателье.
3 уровень
1. Когда наступает химическое равновесие в обратимых реакциях?
2. Перечислите факторы, влияющие на смещение химического равновесия.
3. Определите, в какую сторону сместится равновесие в реакции
2SO2 + O2 ↔ 2SO3+Q, если увеличить давление реагирующих веществ уменьшить температуру.
Практическая работа№12
Химическое равновесие.
Цель. Закрепить понятия о химическом равновесии и условиях его смещения.
Оборудование и реактивы. Спиртовка, спички, водяная баня, газоотводная трубка-капилляр, штатив с пробирками, держатель для пробирок, санитарная склянка; хлорид натрия (р-р) и хлорид натрия (крист.), карбонат натрия (р-р) и карбонат натрия (крист.), известковая вода (Са(ОН)2), лакмус (p-p), метилоранж (р-р), едкий натр (р-р), H2SO4 (разб.), H2SO4 (конц.).
Необратимых реакций нет, любой процесс, рассматриваемый как необратимый, может быть превращен в обратимый (и наоборот). Разложение карбоната кальция:
Реакция необратима, если она осуществляется в открытой системе (т. е. где из сферы реакции возможно улетучивание оксида углерода(IV)). Однако в замкнутой системе процесс идет не полностью. Когда в системе устанавливается определенное давление газа, препятствующее разложению, процесс становится обратимым. Для обратимой реакции, записываемой в общем виде:
aA + bB = cC + dD,
скорость прямой реакции пр определяется из соотношения:
где k1 – константа скорости прямой реакции, cA и cB – молярные концентрации веществ А и В.
Концентрации веществ А и В уменьшаются, и, следовательно, скорость прямой реакции понижается. Появление в системе продуктов С и D означает возможность протекания обратного процесса, скорость которого обр математически выражается следующим образом:
По мере накопления в системе веществ С и D скорость обратного процесса непрерывно возрастает до выравнивания скоростей прямой и обратной реакций: пр =
обр. Подобное состояние системы называется химическим равновесием.
Соотношение между концентрациями при равновесии выражается формулой:
где Kp – константа равновесия, [A], [B], [C], [D] – равновесные концентрации веществ. Величина константы химического равновесия зависит от природы реагирующих веществ и от температуры. Если Kp 1, то пр
обр, если Kp пр обр.
Смещение равновесия в зависимости от изменения условий определяется универсальным принципом ЛеШателье:
если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие, выражающееся в изменении концентрации, температуры или давления, то равновесие смещается в направлении, способствующем ослаблению этого воздействия.
Пример 1. Почему лакмус (HInd) в кислой среде (избыток H3О+) – красный, а в щелочной (избыток гидратированного ОН–, рН 7) – cиний?
Решение
Уравнение диссоциации индикатора можно представить в виде:
HInd Н+ + Ind–.
В состоянии химического равновесия:
1) При избытке в растворе гидратированного Н+ (кислая среда, рН 2) Избыток ОН– (щелочная среда, рН 7) нейтрализует ионы гидроксония, т. е. уменьшает их концентрацию, что сдвигает равновесие вправо (Кр 1), в сторону накапливания гидратированных анионов индикатора синего цвета Ind–.
Пример 2. Вывести математическое выражение Кр для реакции:
2SO2 + O2 = 2SO3 + Q.
Используя численное значение Кр и принцип ЛеШателье, объяснить, как можно предсказать сдвиг равновесия вправо.
Решение
Сместить равновесие вправо можно с помощью следующих воздействий.
1) Увеличить концентрацию реагирующих веществ. Такое воздействие можно описать неравенством:
Число молекул SO2 и O2 в единице объема увеличивается, столкновения между ними становятся чаще, как следствие, концентрация SO3 тоже возрастает.
2) Уменьшить концентрацию продукта реакции. При уменьшении концентрации (отводе) SO3 результат подобен предыдущему. Новые порции исходных веществ будут реагировать для компенсации удаляемого продукта.
3) Понизить температуру. Прямая реакция – экзотермическая, поэтому для сдвига равновесия вправо систему следует охлаждать. Потерянное тепло будет восполняться вследствие усиления прямой реакции. (Наоборот, повышение температуры вызовет сдвиг равновесия влево.)
4) Повысить давление. Исходные вещества – газообразные, продукт – жидкое вещество (в виде пара). Прямая реакция идет с уменьшением объема, следовательно, увеличивая давление, мы смещаем равновесие вправо, а уменьшая – влево. Если бы реакция шла без изменения объема, то изменение давления не влияло бы на равновесие.
5) Использование катализатора не вызывает смещения равновесия. Катализатор, заметно влияющий на скорость химической реакции, равно ускоряет обе реакции – прямую и обратную.
Применение обратимых процессов в промышленности невыгодно, т. к. слишком мал практический выход продукта реакции. На практике стараются подобрать оптимальные условия для этих реакций, чтобы как можно больше сместить равновесие в нужную сторону.
| Порядок работы | Задания | Наблюдения и выводы |
| Испытать растворы щелочи и кислоты раствором метиловогооранжевого | Объяснить с точки зрения | ..... |
| Собрать два одинаковых прибора согласно схеме. В реакторе первого | Объяснить, почему в первом реакторе нет изменений, характеризующих ход химической реакции, а во втором таковые есть. Kакие они? Указать причины сдвига равновесия, записать уравнения реакций происходящих процессов | ….. |
| Используя два прибора, как и в предыдущем опыте, проверить взаимодействие сильно разбавленного раствора карбоната натрия с серной кислотой и кристаллической соли с концентрированной H2SO4. | Составить уравнения реакций | ….. |
| Использовать схему ответа, аналогичную рассмотренной в предыдущих примерах | Вывести математическое выражение Kp для реакции: | .... |
Практическая работа№13
Реакция замещения меди железом в растворе медного купороса. Реакции, идущие с образованием осадка, газа или воды.
Цель:Овладение умениями проведения различных типов химических реакций,с соблюдением правил техники безопасности.
Задача:Закрепление знаний по теме «Химические реакции».
Реактивы и оборудование: Штатив с пробирками, держатель, растворы NaOH,H2SO4,CuSO4, Na2CO3, NH4Cl, Na2SO4, ZnSO4, BaCl2, Naивода.
Теоретические основы
Необратимые реакции протекают до конца, если выполняется три условия: выпадает осадок, образуется газообразное вещество и образуется малодиссоциирующее вещество (вода).
Образование осадка.
NaCl + AgNO3 = AgCl↓ + NaNO3 молекулярное уравнение
Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ + NO3— полное ионное уравнение
Ag+ + Cl- = AgCl↓ сокращенное ионное уравнение
Образование газообразного вещества.
(NH4)2S + 2HCl = 2NH4Cl + H2S↑
2NH4+ + S2- + 2H+ + 2Cl- = 2NH4+ + 2Cl- + H2S↑
2H+ + S2- = H2S↑
Образование воды.
H2SO4 + 2KOH = K2SO4 + 2H2O
2H+ + SO42- + 2K+ + 2OH- = 2K+ + SO42- + 2H2O
2H+ + 2OH- = 2H2O
Выполнение работы.
1.Реакции, идущие с образованием газа
1.1. В пробирку поместите 2 мл раствора солиNH4Cl и прилейте такое же количество щелочи NaOH. Пробирку нагрейте до появления запаха аммиака. Запишите наблюдения и химическую реакцию.
1.2. В пробирку поместите 2 мл раствора солиNa2CO3 и прилейте 1 мл раствора
серной кислоты. Запишите наблюдения и химическую реакцию.
1.3. В пробирку поместите 2 мл воды и опустите небольшой кусочек натрия. Запишите наблюдения и химическую реакцию.
2. Реакции, идущие с образованием осадка
2.1. В пробирку поместите 2 мл раствора солиCuSO4 и прилейте 4мл раствораNaOH.
Запишите наблюдения и химическую реакцию.
2.2. В пробирку поместите 2 мл раствора солиNa2SO4 и прилейте 2 мл раствора BaCl2 до образования осадка. Запишите наблюдения и химическую реакцию.
3. Реакции, идущие с образованием воды
3.1. В пробирку поместите 2мл раствора H2SO4 и 1 каплю индикатора метилового оранжевого, затем прилейте щелочи NaOH до изменения окраски раствора. Запишите наблюдения и химическую реакцию.
3.2. В пробирку поместите 2мл раствора ZnSO4 и по капелькам до образования осадка добавьте раствор щелочи NaOH. К полученному осадку прилейте H2SO4 до его растворения. Запишите наблюдения и химическую реакцию.
Контрольные вопросы
1 уровень
1. При каких условиях возможны необратимые реакции?
2. Возможна ли реакция: HCl + KOH = H2O + KCl
2 уровень
1. Запишите типы химических реакций по имеющимся классификациям.
2. Допишите реакцию: ZnCl2 + NaOH= ? +? . Почему возможна эта необратимая реакция?
3 уровень
1. Запишите типы химических реакций по имеющимся классификациям, проделанных в лабораторной работе.
2. Запишите необратимую реакцию, которая протекает с выделением осадка.
Сформулируйте вывод по работе
Практическая работа № 14
тема: «Ознакомление со структурами серого и белого чугуна. Распознавание руд железа».
Оборудование: справочники, коллекции металлов и сплавов.
Ход работы:
Опишите физические свойства выданных металлов и сплавов (алюминий, цинк, свинец, олово, чугун), используя план:
1. агрегатное состояние при комнатной температуры
2. цвет
3. блеск
4. пластичность
5. теплопроводность, электропроводность
6. твердость (см.справочник)
7. плотность (см.справочник)
8. температура плавления и кипения (см.справочник)
Сформулируйте вывод, в котором перечислите общие физические свойства металлов.
Контрольные вопросы:
Почему в технике широко используют сплавы железа, а не чистое железо? Какие сплавы железа применяют на производстве и в быту?
Сплав железа поместили в воду, содержащую: а) кислород; б) кислород и оксид углерода (IV). В каком случае коррозия сплава буде протекать интенсивнее и почему? Напишите уравнения соответствующих реакций.
Имеются следующие сплавы: алюмель(Ni,AI,Mn,Si)
бронза(Cu,Sn,AI,Pb,Cr,Si,Be)
мельхиор(Cu,Ni,Fe,Mn)
нихром(Ni,Cr,AI,Si)
хромель(Ni,Cr,Co,Fe)
Выберите сплав, полностью растворяющийся в разбавленной серной кислоте. Напишите уравнения химических реакций.
С какой целью поверхность цистерн для хранения нефтепродуктов (бензина, керосина) окрашивают «серебрином» - смесью алюминиевой пудры с одним из растительных масел?
Практическая работа №15
Тема: Исследование свойств галогенов
Цель: закрепить знания о соединениях галогенов
Оборудование: НСl, NaCl, KBr, KI, AgNO3, Na2CO3, CuO, Zn,Cu, 9 пробирок, спиртовка, спички, держатель, индикаторная бумага.
Опыт 1. Изучение свойств соляной кислоты
А) Диссоциация соляной кислоты. В пробирку налейте 1 мл соляной кислоты и поместите туда индикаторную бумагу. Как изменилась окраска бумаги? Запишите уравнение диссоциации.
Б) Взаимодействие с металлами. В две пробирки налейте по 1 мл соляной кислоты, в одну пробирку поместите кусочек Zn, в другую медную проволоку. Осторожно нагрейте. Запишите уравнения реакций и наблюдаемые явления (признаки реакции).
В) Взаимодействие соксидами металлов. В пробирку положите небольшое количество оксида меди(II) и добавьте 1 мл соляной кислоты. Нагрейте. Какие признаки реакции наблюдаете? Запишите уравнение реакции в молекулярном и ионом виде.
Г) Взаимодействие с основаниями (щелочами) В пробирку налейте1 мл гидроксида натрия, окрасьте его фенолфталеином. Затем прилейте соляную кислоту до изменения окраски. Напишите уравнение реакции в молекулярном и ионом виде. Укажите признаки реакции.
Д) Взаимодействие с солями. В пробирку поместите небольшое количество карбоната натрия, затем осторожно прилейте 1 мл соляной кислоты. Какие признаки реакции наблюдаете? Запишите уравнение реакции в молекулярном и ионом виде.
Опыт 2. Качественные реакции на анионы галогенов.
В трех пробирках налиты по 1 мл NaCl, KBr, KI. Определите с помощью характерных реакций каждое из выданных вам веществ. Запишите уравнения реакций в молекулярном и ионом виде. Укажите признаки реакции.
Сформулируйте вывод по работе.
Практическая работа№16
«Получение газов – неметаллов (водорода, аммиака, углекислого газа)»
Цель:Развитие навыков получения, собирания и распознавания водорода, аммиака, углекислого газа.
Задача:Закрепление знаний по теме «Металлы и неметаллы».
Реактивы и оборудование: Штативы, пробирки с газоотводными трубками, держатели, спички, сосуд с водой. Растворы HCl, NaOH, Ca(OH)2; CaCO3 (мрамор), NH4Cl, универсальная лакмусовая бумажка.
Теоретические основы
Водород – бесцветный газ, без запаха. В 14,4 раза легче воздуха, обладает наибольшей диффузионной способностью, а отсюда и высокой теплопроводностью. Плохо растворяется в воде, но может растворяться в некоторых металлах.
В лаборатории водород получают:
взаимодействием цинка с разбавленной хлороводородной кислотой:
Zn + 2HCl = ZnCl2 + H2
растворением алюминия в щелочах:
2Al +2NaOH + H2O = 2NaAlO2 + 3H2
Кислород – бесцветный газ, не имеет вкуса и запаха, немного тяжелее воздуха,малорастворим в воде.
В лаборатории кислород получают:
2KCl = 2KCl + 3O2
2KMnO4 = K2MnO4 + MnO2 + O2
Оксид углерода (IV) – бесцветный, негорючий газ, тяжелее воздуха, в воде растворяется незначительно. В твердом состоянии легко получается путем испарения жидкой СО2 , находящейся под давлением. Твердая СО2 называется сухим людом.
Оксид углерода (IV) (углекислый газ) можно получить:
При горении угля в избытке кислорода:
С + О2 = СО2
При разложении карбонатов и гидрокарбонатов:
СаСО3 = СО2 + СаО
Действием на карбонат хлороводородной кислоты:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
При действии метана с водяным паром и кислородом:
2СН4 + 2Н2О + О2 = 2СО2 + 4Н2
Аммиак – бесцветный газ, легче водуха, с резким запахом,хорошо растворим в воде с образованием щелочи:
NH3 + H2O = NH4OH
Аммиак в лаборатории получают:
Действием на хлорид аммония щелочью при нагревании:
NH4Cl + NaOH = NaCl + NH3↑ + H2O
При нагревании гидроксида аммония:
NH4OH → NH3↑ + H2O
Выполнение работы
1. Получение, собирание и распознавание водорода.
В пробирку с притертой крышкой и газоотводной трубкой поместите несколько гранул Zn и прилейте 4 мл раствора HCl. Соберите выделяющийся газ водород методом вытеснения из воды, для этого поместите пробирку в сосуд с водой и введите в нее газоотводную трубку. Для распознавания водорода поднесите к отверстию газоотводной трубки горящую лучину.
Произойдет хлопок. Запишите наблюдения и химические реакции.
2. Получение, собирание и распознавание углекислого газа.
В пробирку с притертой крышкой и газоотводной трубкой поместите несколько кусочков мрамора (CaCO3) и прилейте 4мл раствора HCl. Соберите выделяющийся газ методом вытеснения воздуха, для этого газоотводную трубку поместите в другую пробирку. Газ соберется на дне пробирки. Для распознавания CO2 в пробирку с собранным газом внесите горящую лучинку, она должна потухнуть. А так же пропустите выделяющийся газ через раствор Ca(OH)2 ,раствор станет мутным. Запишите наблюдения и химические реакции.
3. Получение, собирание и распознавание аммиака.
В пробирку с притертой крышкой и газоотводной трубкой поместите сухую соль хлорида аммония (NH4Cl) и прилейте 2мл раствораNaOH. Соберите выделяющийся газ методом вытеснения воздуха, для этого газоотводную трубку поместите в другую пробирку с перевернутым дном. Для распознавания NH3 поместите пробирку с собранным газом в сосуд с водой. Вода наполнит пробирку, в полученный раствор внесите лакмусовую бумажку. Лакмусовая бумажка станет синей, так как образовался раствор аммиака (NH4OH)и появится резкий запах. Запишите наблюдения и химические реакции.
Сделайте вывод по работе.
Контрольные вопросы
1. Каким способом собирают газ водород? Почему?
2. Каким способом собирают углекислый газ CO2? Почему?
3. Каким способом собирают газ аммиак? Почему?
4. Какие из полученных газов хорошо растворяются в воде, и какие вещества при этом образуются?
5. Зарисуйте схемы приборов для получения газов.
6. Решите задачу
1 уровень
Какой объем водорода при н.у. выделится при взаимодействии 64 г цинка с серной кислотой?
2уровень
При взаимодействии с 53,5г хлорида аммония с гидроксидом натрия выделился газ среким запахом и вода. Определите оъем газа при н.у. и объм воды?
3 уровень
При взаимодействии 110г известняка, содержащего 0,9 массовых долей карбоната кальция с соляной кислотой выделился газ. Определите объем газа при н.у.
Практическая работа№17
Тема:
Ознакомление с коллекцией образцов нефти и продуктов ее переработки.
Цель: На основе коллекционного материала ознакомиться cобразцами нефти и продуктами ее переработки,
Задача: Закрепить знания по теме «Углеводороды и их природные источники».
Оборудование: Коллекции: «Нефть и продукты ее переработки», Учебное пособие Габриелян О.С. «Химия»
Теоретические основы
Природными источникамиразличных углеводородов являются нефть, уголь, природный газ. Все перечисленное является источником получения энергии, а так же важнейшим химическим сырьем.
Нефть – это жидкий, горючий маслообразный минерал, имеющий окраску от светло-желтой до темно-коричневой,легче воды и практически в ней нерастворима. Нефть состоит из алканов, циклоалканов и ароматических углеводородов.
Выполнение работы
1. Ознакомление с коллекцией «Нефть и продукты ее переработки».
Рассмотрите коллекцию. Запишите образцы нефти и их отличие по составу. Запишите продукты переработки нефти и их применение.
Данные наблюдений занесите в таблицу.
| Образцы | Физические свойства | Применение |
| 1.Нефть 1.1. |
|
|
Контрольные вопросы
1. Какие углеводороды входят в состав нефти?
2. Какие существуют методы переработки нефти?
3. Перечислите фракции перегонки нефти?
Сформулируйте вывод по работе.
Практическая работа№18
Тема:
Ознакомление с коллекцией каучуков и образцами изделий из резины.
Цель: На основе коллекционного материала ознакомиться cобразцами нефти, угля и продуктами их переработки, каучуками и образцами изделий из резины.
Задача: Закрепить знания по теме «Углеводороды и их природные источники».
Оборудование: Коллекции: «Каучуки и образцы изделий из резины», Учебное пособие Габриелян О.С. «Химия»
Теоретические основы
Каучуки – эластичные материалы, из которых путем специальной обработки получают резину. Сырой каучук липок, непрочен, а при небольшом понижении температуры становится хрупким. Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации – вводят в него серу и нагревают. Вулканизированный каучук называется резиной.
Натуральный каучук (НК) представляет высокомолекулярное соединение - полимер формула которого ( -СН2 – С = СН – СН2 -)n
/
CH3
Синтетические каучуки (СК) производят разного вида.
СКБ – продукт совместной полимеризации бутадиена с другими непредельнми углеводородами.
Формула СК ( - СН2 – СН = СН – СН2 - )n
Выполнение работы
1. Ознакомление с коллекцией «Каучуки и образцы изделий из резины».
Рассмотрите коллекцию. Запишите образцы каучуков и их отличие по составу. Запишите образцы изделий из резины и их применение.
Данные наблюдений занесите в таблицу.
| Образцы | Физические свойства | Применение |
| 1. Каучук 1.1. |
|
|
Контрольные вопросы
1. К каким органическим соединениям относятся каучуки?
2. Какие бывают синтетические каучуки?
3. На какие группы делятся каучуки по их назначению?
Сформулируйте вывод по работе.
Практическая работа №19
Тема:«Получение этилена и опыты с ним»
Цель работы:научиться получать этилен в лаборатории и научиться проводить качественные реакции на непредельные углеводороды этиленового ряда.
Запишите в тетради тему практической работы. Затем последовательно зафиксируйте в тетради каждый опыт по алгоритму:
записать название опыта;
открыть по ссылке электронный ресурс;
ознакомиться с описанием опыта, кратко записать ход опыта и уравнение реакции;
просмотреть видеоролик, записать признаки реакции;
сделать вывод о реакционной способности вещества или о способах получения.
Опыт 1. Поучение этилена из этилового спирта
http://files.school-collection.edu.ru/dlrstore/e659f378-5a0f-07e2-5491-fe1ca9d05442/index.htm
Опыт 2. Взаимодействие этилена с бромной водой
http://files.school-collection.edu.ru/dlrstore/e920f54f-3088-7973-829d-909ad427fbc8/index.htm
Опыт 3. Взаимодействие этилена с раствором перманганата калия
http://files.school-collection.edu.ru/dlrstore/a2fde3eb-37b0-b327-af25-099e3fa00573/index.htm
Сделайте вывод о реакционной способности алкенов.
Вывод:
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
Сформулируйте вывод по работе.
Практическая работа№20
Тема: Растворение глицерина в воде и взаимодействие с гидроксидом меди(II).
Цель: Провести реакцииполучения глицерата меди.
Ход работы
Опыт № 1 Получение глицерата меди
В пробирку налейте около 1 мл 10% -ного раствора сульфата меди(II) и добавьте немного 10% -ного раствора гидроксида натрия до образования голубого осадка гидроксида меди(II).
К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета.
Вопросы к опыту:
1. Какая реакция лежит в основе получения гидроксида меди(II)? Напишите уравнение этой реакции.
2. Почему при добавлении глицерина к осадку гидроксида меди(II) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(II).
3. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(II)?
Опыт № 2 Растворение глицерина в воде
В пробирку налейте 2-3 мл воды и добавьте глицерин. Отметьте, что происходит с глицерином. Встряхните пробирку и зафиксируйте изменения.
Сформулируйте вывод по работе.
Практическая работа№21
Свойства уксусной кислоты, общие со свойствами минеральных кислот.
Цель работы:
Изучить свойства уксусной кислоты; закрепить знания о карбоновых кислотах,
Реактивы и оборудование:
ацетат натрия, серная кислота (конц.), магний (порошок), цинк, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, гидроксид натрия, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
спиртовка, водяная баня, колба с обратным холодильником, стеклянная палочка, химические стаканы; концентрированная серная кислота,
конические колбы с пробками, мерные цилиндры, пробирки, разбавленные растворы соляной или серной кислот,
металлический штатив, спиртовка, газоотводная трубка с пробкой, пробирки, химический стакан, ватный тампон, тертый кирпич;
Ход работы
Напишите возможные изомеры для соединений с формулой С5Н10О2
С какими из перечисленных веществ будет реагировать уксусная кислота: оксид магния, гидроксид алюминия, сульфат бария, карбонат калия, формиат натрия, цинк? Запишите уравнения возможных реакций.
Как осуществить превращения: этан – этилен – ацетилен – ацетальдегид – уксусная кислота – метиловый эфир уксусной кислоты.
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Взаимодействие уксусной кислоты с металлами.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с металлами»
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа№22
«Получение этилового эфира уксусной кислоты»
Цель работы:
1. Закрепить знания о карбоновых кислотах,
Получить этиловый эфир уксусной кислоты, исследовать его физические свойства.
Реактивы и оборудование:
1. уксусная кислота, спиртовка, пробирку, вата, спички, изоамиловый спирт.
2.спиртовка, колба с обратным холодильником, стеклянная палочка, химические стаканы; изоамиловый спирт, концентрированная уксусная кислота, концентрированная серная кислота
3.конические колбы с пробками, мерные цилиндры,
4.металлический штатив, спиртовка, газоотводная трубка с пробкой, пробирки, химический стакан, ватный тампон, тертый кирпич;
Ход работы
Запишите уравнение этерификации пропанола и масляной кислоты.
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение изоамилового эфира уксусной кислоты, исследование его физических свойств.
Соберите прибор, как показано на рис. 10. В пробиркуА налейте 2 мл смеси этилового спирта, уксусной и серной кислот и для равномерного кипения жидкости добавьте немного тертого кирпича. ПробиркуА с помощью пробки с газоотводной трубкой присоедините к пробирке Б. В пробирку Б налейте 2‑3 мл насыщенного раствора хлорида натрия. ПробиркуБ поместите в химический стакан с холодной водой и кусочками льда. Отверстие пробирки закройте ватным тампоном.
Реакционную смесь нагревайте в пробирке на слабом пламени спиртовки. При этом можно заметить, что в пробиркеБ образуется тонкий слой эфира на поверхности раствора. Закончив нагревание, выньте ватный тампон. Ощущается ли запах эфира?
Задания: 1. Зарисуйте прибор, указав содержимое пробирокА и Б.
2. Напишите уравнение протекающей реакции, отметьте наблюдения.
3. Какова роль серной кислоты в реакции этерификации?
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа№23
Получение мыла из жира.
Цель работы:
1.Сравнить свойства мыла и синтетических моющих средств.
Реактивы и оборудование:
1.спиртовка, водяная баня, колба с обратным холодильником, стеклянная палочка, химические стаканы; твердый жир, 15 % спиртовой раствор щелочи, насыщенный раствор поваренной соли, 5 % раствор соды, раствор мыла, раствор белка, бензин, толуол, 5 % раствор КОН, 5 % раствор Na2CO3.
2.конические колбы с пробками, мерные цилиндры, навески мыла и синтетического моющего средства, пробирки, разбавленные растворы соляной или серной кислот, раствор гидроксида натрия или калия, раствор ацетата свинца, сульфат меди (II), фенолфталеин, жесткая вода.
Ход работы
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Омыление жиров в водно-спиртовом растворе.
Соберите прибор, как показано на рис. 9. В круглодонную колбу вместимостью 20 мл поместите 3-4 г измельченного твердого жира и налейте 8 мл 15 % спиртового раствора NaOH.
Перемешайте смесь стеклянной палочкой, колбу со смесью закройте обратным холодильником, опустите в водяную баню, закрепив в лапке штатива, нагрейте в течение 15-20 минут. Омыление жира следует проводить до тех пор, пока содержимое колбы не станет однородным. Оно обычно заканчивается образованием плотной твердой пленки на дне колбы. Затем колбу извлеките из водяной бани, дайте ей остыть, и добавьте в нее воды, хорошо взболтайте. Сравните растворимость полученного вещества с растворимостью жира, из которого оно было получено.
Задания:
1. Составьте уравнение реакции щелочного омыления твердого тристеарина, укажите условия ее протекания и наблюдения.
2. Как доказать, что продуктом данной реакции является мыло?
Опыт 2. Сравнение свойств мыла и синтетических моющих средств.
а) Влейте по 2-3 мл растворов мыла и СМС в пробирки, добавьте к ним 2‑3 капли раствора фенолфталеина. Каков цвет раствора? Почему?
Задания:
1. Напишите уравнение реакции гидролиза мыла, запишите наблюдения.
2. Ответьте на вопросы, поставленные в тексте эксперимента.
б) В 2 пробирки влейте по 4-5 мл жесткой воды, содержащей ионы Са2+ и Mg2+. В первую пробирку при встряхивании добавьте раствор мыла, во вторую – раствор синтетического моющего средства. В каком случае приходится прибавлять больше раствора до образования устойчивой пены? Какой препарат не утрачивает моющего действия в жесткой воде? Почему?
Задания:
1. Напишите уравнение реакции, происходящей в растворе мыла.
2. Запишите наблюдения явлений, происходящих в обеих пробирках, объясните их причину.
На основании проделанных опытов сделайте вывод о преимуществах и недостатках мыла и СМС.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа№24
Качественные реакции на кислородосодержащие органические вещества (Доказательство непредельного характера жидкого жира. Взаимодействие глюкозы и сахарозы с гидроксидом меди(II). Качественная реакция на крахмал)
Цель работы:Исследовать химические свойства углеводов и объяснить причины, обуславливающие эти свойства.
Оборудование и реактивы:металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; 1 % раствор глюкозы, 1 % растворы сахарозы, лактозы, фруктозы; крахмал, спиртовой раствор иода, раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5), аммиачный раствор оксида серебра (I).
Ход работы:
ОПЫТ 1. Свойства глюкозы.
Внесите в пробирку 3 капли раствора глюкозы, одну каплю раствора соли меди и прибавьте при взбалтывании несколько капель гидроксида натрия до образования светло-синего раствора (щелочь должна быть в избытке). Что доказывает появление такой окраски раствора? Вспомните реакцию образования глицерата меди.
Полученный раствор нагрейте. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
Задания:
1. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при комнатной температуре. Укажите наблюдения. На наличие каких функциональных групп указывает эта реакция?
2. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при нагревании. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
ОПЫТ 2. Взаимодействие сахаров с гидроксидом меди (II).
Опыт проводят одновременно с растворами различных сахаров.
К 2 мл раствора сахара добавьте 1 мл разбавленного раствора щелочи и 3‑4 капли раствора сульфата меди (II). Встряхните пробирку и перемешайте содержимое пробирки стеклянной палочкой до растворения осадка. Жидкость при этом окрашивается в интенсивно-синий цвет.
Затем поместите все пробирки в нагретую водяную баню. Если сахар окисляется, то, вынув пробирку через 2-3 минуты, вы увидите изменения окраски и появление красного или коричневого осадка.
Задание: Заполните следующие таблицы:
Результаты опыта, проведенного при нормальных условиях
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
Результаты опыта, проведенного при нагревании
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
ОПЫТ 3. Взаимодействие сахаров с аммиачным раствором оксида серебра (I).
Опыт проводят одновременно с растворами различных сахаров.
Налейте в тщательно вымытые и высушенные пробирки по 1 мл аммиачного раствора оксида серебра (I) и по 1 мл раствора сахара. Пробирки поместите на несколько минут в горячую водяную баню.
ОПЫТ4. Качественная реакция на крахмал.
В пробирку поместите небольшое количество порошка крахмала и прилейте 4мл воды все перемешайте стеклянной палочкой и нагрейте до кипения. Полученный крахмальный клейстер остудите, и добавьте 1 каплю раствора иода. Запишите наблюдения.
Задание: Заполните следующую таблицу:
Результаты опыта, проведенного при нагревании
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
Запишите уравнение соответствующей реакции для глюкозы.
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа № 26
«Денатурация белка. Цветные реакции белков»
Цель работы:
1. Изучить химические свойства белков.
2. Выполнить и запомнить качественные реакции на белки.
Оборудование и реактивы:спиртовка, держатель для пробирок, пробирки, раствор гидроксида натрия (10-12 %), раствор сульфата меди (II) (0,5 моль/л), водный раствор яичного белка (готовится из расчета 1 мл белка на 5 мл насыщенного раствора поваренной соли), насыщенный раствор ацетата свинца, насыщенный раствор сульфата меди (II), концентрированная азотная кислота, концентрированная соляная кислота, концентрированная серная кислота, насыщенный раствор сульфата аммония, этиловый спирт, концентрированный раствор гидроксида натрия, концентрированный раствор аммиака, раствор ацетата свинца (0,5 моль/л).
ХОД РАБОТЫ
ОПЫТ 1. Свертывание белков при нагревании.
2-3 мл раствора белка налейте в пробирку и нагрейте в пламени спиртовки до кипения. Что при этом наблюдается? Чем можно объяснить это явление? Содержимое пробирки разбавьте водой. Растворяется ли осадок, если нет, то почему?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 2. Осаждение белков солями тяжелых металлов.
В две пробирки налейте по 1-2 мл раствора белка и медленно, по каплям, при встряхивании прилейте в одну из них насыщенный раствор сульфата меди (II), а в другую – насыщенный раствор ацетата свинца. Что наблюдается? Затем содержимое пробирок разбавьте большим количеством воды. Что наблюдается при этом?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод о действии солей тяжелых металлов на белок.
ОПЫТ 3. Осаждение белков минеральными кислотами.
Налейте в одну пробирку 1 мл концентрированной азотной кислоты, в другую – 1 мл концентрированной соляной кислоты, в третью – 1 мл концентрированной серной кислоты. Каждую пробирку наклоните и осторожно влейте в нее по стенке 1-1,5 мл раствора белка так, чтобы он не смешивался с более тяжелым слоем кислоты, затем пробирку поставьте в штатив. Что наблюдается на границе раздела двух жидкостей?
Затем пробирки встряхните. Какие изменения происходят при этом в пробирках?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод об отношении белка к концентрированным кислотам.
ОПЫТ 4. Высаливание белков сульфатом аммония.
В пробирку налейте 1-1,5 мл раствора белка, прилейте равный объем насыщенного раствора сульфата аммония. Смесь слегка встряхните. Что наблюдается? Что происходит с белком?
Смесь разбавьте большим количеством воды. Что происходит с осадком? Какой вид свертывания белка наблюдается?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 5. Осаждение белков этиловым спиртом.
В пробирку налейте 1-1,5 мл раствора белка, прилейте 2-3 мл этанола. Что наблюдается? Проверьте, растворяется ли осадок в воде. Какой вид свертывания белка наблюдается?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 6. Цветные реакции на белки.
а) Ксантопротеиновая реакция.
К 1 мл раствора белка добавьте 5-6 капель концентрированной азотной кислоты до появления белого осадка или мути от свертывания белка. Реакционную смесь нагрейте до окрашивания осадка в желтый цвет. В процессе гидролиза, происходящем при этом, осадок может частично растворяться. Смесь охладите и добавьте к ней осторожно, по каплям, избыток концентрированного раствора аммиака. Окраска при этом переходит в оранжевую. Данная реакция является качественной на белки.
Задания:
1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
б) Биуретовая реакция.
В пробирку налейте 1-2 мл раствора белка, равный объем концентрированного раствора щелочи и 2-3 капли разбавленного раствора сульфата меди (II). Содержимое пробирки тщательно перемешайте. Жидкость при этом окрашивается в ярко-фиолетовый цвет. Эта реакция также является качественной на белки.
Задания:
1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
в) Сульфгидрильная реакция.
В пробирку налейте 0,5 мл раствора ацетата свинца и 2 мл раствора гидроксида натрия до растворения образовавшегося осадка гидроксида свинца (II). В результате получается плюмбит натрия Na2PbO2. В другую пробирку налейте 2 мл белка и прилейте из первой пробирки столько же плюмбита натрия.
Смесь нагрейте до кипения. При нагревании белок гидролизуется, и образуется сероводород, который вступает во взаимодействие с раствором Na2PbO2 с образованием черного или черно-коричневого осадка сульфида свинца PbS.
Задания:
1. Запишите все соответствующие наблюдения.
2. Напишите уравнения реакций образования гидроксида свинца (II) и плюмбита натрия.
3. Что позволяет обнаружить данная реакция в белке?
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа№27
«Распознавание пластмасс»
Цель:Ознакомление на основе коллекционного материала с образцами пластмасс.
Задача: Закрепить знания по теме «Азотсодержащие органические соединения. Полимеры».
Обеспечивающие средства: Коллекция « Пластмассы».
Теоретические основы
Пластмассами называют материалы, изготавливаемые на основе полимеров, способные приобретать при нагревании заданную форму и сохранять ее после охлаждения.
Пластмассы бывают:
Термопластичные полимерыпри нагревании размягчаются и в этом состоянии легко изменяют форму. При охлаждении они снова затвердевают и сохраняют приданную форму. При следующем нагревании они снова размягчаются, придают новую форму.
Термореактивные полимеры при нагревании сначала становятся пластичными, но затем утрачивают пластичность, становятся неплавкими и нерастворимыми, так как в них происходит химическое взаимодействие между линейными макромолекулами, образует пространственная структура полимера.
| Пластмассы | |
| Термопластичные: полиэтилен; поливинилхлорид; полистирол; полиметилметакрилат | Термореактивные: фенолформальдегидные; мочевиноформальдегидные; целлулоид |
1. Ознакомление с коллекциями образцов пластмасс.
Рассмотрите коллекции «Пластмассы» Запишите внешние признаки пластмасс в таблицу.
Таблица
Физические свойства пластмасс.
| Название | Цвет | Твердость | Эластичность | Хрупкость |
| Пластмассы |
|
|
|
|
| 1.Полиэтилен |
|
|
|
|
| 2.Поливинилхлорид |
|
|
|
|
| 3.Полистирол |
|
|
|
|
Контрольные вопросы
1. Какие вещества называются полимерами?
2. Назовите известные вам полимерные соединения и их область применения.
Сформулируйте вывод по работе.
Практическая работа№28
«Распознавание волокон»
Цель: Ознакомление на основе коллекционного материала с образцами волокон.
Задача: Закрепить знания по теме «Азотсодержащие органические соединения. Полимеры».
Обеспечивающие средства: Коллекция «Волокна».
Теоретические основы
Изготовление волокон и тканей – вторая обширная область народнохозяйственного применения синтетических высокомолекулярных веществ.
Волокна делятся на природные и химические.
Волокна
Природные Химические
Растительного Животного
Искусственные Синтетические
происхождения
Выполнение работы
1. Ознакомление с коллекциями образцов волокон.
Рассмотрите коллекции «Волокна» Запишите внешние признаки волокон в таблицу.
Таблица
Физические свойства пластмасс и волокон.
| Название | Цвет | Твердость | Эластичность | Хрупкость |
| Волокна |
|
|
|
|
| 1.Шерсть |
|
|
|
|
| 2.Хлопок |
|
|
|
|
| 3.Лен |
|
|
|
|
Контрольные вопросы
1. Как классифицируются химические волокна?
2. Назовите известные вам волокна и их область применения.
Сформулируйте вывод по работе
Список литературы
1. Ерохин Ю.М. Химия: учебник. - М., ОИЦ «Академия», 2014.
2. Габриелян О.С. Химия: учебное пособие для студентов профессиональных учебных заведений / О.С. Габриелян, И.Г. Остроумов. – М., ОИЦ «Академия»,2011
3. Габриелян О.С. Практикум по общей, неорганической и органической химии: учебное пособие для студентов средних профессиональных учебных заведений / О.С.Габриелян, И.Г.Остроумов. – М., ОИЦ «Академия», 2010.
4. Габриелян О.С., Остроумов И.Г. Химия: учебник для профессий и специальностей технического цикла – М., ОИЦ «Академия», 2014.
57
© 2017, Лепешенко Татьяна Ивановна 2612 14
Рекомендуем курсы ПК и ППК для учителей
Похожие файлы
Полезное для учителя