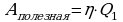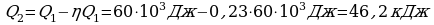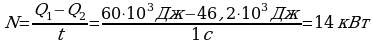Министерство образования, науки и молодежной политики Краснодарского края
ГБПОУ КК «Колледж Ейский»
Методические рекомендации
по организации самостоятельной работы
при решении задач по разделу «Молекулярная физика. Термодинамика»
Ейск, 2016г.
| Рассмотрено на заседании ПЦК математических и естественнонаучных дисциплин Протокол №___ от «___»___________2016г. Председатель ПЦК__________Л.С.Черных | Рассмотрено ОМК ГБПОУ КК «Колледж Ейский» _________Е.Н.Литвинова Протокол №___ от «___»_______2016г. |
Методические рекомендации предназначены для организации самостоятельной внеаудиторной работы по учебной дисциплине Физика при решении задач по разделу «Молекулярная физика. Термодинамика».
Методическое пособие включает в себя теоретический материал по разделу «Молекулярная физика. Термодинамика», примеры решения задач типовых заданий по указанной тематике, задания для выполнения внеаудиторных работ по указанной тематике.
Предназначены для студентов первого курса среднего специального профессионального образования, обучающихся по специальностям технического профиля.
Содержание:
| Пояснительная записка | 4 |
| Введение | 5 |
| 1. Как надо решать задачи по физике | 7 |
| 2.Основы молекулярно-кинетической теории | 8 |
| 3.Температура. Энергия теплового движения молекул | 12 |
| 4.Уравнение состояния идеального газа. Газовые законы | 15 |
| 5.Взаимные превращения жидкостей и газов | 21 |
| 6.Твёрдые тела | 24 |
| 7.Основы термодинамики | 27 |
| 8. Список задач для самостоятельной работы | 30 |
| Заключение | 37 |
| Литература | 39 |
| Приложение | 40 |
Пояснительная записка
Данные методические рекомендации предназначены для студентов первого курса среднего специального профессионального образования, обучающихся по специальностям технического профиля при решении задач по разделу «Молекулярная физика. Термодинамика» по дисциплине Физика.
На каждом уроке преподавателю наряду с планированием учебного материала необходимо продумывать и вопрос о том, какие навыки самостоятельной работы получат на уроке студент.
Если студент научится самостоятельно изучать новый материал, пользуясь учебником или какими-то специально подобранными заданиями, то будет успешно решена задача сознательного овладения знаниями. Знания, которые усвоил студент сам, значительно прочнее тех, которые он получил после объяснения преподавателя. И в дальнейшем студент сможет самостоятельно ликвидировать пробелы в знаниях, расширять знания, творчески применять их в решении задач.
Цель данной методической разработки – последовательное изложение теории и устранение неясностей и проблем, которые могут возникнуть у студента в процессе решения задач по разделу «Молекулярная физика. Термодинамика».
Введение
Методическая разработка является опорным конспектом для студентов при организации самостоятельной работы. Программа изучения дисциплины Физика предусматривает, кроме обязательных часов аудиторной работы, также и определенный объем самостоятельной внеаудиторной работы. Эффективная самостоятельная работа способствует формированию и развитию общих и профессиональных компетенций студентов.
Самостоятельная внеаудиторная работа обучающегося – это вид деятельности, выступающий как специфическая форма учебного и научного познания, внутренним содержанием которого является самостоятельное построение обучающимся способа достижения поставленной цели. Содержание самостоятельной внеаудиторной работы студентов имеет двуединый характер. С одной стороны, это совокупность учебных и практических заданий, которые должен выполнить обучающийся в процессе обучения, объект его деятельности. С другой стороны, это способ деятельности обучающегося по выполнению соответствующего учебного теоретического или практического задания.
В нормативных документах определены цели самостоятельной внеаудиторной работы студентов:
- закрепление, углубление, расширение и систематизация знаний, полученных во время аудиторных занятий, самостоятельное овладение новым учебным материалом;
- формирование общетрудовых и общепрофессиональных умений;
- формирование умений и навыков самостоятельного умственного труда;
- развитие самостоятельности мышления;
- формирование убежденности, волевых черт характера, способности к самоорганизации.
Активная самостоятельная работа студентов возможна только при наличии серьезной и устойчивой мотивации.
Основным мотивом в обучении является желание стать квалифицированным рабочим, для чего необходимо углублять знания по профессии; проявлять интерес к учебному и профессиональному поиску; стремиться к интеллектуальному росту и расширению кругозора.
Самостоятельная работа студентов проводится с целью:
- систематизации и закрепления полученных теоретических знаний и практических умений студентов;
- углубления и расширения теоретических знаний;
- формирования умений использовать справочную документацию и специальную литературу;
- развития познавательных способностей и активности студентов: творческой инициативы, самостоятельности, ответственности и организованности;
- формирования самостоятельности мышления, способностей к саморазвитию, самосовершенствованию и самореализации;
- развития исследовательских умений.
Роль самостоятельной работы возрастает, т.к. перед учебным заведением стоит задача в т. ч. и по формированию у студента потребности к самообразованию и самостоятельной познавательной деятельности.
1. Как надо решать задачи по физике.
Чтобы правильно и осмысленно решать задачи по физике, необходимо следовать алгоритму:
Алгоритм «Решение задач по физике»
Внимательно прочитайте условие задачи.
Установите о каком (их) физических явлениях идёт речь в задаче.
Вспомните основные количественные и качественные закономерности, объясняющие это (и) явление.
Определите, что требуется найти в задаче.
Установите, какие физические величины даны в задаче. Не забудьте о табличных величинах.
Примечание: Иногда использование табличных величин зашифровано текстовой информацией:
-определить массу молекулы азота,
-найти количества вещества в массе алюминия.
Переведите, если этого необходимо, физические величины в систему СИ (стандартные единицы измерения)
Определите какую (ие) количественную (ые) зависимость (и) надо использовать в решение. Для этого лучше всего определить количественные зависимости, куда входит искомая физическая величина, а также данные физических величин по условию задачи.
Использовать преобразования в физических формулах, получите окончательную расчётную формулу.
Примечание: при проверке правильности полученной формулы используйте размерность физической величины.
Например: Если мы должны найти силу F, то в результате сокращения размерности должны получить H (Ньютон), если получить, что-то другое, значит, формула получена не верно.
Выполните вычисления по полученной формуле.
Запишите ответ задачи.
Примечание: Иногда, для успешного решения задачи требуется выполнить чертёж. Помните о том, что правильно выполнит чертёж, помогает в решение задач, это 50% вашего успеха.
2. Основы молекулярно-кинетической теории.
2.1 Основные понятия и закономерности.
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом.
Относительно молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) m данного вещества к
данного вещества к 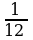 массы атома углерода m
массы атома углерода m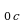 : Mr =
: Mr =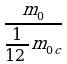
В Международной системе единиц количество вещества выражают в молях. Один моль- это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
Значит, в 1 моле любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают N
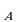
и называют
постоянной Авогадро в честь итальянского учёного.
Между молярной массой Μ и относительной молекулярной массой Mr существует следующая связь:
M=Mr⋅10−3
Следующей основной физической величиной в МКТ будет – количество вещества. Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле. Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в нем с числом атомов в 0,012 кг изотопа углерода 126C. Единица количества вещества называется молем (моль). Обозначают количесвта вещества – ν.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА:
ν = N/ NА = m\M
Зная массу вещества и его молярную массу М, можно найти число молей (количество вещества)
N=νNA=mMNA.
Зная молярную массу и постоянную Авогадро, можно рассчитать массу одной молекулы: m0=M\NA=mN.
Броуновское движение-это тепловое движение взвешенных в жидкости (или газе) частиц. Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. p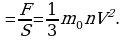
Это основное уравнение молекулярно-кинетической теории. p
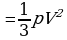 1
1
2.2. Решение задач
Задача 1. Какое количество вещества содержится в алюминиевой отливке массой 5,4 кг?2

 Дано СИ Решение
Дано СИ Решение
M(Al)=27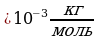
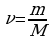
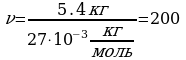 моль
моль
m (Al)=5,4 кг
 .
.
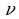 -? Ответ: 200 моль.
-? Ответ: 200 моль.
Задача 2. Какой объем занимает 100 моль ртути?

 Дано СИ Решение
Дано СИ Решение
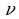 (Hg)=100 моль V=
(Hg)=100 моль V= Подставим
Подставим 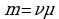 в первую формулу
в первую формулу
 (Hg)=13.6·10
(Hg)=13.6·10 V=
V=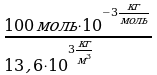 =1,5 ·10
=1,5 ·10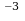 м
м
M(Hg)=201
 V-? Ответ: 1,5·10
V-? Ответ: 1,5·10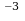 или 1,5 л.
или 1,5 л.
Задача 3.
Чему равно число молекул в 10 г. кислорода? Дано СИ Решение

 m (O
m (O )=10 г. 0,01кг.
)=10 г. 0,01кг. 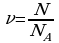 (1)
(1)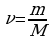 (2) =
(2) =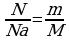
M(O ) =32·10
) =32·10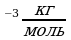 Выразим N; получаем
Выразим N; получаем 
 Na=6.02·10
Na=6.02·10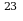 моль
моль N=
N=
 1,88·10
1,88·10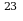 молекул
молекул
N-? Ответ:  1,88*10
1,88*10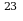 молекул
молекул
Задача 4. На изделие, поверхность которого 50 см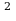 , нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии?
, нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии?
 Дано СИ Решение
Дано СИ Решение

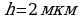

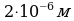 N= , но масса цинка не известна.
N= , но масса цинка не известна.
S=50 cм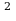
 Найдём массу цинка через объём и плотность.
Найдём массу цинка через объём и плотность.
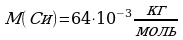
 , объём найдём, зная площадь поверхности
, объём найдём, зная площадь поверхности
Na=6.02*10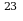 моль
моль и толщину слоя V=Sh=m=Sh
и толщину слоя V=Sh=m=Sh
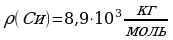 Подставим в начальную формулу
Подставим в начальную формулу
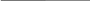 N-?
N-?
N=
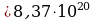 молекул
молекул
Ответ: 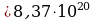 молекул
молекул
Задача 5. Определите сколько молекул воды в объёме 2л.
Дано СИ Решение

 V=2л. 2*10
V=2л. 2*10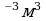 N=
N= , масса воды неизвестна.
, масса воды неизвестна.
Na=6.02*10 Найдём массу воды через объём и плотность. m=
Найдём массу воды через объём и плотность. m=


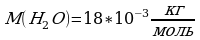 N=
N=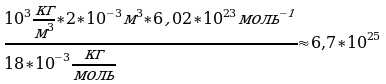

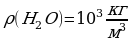
N-? Ответ: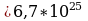
Задача 6. Находившаяся в стакане воде массой 0,5 кг. полностью испарилась за 30 суток. Сколько в среднем молекул воды вылетало с её поверхности за 1с?
Дано СИ Решение

 m(H
m(H )=0.5 кг. N
)=0.5 кг. N =
=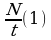 Чтобы найти число молекул, испаряющихся за
Чтобы найти число молекул, испаряющихся за
t=30 суток 2,592·10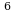 с. 1сек. - N
с. 1сек. - N , необходимо всё число молекул разделить
, необходимо всё число молекул разделить
t =1с на время, за которое они испарились.
=1с на время, за которое они испарились.
 =18·10
=18·10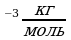 . N=
. N= (2).
(2).
 Подставим(2)
Подставим(2) (1) и учтем время в секундах.
(1) и учтем время в секундах.
N -?
-?
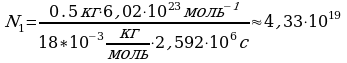 N
N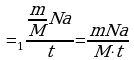
Ответ: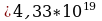
Задача 7. В озеро, имеющее среднюю глубину 10м и площадь поверхности 20 км , бросили кристаллик поваренной соли массой 0,01г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см
, бросили кристаллик поваренной соли массой 0,01г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см , зачерпнутой из озера, если полагать, что соль, растворившись, равномерно распределилась во всем объеме воды?
, зачерпнутой из озера, если полагать, что соль, растворившись, равномерно распределилась во всем объеме воды?
Дано СИ Решение
h=10м Чтобы найти N . Необходимо найти объем озера V , кол-во
. Необходимо найти объем озера V , кол-во

 S=20 км
S=20 км 2·10
2·10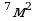 частиц соли N V=hS(1); N=
частиц соли N V=hS(1); N=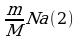 ; N
; N
m=0.01 г 10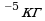 Подставим (1) и (2) в (3)
Подставим (1) и (2) в (3) 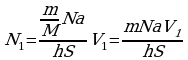
V =2 см
=2 см 2·10
2·10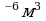
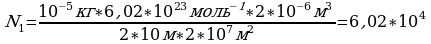
Na=6.02·10
 N
N -? Ответ:6,02·10
-? Ответ:6,02·10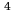
 Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600
Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600 , а его плотность 1,54
, а его плотность 1,54 ?
?
 Дано СИ Решение
Дано СИ Решение
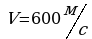
 Отразим на произведение m
Отразим на произведение m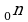


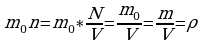 Следовательно,
Следовательно, 
Р -? 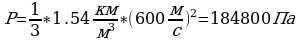 Ответ:1,848*10
Ответ:1,848*10
Задача 9. Какова средняя квадратичная скорость движения молекул газа, если имея массу 8 кг, он занимает объем 10 м при давлении 250 кПа?
при давлении 250 кПа?
Дано СИ Решение

 m=8кг
m=8кг  Рассмотрим n -концентрация n=
Рассмотрим n -концентрация n= 
V=10 м
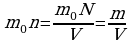 Следовательно,
Следовательно, 
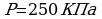 2,5*10
2,5*10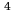 Выразим V из этого уравнения поэтапно:
Выразим V из этого уравнения поэтапно:
 V-? 1. Умножим первую и правую части на 3V: 3РV=mV
V-? 1. Умножим первую и правую части на 3V: 3РV=mV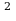
2. Разделим первую и вторую часть на m: V 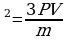
3. Возьмем квадратичный корень из первой и второй части.
V=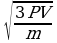
V=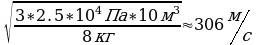
Ответ: 306 м/с
Задача 10. Найти концентрацию молекул кислорода, если давление его 0,3 МПа, а средняя квадратичная скорость молекул равна 900

 Дано CИ Решение
Дано CИ Решение
V=900 (1)
(1)  . Выразим n из уравнения (1). n=
. Выразим n из уравнения (1). n=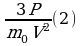
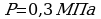 3*10
3*10  Мы не знаем массу m
Мы не знаем массу m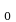 -массу молекулы кислорода.
-массу молекулы кислорода.
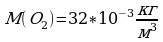 Для этого воспользуемся малярной массой кислорода
Для этого воспользуемся малярной массой кислорода
 Na=6,02*10
Na=6,02*10 
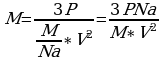
n-? n=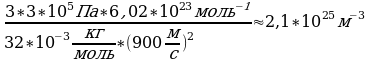
Ответ:
Задача 11. Найти среднюю кинетическую энергию молекулы одноатомного газа при давлении 30 кПа. Концентрация молекул газа при указанном давление 5*10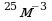 .
.

 Дано СИ Решение
Дано СИ Решение
P=30 кПа 3*10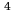 Па Р=
Па Р=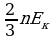 Eк
Eк 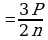 E
E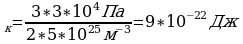
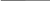 N=5*10
N=5*10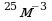
Е -? Ответ:9*10
-? Ответ:9*10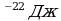
3.Температура. Энергия теплового движения молекул.
3.1. Основные понятия и закономерности.
Величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел(V,p,Т) называют макроскопическими параметрами.
Тепловым равновесием называют такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными.
Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении, называют нулем температуры.
Постоянная Больцмана связывает температуру 0 в энергетических единицах с температурой Т в Кельвинах.
Один Кельвин и один градус шкал Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию. T=t+2730С; 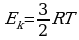
Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре. 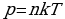
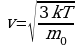 3
3 3.2. Решение задач.
Задача 1. Определить кинетическую энергию молекулы одноатомного газа и концентрацию молекул при температуре 37 С и давлении 1,2 МПа.
С и давлении 1,2 МПа.

 Дано СИ Решение
Дано СИ Решение
T=37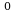 С + 273 310К
С + 273 310К
P=1,2 МПа 1,2*10 . Е
. Е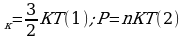 Выразим из (2) уравнения n=n=
Выразим из (2) уравнения n=n=
к=1,38*10 Итак: Е
Итак: Е и n=
и n= Вычислим:
Вычислим:
 Е
Е -? N-? Е
-? N-? Е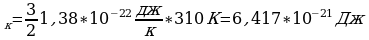
n=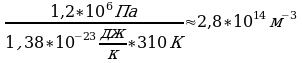
Ответ: 
Задача 2. Найти температуру водорода и среднюю квадратичную скорость его молекул при давлении 150 кПа и концентрации молекул 1,5*10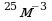 .
.
Дано СИ Решение
P=150 кПа 1.5*10 Па P=nКТ (1) . Выразим Т из Уравнения (1): Т=
Па P=nКТ (1) . Выразим Т из Уравнения (1): Т=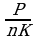

 N=1,5*10
N=1,5*10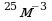 Т=
Т=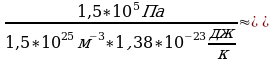 724 К; V=
724 К; V=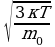 (2)
(2)
k=1,38*10 Масса молекулы водорода неизвестна. Найдем его,
Масса молекулы водорода неизвестна. Найдем его,
Na=6.02*10 используя молярную массу водорода.
используя молярную массу водорода.
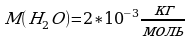
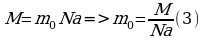 Подставим выражение (3) в
Подставим выражение (3) в
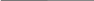 Т-? V-? .
Т-? V-? .
уравнение (2) V=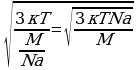
V=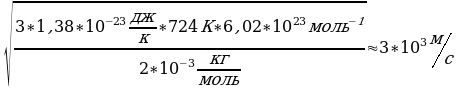
Ответ: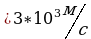
Задача 3. При какой температуре средняя квадратичная скорость молекул равна 700 ?
?

Дано СИ Решение

V=700 V=
V=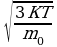 (1). Выразим из уравнения(1)поэтапно
(1). Выразим из уравнения(1)поэтапно
К=1,38*10 1.Возведем в квадрат обе части V
1.Возведем в квадрат обе части V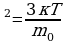
Na=6.02*10 2.Умножим обе части на m
2.Умножим обе части на m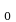 : V
: V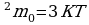

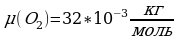 3.Разделим обе части на 3К: Т=
3.Разделим обе части на 3К: Т=
Т-? Итак, Т=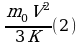 , но мы не знаем m
, но мы не знаем m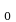 -массу одной
-массу одной
молекулы кислорода. Найдем её, зная молекулярную
массу кислорода:  Подставим (3) в (2), получим:
Подставим (3) в (2), получим: 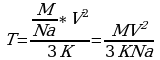 Т=
Т=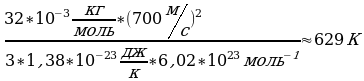
Ответ: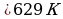
Задача 4. Средняя квадратичная скорость молекул газа, находящихся при температуре 110 С, равна 600
С, равна 600 . Определите массу молекулы.
. Определите массу молекулы.
Дано СИ Решение

 t=110
t=110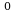 с Т=t+273К ; Т=110
с Т=t+273К ; Т=110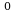 с+273К=383К
с+273К=383К
V=600  V=
V=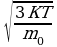
к=1,38*10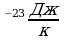 Выразим m
Выразим m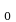 из этого уравнения.
из этого уравнения.
 m
m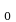 -? 1. Возведем левую и правую части в квадрат V
-? 1. Возведем левую и правую части в квадрат V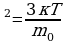
2.Умножим обе части на m : V
: V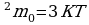
3. Разделим обе части на V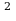 m
m
Вычислим: m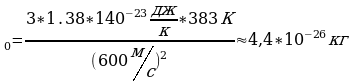 Ответ:
Ответ: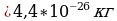
4.Уравнение состояния идеального газа. Газовые законы.
4.1. Основные понятия и закономерности.
Еще философы древности догадывались о том, что теплота - это вид внутреннего движения. Но только в 18 веке начала развиваться молекулярно-кинетическая теория (МКТ). Цель МКТ - объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, на основе представлений о том, что все тела состоят из отдельных, беспорядочно движущихся частиц. В основе МКТ строения вещества лежат три утверждения:
- вещество состоит из частиц;
- эти частицы беспорядочно движутся;
- частицы взаимодействуют друг с другом.
Качественное объяснение основных свойств газов на основе МКТ не является особенно сложным. Однако теория, устанавливающая количественные связи между измеряемыми на опыте величинами и свойствами самих молекул, их числом и скоростью, весьма сложна. Вместо реального газа, между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать его физическую модель. Эта модель называется идеальным газом.
Идеальный газ - это газ, взаимодействие, между молекулами которого пренебрежимо мало и молекулы не занимают объема.
Для описания процессов в газах и других макроскопических телах нет необходимости всё время обращаться к МКТ. Величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел называют макроскопическими параметрами. Это объем, давление и температура. Уравнение, связывающее все три макроскопических параметра вместе, называют уравнением состояния идеального газа. Оно имеет еще одно название - уравнение Менделеева - Клапейрона. Получим его:
 ,
, 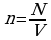 ,
,  ,
, 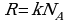 →
→ 
Можно заметить, что это уравнение получено для газа любой массы. Для газа неизменной массы эту зависимость можно представить в следующем виде:
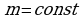 ,
, 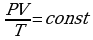 ,
, 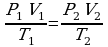
Это уравнение получило название - уравнение Клапейрона. Как можно заметить уравнение Клапейрона является частным случаем уравнения состояния идеального газа.
C помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех макроскопических параметров остаются неизменными. Количественные зависимости между двумя параметрами при фиксированном значении третьего параметра называют газовыми законами. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) макроскопических тел при постоянной температуре называют изотермическим.
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Бойля-Мариотта. Для газа данной массы произведение давления газа на его объём постоянно, если температура газа не меняется. Математическая запись закона выглядит так: 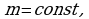
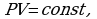
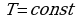
Зависимость макроскопических параметров в различных осях выглядит следующим образом:


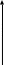
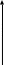
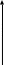
















Легко заметить, что изотерме располагающейся выше в осях P,V соответствует большая абсолютная температура.
ИЗОБАРНЫЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) при постоянном давлении называют изобарным.
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Гей-Люссака. Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется. Математическая запись закона выглядит так: 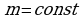 ,
, 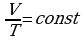 ,
, 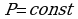
Зависимость макроскопических параметров в различных осях выглядит следующим образом:


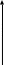















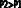
 Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.
Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.
ИЗОХОРНЫЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) при постоянном объёме называют изохорным.
В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Шарля. Для газа данной массы отношение давления к температуре постоянно, если объём газа не меняется. Математическая запись закона выглядит так: 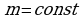 ,
,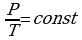 ,
,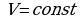
Зависимость макроскопических параметров в различных осях выглядит следующим образом:

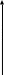


















Нетрудно определить, что изохоре в осях P,T имеющей меньший угол наклона к оси температур соответствует больший объём4.
4.2. Решение задач
Задача1. Какое количество вещества содержится в газе, если при давлении 200кПа и температуре 240К его объем равен 40л?
Дано СИ Решение

 Р=200кПа
Р=200кПа 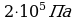 Воспользуемся уравнением состояния идеального газа,
Воспользуемся уравнением состояния идеального газа,
Т=240К поскольку в задаче идет речь о состоянии газа.
V=40л 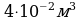
 Зная, что количество вещества определяется
Зная, что количество вещества определяется
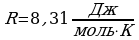
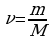 , подставим в исходную формулу:
, подставим в исходную формулу:

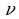 -?
-? 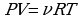 , выразим
, выразим 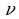 и получим:
и получим: 
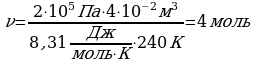
Ответ: 4 моль
Задача 2. Газ при давлении 0,2МПа и температуре 150С имеет объем 5л. Чему равен объем этой массы газа при нормальных условиях?
Дано СИ Решение

 Р=0,2МПа
Р=0,2МПа 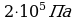 Для решения воспользуемся уравнением Клапейрона, поскольку в
Для решения воспользуемся уравнением Клапейрона, поскольку в
задаче речь идет о изменении макропараметров без изменении массы
газа.

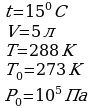

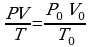 Выразим
Выразим  из уравнения Клапейрона:
из уравнения Клапейрона:
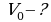
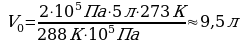
Ответ: 9,5л
Задача 3. Как изменился объем газа, если его температура увеличилась в 2 раза, давление возросло на ¼. Первоначальное давление 0,2МПа.

 Дано СИ Решение
Дано СИ Решение
Р=0,2Мпа Для решения воспользуемся уравнением Клапейрона, поскольку
 в задаче речь идет о изменении макропараметров без
в задаче речь идет о изменении макропараметров без
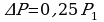 изменения массы газа.
изменения массы газа. 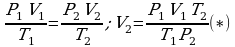
m=const Учитывая, что давление возросло, то 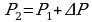 и
и 

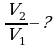 подставим в (*), получим:
подставим в (*), получим: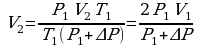
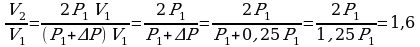
Ответ: увеличилось в 1,6 раза
Задача 4. Газ был изотермически сжат с 8 л до 5л. При этом давление возросло на 60кПа. Найти первоначальное давление газа.

 Дано СИ Решение
Дано СИ Решение
 Воспользуемся законом Бойля-Мариотта, так как в задаче
Воспользуемся законом Бойля-Мариотта, так как в задаче
 идет речь о изотермическом процессе без изменения массы
идет речь о изотермическом процессе без изменения массы
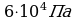 газа.
газа. 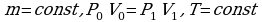

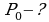 Так как
Так как 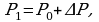 то имеем
то имеем

Выразим 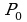 из предыдущего выражения, получим:
из предыдущего выражения, получим: 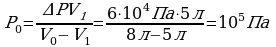
Ответ: 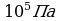
Задача 5. Какой объем займет газ при 770С, если при 270С его объем был 6л?

 Дано СИ Решение
Дано СИ Решение
V1=6л  В данной задаче переводить литры в м3 нет необходимости, так как
В данной задаче переводить литры в м3 нет необходимости, так как
t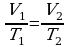 1=270C воспользуемся законом Гей-Люссака (давление постоянно).
1=270C воспользуемся законом Гей-Люссака (давление постоянно).
t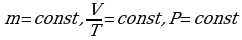
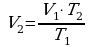 2 = 770C
2 = 770C
T1=300K
 T2=350K
T2=350K
V2 - ? Выразим из этого выраженияV2. Вычислим: 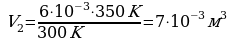
Ответ: 7·10 -3м3 Задача 6. При какой температуре находился газ в закрытом сосуде, если при нагревании его на 140К давление возросло в 1,5 раза?

 Дано СИ Решение
Дано СИ Решение
 Так как сосуд закрыт, следовательно, масса газа не изменятся и объем
Так как сосуд закрыт, следовательно, масса газа не изменятся и объем
 газа не изменен. Значит, воспользуемся законом Шарля.
газа не изменен. Значит, воспользуемся законом Шарля.
Т0-? 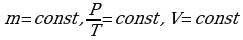
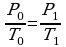 , но
, но 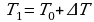 и
и 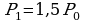
Следовательно, 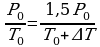 , на Р0 можно сократить и преобразовать выражение:
, на Р0 можно сократить и преобразовать выражение:
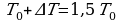 Перенесем в левую часть все Т0 , а в правую все остальное .
Перенесем в левую часть все Т0 , а в правую все остальное .
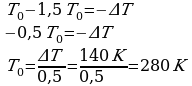
Ответ: 280К
Задания на чтение графиков изменения состояния газа при фазовых переходах.
Алгоритм выполнения
Определить фазовые переходы состояния газа (изотермический, изобарный, изохорный процессы). Записать анализ ниже предложенного графика.
Установить на каждом переходе изменения макроскопических параметров (увеличиваются или уменьшаются).
Учитывая графики изопроцессов в различных осях координат (см. ранее), построить графики изменения состояния газа в недостающих координатах.
5.Взаимные превращения жидкостей и газов.
5.1. Основные понятия и закономерности.
Между жидкостью и паром (газом), находящимся над ней, может существовать динамическое равновесие, при котором число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся из пара в жидкость за то же время. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Давление насыщенного пара не зависит от объёма и определяется только температурой. Газ, который простым сжатием при неизменной температуре можно превратить в жидкость, называется ненасыщенным паром.
В природе существует два процесса перехода из жидкости в газ. Эти процессы - испарение и кипение называют процессами парообразования.
Испарение - это процесс парообразования, происходящий при любой температуре с поверхности жидкости с поглощением энергии.
Скорость испарения зависит от:
1. рода жидкости (плотность вещества)
2. температуры жидкости
3. атмосферного давления
4. площади поверхности жидкости
5. движения воздушных масс у поверхности жидкости
6. содержания водяных паров в атмосфере (влажность воздуха)
Кипение - это процесс парообразования, происходящий при определенной температуре во всем объёме жидкости с поглощением энергии.
Температура кипения зависит от:
1. рода жидкости
2. атмосферного давления
3. примесей в жидкости
Конденсация - это обратный процесс парообразования, происходящий с выделением энергии.
Критическая температура - это температура, при которой исчезают различия в физических свойствах между жидкостью и её насыщенным паром.
Представление о критической температуре ввел Д. Н. Менделеев. Особое значение критической температуры состоит в том, что при температуре выше критической ни при каких давлениях газ нельзя обратить в жидкость.
Вода занимает около 70,8% поверхности земного шара. Живые организмы содержат от 50 до 99,7% воды. Образно говоря, живые организмы - это одушевленная вода. В атмосфере находится около 13-15 тыс.куб. метров воды в виде капель, кристаллов снега и водяного пара. Атмосферный водяной пар влияет на погоду и климат Земли.
Давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали, называют парциальным давлением водяного пара. Водяной пар в воздухе не является насыщенным. Почему? Парциальное давление водяного пара принимают за один из показателей влажности воздуха. Его выражают в единицах давления - паскалях или миллиметрах ртутного столба.
По парциальному давлению водяного пара ещё нельзя судить о том, насколько водяной пар в данных условиях близок к насыщению. Поэтому вводят величину, показывающую, насколько водяной пар при данной температуре близок к насыщению, - относительную влажность. Относительной влажностью воздуха  называют отношение парциального давления
называют отношение парциального давления  водяного пара, содержащегося в воздухе при данной температуре, к давлению
водяного пара, содержащегося в воздухе при данной температуре, к давлению 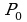 насыщенного пара при той же температуре, выраженной в процентах:
насыщенного пара при той же температуре, выраженной в процентах: 
Влажность воздуха измеряют с помощью специальных приборов: психрометр, гигрометр, волосяной гигрометр. Психрометр состоит из двух термометров. Резервуар одного из них остаётся сухим, и он показывает температуру воздуха. Резервуар другого окружен полоской ткани, конец которой опущен в воду. Вода испаряется, и благодаря этому термометр охлаждается. Чем больше относительная влажность воздуха, тем менее интенсивнее идет испарение и тем более высокую температуру показывает термометр, окруженный полоской влажной ткани. При относительной влажности воздуха 100% вода вообще не будет испаряться и показания обоих термометров будут одинаковы. По разности температур этих термометров с помощью специальных таблиц (психрометрических ) можно определить относительную влажность воздуха.
Принцип действия гигрометра во многом отличается. Используя гигрометр определяют точку росы ( температура при выпадает роса ) и по специальному алгоритму определяют относительную влажность воздуха.
В основе действия волосяного гигрометра лежит свойство волоса удлинятся или укорачиваться в зависимости от содержания водяных паров в атмосфере.
Точка росы – температура, при которой выпадает роса. При решении задач на точку росы необходимо использовать следующий алгоритм:
Алгоритм «Точка росы»
Определить температуру окружающего воздуха. По таблице зависимости давления насыщенного пара от температуры определить давление Р0.
Определить температуру, при которой выпала роса. По таблице зависимости давления насыщенного пара от температуры определить парциальное давление Р.
По формуле  выполнить вычисления5.
выполнить вычисления5.
5.2. Решение задач
Задача 1. Найти относительную влажность воздуха в комнате при 180С, если точка росы 100С.
 Дано СИ Решение
Дано СИ Решение

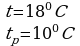 Для решения задачи воспользуемся алгоритмом «Точка росы»
Для решения задачи воспользуемся алгоритмом «Точка росы»
1. 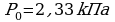 ; 2.
; 2. 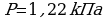

 3.
3. 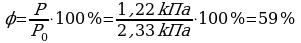
Ответ: 59%
 Задача 2. Влажный термометр психрометра показывает 100С, а сухой 140С. Найти относительную влажность воздуха.
Задача 2. Влажный термометр психрометра показывает 100С, а сухой 140С. Найти относительную влажность воздуха.
 Дано СИ Решение
Дано СИ Решение
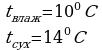 Для решения данной задачи воспользуемся психрометрической таблицей:
Для решения данной задачи воспользуемся психрометрической таблицей:
1. Найдем показания сухого термометра (140С)
2. Определим разность в показаниях сухого и влажного термометров



3. На пересечении соответствующих строк и столбца найдем показания психрометра: 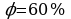
Ответ: 60%
Задача 3. Днем при 200С относительная влажность воздуха была 60%. Сколько воды в виде росы выделится из каждого кубического метра воздуха, если температура понизилась до 80С?

 Дано СИ Решение
Дано СИ Решение
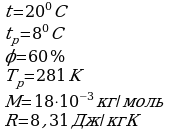 Для решения задачи необходимо воспользоваться формулами
Для решения задачи необходимо воспользоваться формулами
нахождения относительной влажности воздуха и уравнением
Менделеева.  ,
, 
Найдем парциальное давление, зная влажность и
давление насыщенного пара: 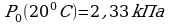
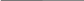 (из таблицы)
(из таблицы) 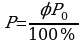
Из уравнения Менделеева выразим массу: 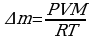
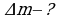
Подставим парциальное давление и найдем массу воды.

Ответ: 10г
6.Твердые тела.
6.1. Основные понятия и закономерности.
Мы живем на поверхности твердого тела - земного шара, в сооружениях, построенных из твердых тел, - домах. Наше тело, хотя и содержит приблизительно 65% воды (мозг - 80%), тоже твердое. Орудия труда, машины также сделаны из твердых тел. Знать свойства твердых тел жизненно необходимо!
Твердые тела делятся на два основных вида: кристаллические и аморфные. Твердые тела сохраняют не только объем, но и форму.
Кристаллические тела - это твердые тела, атомы и молекулы которых занимают определенные, упорядоченные положения в пространстве. Примером кристаллических тел могут служить - алмазы, металлы, графит, лед и т.д.
Основные свойства кристаллических тел:
1. Имеют кристаллическую решётку.
2. Анизотропия (только для монокристаллов).
3. Имеют определенную температуру плавления.
Зависимость физических свойств (прочность, теплопроводность, светопроводность, тепловое расширение и т.д.) от направления внутри кристалла называют анизотропией.
Аморфные тела - это твердые тела, которые по своим физическим свойствам занимают промежуточное положение между жидкостями и кристаллическими телами. При высоких температурах они ведут себя как жидкости, при низких - как твердые тела. Примером аморфных тел могут служить - канифоль, смола, стекло, пластмассы и т.д.
Свойства аморфных тел:
1. Атомы и молекулы не имеют строго расположения в пространстве.
2. Изотропны. (все свойства во всех направлениях одинаковы)
3. Не имеют определенной температуры плавления.
Все твердые тела подвергаются деформациям. Деформацией называются изменение формы или объёма тела. Различают упругую и пластическую деформации.
Деформации, которые полностью исчезают после прекращения действия внешних сил, называются упругими.
Деформации, которые не исчезают после прекращения действия внешних сил, называются пластическими.
Виды упругой деформации:
1. Растяжение (сжатие)
характеризуются:
абсолютным удлинением 
относительным удлинением 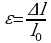
2. Сдвиг. Характеризуется углом сдвига.
3. Изгиб.
4. Кручение.
Первый и второй виды упругой деформации называются основными, так как изгиб и кручение представимы в комбинациях основных видов. Например, деформация изгиба представляет собой в верхних слоях тела растяжение, в нижних - сжатие. Кручение есть результат деформаций растяжения, сжатия и сдвига.
При деформациях в твердых телах возникает механическое напряжение. Механическим напряжением называют отношение модуля силы упругости, возникающей в теле при действии внешней силы, к площади поперечного сечения тела: 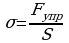
Закон Гука: При малых деформациях механическое напряжение прямо пропорционально относительному удлинению. Коэффициент пропорциональности, входящий в закон Гука называется модулем упругости или модулем Юнга. 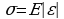 6
6
6.1. Решение задач
Задача 1. На сколько удлинится медная проволока длиной 3м и диаметром 0,12мм под действием гири весом 1,5Н? Деформацию считайте упругой.

 Дано СИ Решение
Дано СИ Решение
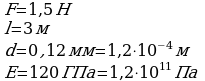
Воспользуемся законом Гука, механическим напряжением
и относительным удлинением.
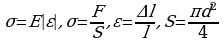

 Сравним правые части закона Гука и механического напряжения, учтем при этом относительное удлинение и площадь, получим:
Сравним правые части закона Гука и механического напряжения, учтем при этом относительное удлинение и площадь, получим: 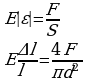 Выразим из этого выражения искомую величину:
Выразим из этого выражения искомую величину: 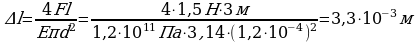 Ответ: 3,3 мм
Ответ: 3,3 мм
Задача 2. Рассчитайте силу, необходимую для разрыва медной проволоки из школьного набора проводов диаметром 0,3мм.
Дано СИ Решение


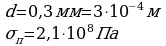 Для решения задачи воспользуемся определением механического
Для решения задачи воспользуемся определением механического
напряжения и определением площади круга (проволока в сечении
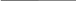 круглая).
круглая). 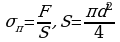
F-? Выразим силу F из механического напряжения. Подставим в эту
формулу выражение для площади сечения.

Ответ: 15Н
Задача 3. Какой максимальной высоты может быть кирпичное здание, если допускаемое напряжение кирпичной кладки 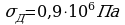 ?
?

 Дано СИ Решение
Дано СИ Решение
 Созданное весом стен давление равно
Созданное весом стен давление равно  , где
, где
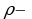 плотность кирпича,
плотность кирпича, 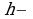 высота кладки
высота кладки
Выразим высоту h, получим:


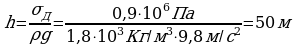
Ответ: 50 м
7.Основы термодинамики.
Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул(или атомов) относительно центра и потенциальных энергий взаимодействия всех молекул друг с другом(но не с молекулами других тел). 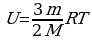 . Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.
. Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.
Она не зависит от объема и других макроскопических параметров системы. Изменение внутренней энергии данной массы идеального газа происходит только при изменение его температуры: 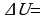

Работа газа равна: А’=F’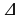 h=pS(h
h=pS(h )
)
Эту работу можно выразить через изменение объема газа. Начальный объем V =Sh
=Sh , а конечный V
, а конечный V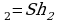 , поэтому А’=p(V
, поэтому А’=p(V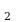 -V
-V )=p
)=p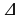 V, где
V, где  -изменение объема газа.
-изменение объема газа.
При расширение газ совершает положительную работу, так как направление силы и направление перемещения поршня совпадают. В процессе расширения газ передает энергию окружающим телам.
Работа А, совершаемая внешними телами над газом, отличается от работы газа А’ только знаком; А=А’, так как сила F , действующая на газ, направлена против силы F’, а перемещение поршня остается тем же самым. Поэтому работа внешних сил, действующих на газ, равна: А=-А’=-p
Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом или теплопередачей.
Количественная мера измерения внутренней энергии при теплообмене называют количеством теплоты.
Удельная теплоемкость- это количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К.
Q=cm(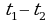 )=cm
)=cm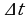
Количество теплоты, необходимое для превращения при постоянной температуре 1 кг жидкости в пар, называют удельной теплотой парообразования. Qп=rm; Qк=-rm
Количество теплоты, необходимое для превращения 1 кг кристаллического вещества при температуре плавления в жидкость той же температуры, называют удельной плавления  . Qпл=
. Qпл=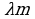 ; Qкр=-
; Qкр=-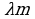
Количество теплоты, необходимое для полного сгорания 1 кг топлива при температуре сгорания, называют удельной сгорания Qпл=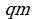 ; Qкр=-
; Qкр=-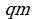
Закон сохранения энергии
Энергия в природе не возникает из ничего и не исчезает; количество энергии неизменно, она только переходит из одной формы в другую.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:  ; Q=
; Q=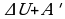
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Невозможно перевести теплоту от более холодной системы к более горечей при отсутствии других одновременных изменений в обеих системах или в окружающих телах.
Согласно закону сохранения энергии работа, совершаемая двигателем равна: А’=
Где Q -количество теплоты, полученное от нагревателя, а Q
-количество теплоты, полученное от нагревателя, а Q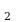 -количество теплоты, отданное холодильнику.
-количество теплоты, отданное холодильнику.
Коэффициентом полезного действия теплового двигателя называют отношение работы А’, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
Так как у всех двигателей некоторое количество теплоты передается холодильнику, то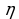
Карно придумал идеальную тепловую машину с идеальным газом в качестве рабочего тела. Он получил для КПД этой машины следующее значение:
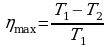 →
→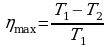
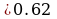 →
→ 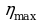 =62%
=62%
Действительно же значение КПД из-за различного рода энергетических потерь приблизительно равно 40%. Максимальный КПД около 44%-имеют двигатели Дизеля.
7.2. Решение задач
Задача 1. Свинцовая пуля летит со скоростью 200м/с и попадает в земляной вал. На сколько градусов нагреется пуля, если 78% кинетической энергии пули превратилось во внутреннюю?

 Дано СИ Решение
Дано СИ Решение
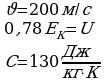 Так часть кинетической энергии перешла во внутреннюю, следовательно,
Так часть кинетической энергии перешла во внутреннюю, следовательно,
 пуля нагрелась. Значит
пуля нагрелась. Значит 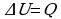
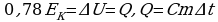 ,
, 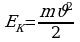 Получим:
Получим:

 , массу можно сократить. Выразим
, массу можно сократить. Выразим 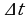 :
: 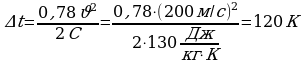
Ответ: 120К
Задача 2. 1 м3 воздуха при температуре 0°С находится в цилиндре при давлении 2·105 Па. Какая будет совершена работа при его изобарном нагревании на 10°С?

 Дано СИ Решение
Дано СИ Решение
V1 = 1 м3 Определить работу расширения газа. Температуру
t1 = 0°С переводим в Кельвины. T1=273 К; T2=283 К
P= 2*105 Па V1/T1=V2/T2→ V2=1,0366 м3
t2 = 10°С ∆V=1,0366-1=0,0366 м3
 А-? А=Р*∆V=2*105*0.0366 = 7326 Дж =7.3 кДж
А-? А=Р*∆V=2*105*0.0366 = 7326 Дж =7.3 кДж
Ответ: 7.3 кДж
Задача 3. Температура нагревателя идеальной тепловой машины 1170С, а холодильника 270С. Количество теплоты, получаемое машиной от нагревателя за 1с, равно 60кДж. Вычислить КПД машины, количество теплоты, отдаваемое холодильнику в 1с и мощность машины.

 Д
Д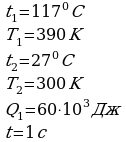 ано СИ Решение
ано СИ Решение
Для решения задачи воспользуемся формулами: идеальной тепловой
машины Карно, КПД, мощность машины

. - формула Карно идеальной тепловой машины
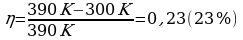
 Найдем количество теплоты, отданной холодильнику.
Найдем количество теплоты, отданной холодильнику. 
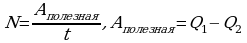 ,
, 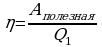 ,
, 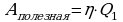
Значит, 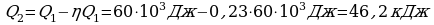
Теперь определим мощность тепловой машины.
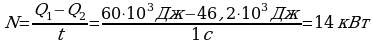
Ответ: 23%, 46,2кДЖ, 14кВт
8. Список задач для самостоятельной работы
Основы молекулярно – кинетической теории
Какое количество вещества содержит 24·1022 молекул?
Сколько молекул в 2,0 моль воды?
Какое количества вещества содержится в воде массой 200 г?
Какова масса 500 моль углекислого газа (CО2)?
Сравните количества вещества, содержащееся в оловянной и свинцовой отливках одинаковой массы.
Найдите число атомов в алюминиевом предмете массой 135г.
Какую массу имеют 2,0·1023 молекул азота?
Какой объем занимают 12 моль алюминия?
Масса атома некоторого химического элемента равна 3,34·10–25 кг. Определите молярную массу элемента.
Определите массу одной молекулы воды.
Вычислите массу одной молекулы озона (О3), углекислого газа (СО2) и метана (СН4).
Сравните число атомов в стальной и алюминиевой ложках равной массы.
Какое давление на стенки сосуда производит кислород, если V =400 м/c, n =2,7*1019м-3
Найдите среднюю кинетическую энергию поступательного движения молекул гелия, если при давлении 0,5*105 Па их концентрация n=1,5*109м-3
Масса газообразного водорода в сосуде равна 4г. сколько примерно молекул водорода находится в сосуде?
При никелировании изделия его покрывают слоем никеля толщиной 1,5 мкм. Сколько атомов никеля содержится в покрытии, если площад поверхности изделия 800 см2 ?
Где число молекул больше: в одном моле водорода или одном моле воды?7
Температура. Энергия теплового движения молекул.
Молекулы какого газа при 200 С имеют среднюю квадратичную скорость 510 м\с?
Вычислить число молекул воздуха, находящихся в помещении размером 6х4х2,5м при температуре 270С и давлении 99,8 кПа
При какой температуре средняя квадратичная скорость молекул углекислого газа СО2 равна 400 м\с?
Определите средние кинетические энергии поступательного движения и средние квадратичные скорости молекул кислорода и водорода при температуре 270С?
При какой температуре Т средняя кинетическая энергия поступательного движения молекул газа равна 6,21·10–21 Дж?
Определите давление атмосферы Солнца (фотосферы), концентрация атомов в которой равна примерно 1,0∙1015 см–3, а температура 6000 К.
Найдите температуру газа при давлении 100 кПа и концентрации молекул 1,0∙1025 м–3.
Расстояние между центрами соседних атомов золота 2,9·10–10 м. Сколько атомов находится в слое золотой фольги толщиной 0,10 мкм?
Плотность алмаза 3500 кг/м3. Какой объем займут 1022 атомов этого
вещества?
Из чашки за промежуток времени 5,0 суток испарилась вода. Счи-
тая среднюю скорость испарения равной 7,0·1018 частиц в секунду, определите
массу воды, находившейся в чашке.
Определите плотность газа при давлении 1,3·105 Па, если средняя
квадратичная скорость его молекул равна 1,4·103 м/с.
Какой объем занимает газ при давлении 2·105 Па, если масса его
1 кг, а средняя квадратичная скорость молекул 600 м/с?
Найдите концентрацию молекул газообразного кислорода, находящегося при давлении 0,20 МПа. Средняя квадратичная скорость молекул
700 м/с.
Определите среднюю кинетическую энергию хаотического движения молекулы газообразного аргона массой 2 кг, если, находясь в сосуде
объемом 2 м3.
Определите среднюю кинетическую энергию хаотического поступательного движения всех молекул газообразного гелия в баллоне вместимостью 10 л при давлении 0,40·105 Па.
Идеальный одноатомный газ находится в сосуде под давлением 80 кПа и имеет плотность 4,0 кг/м3. Определите энергию теплового движения
молекул газа, если масса газа равна 1,0 кг.
Определите давление, при котором в объеме 1,0 м3 идеального газа при температуре 300 К содержится 2,4·1026 молекул.
Сколько молекул воздуха выходит из комнаты объемом 120 м3 при повышении температуры от 15 °C до 25 °С? Атмосферное давление 750 мм рт. ст.
Уравнение состояние идеального газа. Газовые законы.
Какая масса воздуха требуется для наполнения камеры в шине автомобиля, если ее объем 12 л? Камеру накачивают при температуре 27°С до давления 2,2·105 Па.
Баллон емкостью 100 л содержит 5,76 кг кислорода. При какой температуре возникает опасность взрыва, если баллон выдерживает давление до 5·105 Па?
В сварочном цехе стоят 40 баллонов ацетилена (С2Н2) емкостью 40 дм3 каждый. Все они включены в общую магистраль. После 12 ч непрерывной работы давление во всех баллонах упало с 1,3·107 до 0,7·107 Па. Определите расход ацетилена, если температура в цехе оставалась неизменной и была равна 32°С.
Баллон содержит сжатый кислород при температуре 25°С и давлении 1,5·107 Па. В ходе газовой сварки израсходована половина кислорода. Определите, какое давление установится в баллоне, если температура газа снизилась до 15°С.
В баллоне емкостью 100 л находится газ под давлением 4,9·105 Па. Какой объем займет газ при нормальном атмосферном давлении (1,01·105 Па)? Его температура не меняется.
При температуре 5°С давление воздуха в баллоне равно 104 Па. При какой температуре давление в нем будет 2,6·104 Па?
В кислородной системе, которой оборудован самолет, имеется 2,8·10-3 м3 кислорода при давлении 2·107 Па. При максимальной высоте подъема летчик соединяет с помощью крана эту систему с пустым баллоном объемом 5·10-2 м3. Какое давление установится в ней? Процесс расширения газа происходит при постоянной температуре.
Для сварки металлов и их сплавов в инертных газах гелий поставляют в баллонах под давлением 1,5·107 Па. Определите концентрацию молекул гелия (число молекул в единице объема) в баллоне при температуре 27°С.
Современная техника позволяет создавать очень высокий вакуум, порядка 10-7 Па. Сколько молекул газа остается при таком вакууме в камере емкостью 5·10-5 м3 при температуре 27°С?
Содержит газ под давлением 1,4 ·105 Па, соединили с пустым сосудом объемом 6 л. После этого в обоих сосудах установилось давление 105 Па. Найти объем первого сосуда. Процесс изотермический.
Открытая стеклянная колба вместимостью 250 см3 нагрета до 1270С. После этого ее горлышко опущено в воду. Какое количество воды войдет в колбу, если ее охладить до 70С? Атмосферное давление 100 кПа.
Определить плотность кислорода при давлении 1,3·105 Па, если средняя квадратичная скорость его молекул равна 1,4·103 м\с.
Какое давление на стенки сосуда производят молекулы газа, если масса 3·10-3 кг, объем 0,5 ·10-3 м3, средняя квадратичная скорость молекул 500 м\с?
Какова средняя квадратичная скорость движения молекул газа, который занимает объем 5м3 при давлении 2·105 Па и имеет массу 6 кг?
Каково давление углекислого газа (СО2), если в баллоне объемом 40 л содержится 5·1024 молекул, а средняя квадратичная скорость молекул 400 м\с?
Взаимное превращение жидкостей и газов.
При какой температуре кипит вода, если давление окружающей
среды равно: а) 47,3 кПа, б) 490 кПа?
При каком давлении вода будет кипеть при 19 °С?
Парциальное давление водяного пара в воздухе при 19 °С было
1,1 кПа. Найдите относительную влажность.
Относительная влажность воздуха в комнате равна 60% при
температуре 20 °С. Определите парциальное давление пара в комнате.
Абсолютная влажность воздуха при температуре 40 °С состав-
ляет 25 г/м3. Определите его относительную влажность.
При температуре 15 °C относительная влажность воздуха 80%.
Найдите его абсолютную влажность.
В комнате объемом 150 м3 при температуре 25 °C содержится 2,07 кг водяных паров. Определите:
а) абсолютную влажность воздуха, б) относительную влажность воздуха.
Сухой термометр психрометра показывает 16 °С, а влажный:
а) 14 °С, б) 12 °С. Определите температуру окружающей среды и относительную влажность воздуха.
Относительная влажность воздуха при температуре 20 °С равна
74%. Что показывает влажный термометр психрометра?
В закрытом сосуде вместимостью 2 л находится насыщенный
водяной пар при 20 °С. Сколько воды образуется в сосуде при понижении
температуры до 5 °С?
Вечером на берегу озера при температуре 18 °C относительная
влажность воздуха 75 %. При какой температуре утром можно ожидать появление тумана? Давление воздуха не изменяется.
Температура воздуха днем была 15 °С, относительная влажность
64 % . Ночью температура понизилась до 5 °C. Была ли роса? Давление воздуха не изменяется.
При 30 °C относительная влажность воздуха 80 %. Какой станет
относительная влажность этого же воздуха, если его нагреть до температуры
50 °C?
При температуре 284 К относительная влажность воздуха 81,5 %. При какой температуре Т2 влажность этого же воздуха будет 50,0 %?
В комнате объемом 120 м3 при температуре 15 °С относительная
влажность воздуха 60%. Определите массу водяных паров в воздухе комнаты.
Твердые тела.
Найти механическое напряжение, возникающее в стальном тросе при его относительном удлинении 0,001.
При растяжении алюминиевой проволоки длиной 2 м в ней возникло механическое напряжение 35 МПа. Найти относительное и абсолютное удлинения.
Балка длиной 5 м с площадью поперечного сечения 100 см2 под действием сил по 10 кН, приложенных к ее концам, сжалась на 1 см. Найти относительное сжатие и механическое напряжение.
К закрепленной одним концом проволоке диаметром 2 мм подвешен груз массой 10 кг. Найти механическое напряжение в проволоке.
К концам стальной проволоки длиной 3 м и сечением 1 мм2 приложены растягивающие силы по 210 Н каждая. Найти абсолютное и относительное удлинения.
Какие силы надо приложить к концам стальной проволоки длиной 4 м и сечением 0,5 мм2 для удлинения ее на 2 мм?
Во сколько раз относительное удлинение рыболовной лесы диаметром 0,2 мм больше, чем лесы диаметром 0,4 мм, если к их концам приложены одинаковые силы?
Диаметр капроновой рыболовной лесы 0,12 мм, а разрывная нагрузка 7,5 Н. Найти предел прочности на разрыв данного сорта капрона.
Основы термодинамики8.
В батарею водяного отопления поступает вода объемом 6·10-6 м3 в 1 с при температуре 80°С, а выходит из батареи при температуре 25°С. Какое количество теплоты получает отапливаемое помещение в течение суток?
Стальной резец массой 200 г нагрели до температуры 800°С и погрузили для закалки в воду, взятую при 20°С. Через некоторое время температура воды поднялась до 60°С. Какое количество теплоты было передано резцом воде?
Какое количество теплоты требуется для нагревания и расплавления 104 кг стального лома в мартеновской печи, если начальная его температура 20°С? Температура плавления стали 1500°С. Удельная теплота плавления стали 2,7·105 Дж/кг.
В плавильной печи за одну плавку получили 250 кг алюминия при температуре 660°С. Определите, на сколько изменилась внутренняя энергия алюминия, если его начальная температура была 20°С. Удельная теплота плавления алюминия 3,9·105 Дж/кг.
В электроплавильную печь загрузили 3 т стального лома при температуре 20°С. Какое количество электроэнергии требуется для расплавления стали, если КПД печи 95%?
Тепловоз массой 3000 т, двигавшийся со скоростью 72 км/ч, остановлен тормозами. Какое количество теплоты выделилось при торможении?
Газ, занимавший объем V1 = 11 л при давлении 105 Па, был изобарно нагрет от 20 до 100°С. Определите работу расширения газа.
1 м3 воздуха при температуре 0°С находится в цилиндре при давлении 2·105 Па. Какая будет совершена работа при его изобарном нагревании на 10°С?
Какая масса водорода находится в цилиндре под поршнем, если при нагревании от температуры T1 = 250 K до температуры Т2 = 680 К газ произвел работу А = 400 Дж?
Заключение
Самостоятельная работа всегда завершается какими-либо результатами. Это выполненные задания, упражнения, решенные задачи, построенные графики, подготовленные ответы на вопросы.
Таким образом, широкое использование методов самостоятельной работы, побуждающих к мыслительной и практической деятельности, развивает столь важные интеллектуальные качества человека, обеспечивающие в дальнейшем его стремление к постоянному овладению знаниями и применению их на практике.
В процессе изучения физики наряду с некоторыми теоретическими сведениями студенты овладевают определенными приемами решения задач. Обычно с такими приемами знакомит сам преподаватель, показывая решение задач нового образца. Наиболее эффективным при этом является такой подход, при котором преподаватель раскрывает перед студентами технологию решения задачи, показывает, чем мотивировано применение некоторого метода решения, чем обусловлен выбор того или иного пути.
Работа над задачей тоже может быть полностью самостоятельной работой студентов. Она преследует несколько целей:
продолжить формирование умений самостоятельно изучать текст, который в данном случае представляет собой задачу;
обучить рассуждениям;
обучить оформлению решения задач. К тому же студенты будут знать, что у них имеется образец рассуждений и оформления задачи, к которому они могут обратиться при решении другой задачи или при проверке правильности своего решения.
Непременным условием усвоения новых теоретических сведений и овладения новыми приемами решения задач является выполнение студентами тренировочных упражнений, в ходе которого приобретенные знания становятся полным достоянием студентов. Как известно, существуют две формы организации такой тренировочной работы — фронтальная работа и самостоятельная работа. Фронтальная работа на уроках физики — это традиционная, давно сложившаяся форма. Схематически ее можно описать так: один из студентов выполняет задание на доске, остальные выполняют это же задание в тетрадях. Самостоятельная работа студентов на уроке состоит в выполнении без помощи преподавателя и товарищей некоторого задания.
Большие возможности для подготовки студентов к творческому труду и самостоятельному пополнению знаний имеет самостоятельное выполнение заданий. В этом случае студент без какой-либо помощи должен наметить пути решения, правильно выполнить все построения, преобразования, вычисления и т. п. В таком случае мысль студента работает наиболее интенсивно. Он приобретает практический навык работы в ситуации, с которой ему неоднократно придется сталкиваться в последующей трудовой деятельности. Вместе с тем самостоятельная работа студентов на уроках физики имеет и свои недостатки. Усилия студента могут оказаться напрасными и не привести к результату, если он недостаточно подготовлен к решению поставленной задачи. Студент не слышит комментариев к решению, а рассуждения, которые он проводит мысленно, могут быть не всегда правильными и достаточно полными, причем возможности обнаружить это студент не имеет. Вообще при самостоятельном выполнении заданий мыслительные процессы не могут быть проконтролированы преподавателем. Поэтому даже верный ответ может оказаться случайным. Исправление ошибок, допущенных при самостоятельной работе, происходит в ходе ее проверки по окончании всей работы. Поэтому, выполняя упражнение самостоятельно, студент, не усвоивший материал, может повторять одну и ту же ошибку от примера к примеру и невольно закрепить неправильный алгоритм.
Литература
Дмитриева В.Ф. Физика// Учебное пособие для средних специальных учебных заведений. М.,2003
Енохович А.С. Краткий справочник по физике. М.,2003
Сборник задач по физике. Учебное пособие для средних специальных учебных заведений.\ Под ред. Р.А.Гладковой.- М.:Наука,2006
Сборник задач, упражнений и лабораторных работ по физике \ Под ред. Н.Д.Глухова . М.,2009
Савченко Н.Е. Задачи по физике с анализом решения.- М.: Просвещение, 2006
Рябоволов Г.И., Дадалова Н.Р., Самойленко П.И., Сборник дидактических заданий по физике. М.,2000
ФГОС среднего (полного) образования [электронный ресурс]//http://standart.edu.ru/catalog.aspx?CatalogId=6408
Типовое положение об образовательном учреждении СПО от 18.07.2008г № 543[электронный ресурс]//http://base.consultant.ru/cons/cgi/online.cgi?req=doc;base=LAW;n=78463
Рекомендации по планированию и организации самостоятельной работы студентов образовательных учреждений СПО в условиях действия ГОС СПО. Письмо Минобразования России от 29.12 2000 г. №16-52 [электронный ресурс]//http://news-city.info/akty/prawila-44/tekst-fz-pravitelstvo-russia.htm
Нормативные требования к организации самостоятельной работы при реализации ФГОС НПО/СПО нового поколения [электронный ресурс]// http://ogk.edu.ru/sites/all/files/materialy_vystupleniya.pdf
Организация внеаудиторной самостоятельной работы студентов (общие положения) [электронный ресурс]//reaviz.ru›content_files/file_uploads/ovsrs.doc
Самостоятельная внеаудиторная работа как один из компонентов речевого развития студентов техникума (из опыта работы) [электронный ресурс]// http://do.gendocs.ru/docs/index-245296.html
Хомина, О.Н. Организация внеаудиторной самостоятельной обучающихся при переходе на ФГОС [электронный ресурс] //http://nsportal.ru/shkola/obshchepedagogicheskie-tekhnologii/library/organizaciya-vneauditornoy-samostoyatelnoy-raboty
Приложение 1. Таблица Д.И. Менделеева.
Приложение 2. Постоянные величины
| Постоянная | Обозначения | Численное значение |
| Постоянная Больцмана | K | 1,38·10-23Дж\К |
| Постоянная Авогадро | Na | 6,02 ·1023 моль-1 |
| Молярная газовая постоянная | R | 8,31 Дж\моль·К |
| Нормальное атмосферное давление | pатм | 1011325 Па |
| Нормальный объем идеального газа | V0 | 2,24 ·10-2 м3\моль |
| Нормальная температура | T | 273,15 К |
Приложение 3. Приставки для образования десятичных кратных и дольных единиц
| Множитель | Приставка | Приставка | Наименование множителя | Пример |
| 1012 | тера | Т | триолион | ТПа |
| 109 | гига | г | миллиард | ГПа |
| 106 | мега | М | миллион | МПа |
| 103 | кило | к | тысяча | кПа |
| 10-3 | милли | м | одна тысячная | мПа |
| 10-6 | микро | мк | одна милионная | мкПа |
| 10-9 | нано | н | одна миллиардная | нПа |
| 10-12 | пико | п | одна триллионная | пПа |
Приложение 4. Международная система единиц (СИ)
| Физическая величина | Обозначение величины | Единица величины |
| символ | Русское |
|
| масса | m | кг | килограмм |
| Количества вещества | υ | моль | моль |
| Молярная масса | М | кг\моль | килограмм дел. на моль |
| Масса атома углерода | moc | кг | килограмм |
| Сила | F | Н | ньютон |
| Площадь поперечного сечения | S | м2 | квадратный метр |
| Давление | р | Па | паскаль |
| Концентрация | n | 1\м3 | единица дел. на кубический метр |
| Квадратичная скорость | V2 | м2\с2 | метр в квадрате дел. на секунду в квадрате |
| Кинетическая энергия | Ек | Дж | джоуль |
| Относительная молекулярная масса | Мr | г\моль | грамм дел. на моль |
| Число частиц | N | безразмерная величина |
| Температура по Кельвину | T | К | Кельвин |
| Объем | V | м3 | метр в кубе |
| Масса одной молекулы | m0 | кг | килограмм |
| Температура по Цельсию | t | 0С | градусов по Цельсию |
| Относительная влажность воздуха | φ | % | проценты |
| Абсолютное удлинение | ∆l | м | метр |
| Конечная длина | l | м | метр |
| Начальная длина | l0 | м | метр |
| Относительное удлинение | ε | безразмерная единица |
| Механическое напряжение | ϭ | Н\м2 | ньютона дел. на квадратный метр |
| Модуль Юнга | E | Па | паскаль |
| Диаметр | d | м | метр |
| Внутренняя энергия | U | Дж | Джоуль |
| Работа газа | A1 | Дж | Джоуль |
| Работа над газом | A | Дж | Джоуль |
| Количество теплоты | Q | Дж | Джоуль |
| Удельная теплоемкость | c | Дж/кг·°С | Джоуль дел. на килограмм умн. на градус по Цельсию |
| Удельная теплота парообразования | R | Дж/кг | Джоуль дел. на килограмм |
| Удельная теплота плавления | ʎ | Дж/кг | Джоуль дел. на килограмм |
| Количество теплоты полученное от нагревателя | Q1 | Дж | Джоуль |
| Количество теплоты отданное холодильнику | Q2 | Дж | Джоуль |
| Коэффициент полезного действия | ɳ | % | проценты |
| Удельная теплота сгорания | q | Дж/кг | Джоуль дел. на килограмм |
1
2
3
4
5
6
7
8







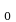 данного вещества к
данного вещества к 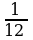 массы атома углерода m
массы атома углерода m : Mr =
: Mr =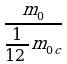
 и называют постоянной Авогадро в честь итальянского учёного.
и называют постоянной Авогадро в честь итальянского учёного. 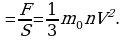

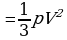 1
1
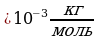
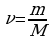
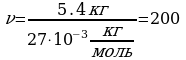 моль
моль .
.  -? Ответ: 200 моль.
-? Ответ: 200 моль.
 Подставим
Подставим 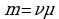 в первую формулу
в первую формулу  (Hg)=13.6·10
(Hg)=13.6·10 V=
V=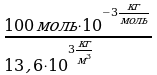 =1,5 ·10
=1,5 ·10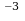 м
м

 V-? Ответ: 1,5·10
V-? Ответ: 1,5·10
 m (O
m (O )=10 г. 0,01кг.
)=10 г. 0,01кг. 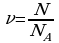 (1)
(1)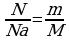
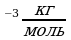 Выразим N; получаем
Выразим N; получаем 
 Na=6.02·10
Na=6.02·10 моль
моль N=
N=
 1,88·10
1,88·10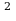 , нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии?
, нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии? Дано СИ Решение
Дано СИ Решение
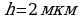

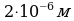 N= , но масса цинка не известна.
N= , но масса цинка не известна.  Найдём массу цинка через объём и плотность.
Найдём массу цинка через объём и плотность.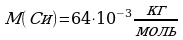
 , объём найдём, зная площадь поверхности
, объём найдём, зная площадь поверхности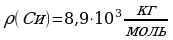 Подставим в начальную формулу
Подставим в начальную формулу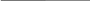 N-?
N-? 
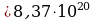 молекул
молекул
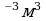 N=
N= Найдём массу воды через объём и плотность. m=
Найдём массу воды через объём и плотность. m=

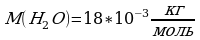 N=
N=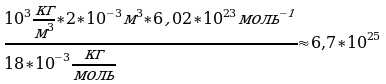

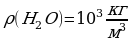
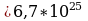
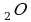 )=0.5 кг. N
)=0.5 кг. N =
=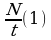 Чтобы найти число молекул, испаряющихся за
Чтобы найти число молекул, испаряющихся за  с. 1сек. - N
с. 1сек. - N =18·10
=18·10 Подставим(2)
Подставим(2) (1) и учтем время в секундах.
(1) и учтем время в секундах. 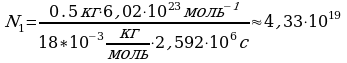 N
N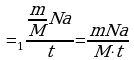
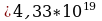

 S=20 км
S=20 км частиц соли N V=hS(1); N=
частиц соли N V=hS(1); N=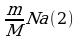 ; N
; N
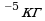 Подставим (1) и (2) в (3)
Подставим (1) и (2) в (3) 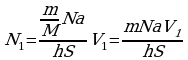
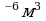
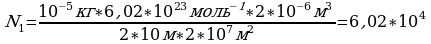
 N
N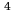
 Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600
Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600 , а его плотность 1,54
, а его плотность 1,54 ?
? Дано СИ Решение
Дано СИ Решение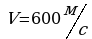
 Отразим на произведение m
Отразим на произведение m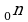


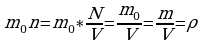 Следовательно,
Следовательно, 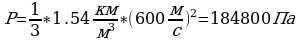 Ответ:1,848*10
Ответ:1,848*10


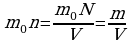 Следовательно,
Следовательно, 
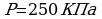 2,5*10
2,5*10 V-? 1. Умножим первую и правую части на 3V: 3РV=mV
V-? 1. Умножим первую и правую части на 3V: 3РV=mV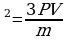
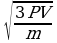
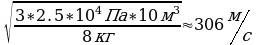

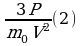
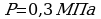 3*10
3*10 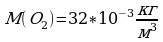 Для этого воспользуемся малярной массой кислорода
Для этого воспользуемся малярной массой кислорода  Na=6,02*10
Na=6,02*10 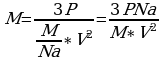
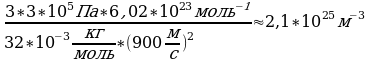

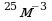 .
.
 Дано СИ Решение
Дано СИ Решение 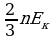 Eк
Eк 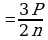 E
E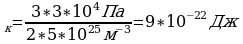
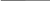 N=5*10
N=5*10 -? Ответ:9*10
-? Ответ:9*10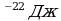
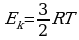
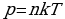
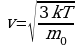 3
3 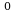 С и давлении 1,2 МПа.
С и давлении 1,2 МПа.
 . Е
. Е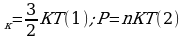 Выразим из (2) уравнения n=n=
Выразим из (2) уравнения n=n=
 Итак: Е
Итак: Е и n=
и n=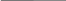 Е
Е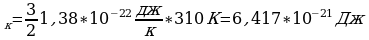
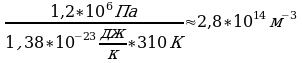

 Па P=nКТ (1) . Выразим Т из Уравнения (1): Т=
Па P=nКТ (1) . Выразим Т из Уравнения (1): Т=

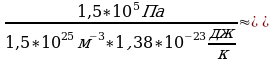 724 К; V=
724 К; V=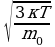 (2)
(2) Масса молекулы водорода неизвестна. Найдем его,
Масса молекулы водорода неизвестна. Найдем его, 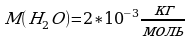
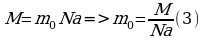 Подставим выражение (3) в
Подставим выражение (3) в  Т-? V-? .
Т-? V-? . 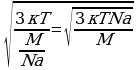
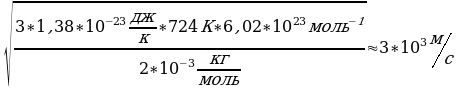
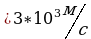

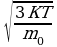 (1). Выразим из уравнения(1)поэтапно
(1). Выразим из уравнения(1)поэтапно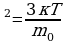
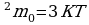

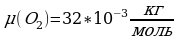 3.Разделим обе части на 3К: Т=
3.Разделим обе части на 3К: Т=
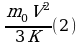 , но мы не знаем m
, но мы не знаем m Подставим (3) в (2), получим:
Подставим (3) в (2), получим: 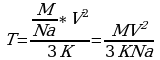 Т=
Т=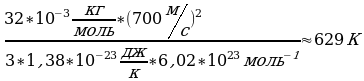
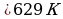

 m
m
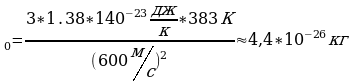 Ответ:
Ответ: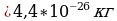
 ,
, 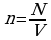 ,
,  ,
, 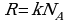 →
→ 
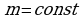 ,
, 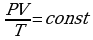 ,
, 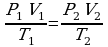
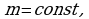
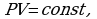
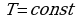













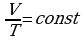 ,
, 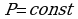







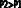
 Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.
Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.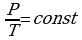 ,
,










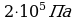 Воспользуемся уравнением состояния идеального газа,
Воспользуемся уравнением состояния идеального газа,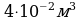
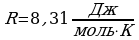

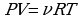 , выразим
, выразим 
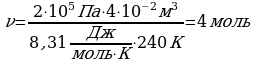

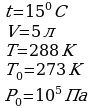

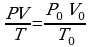 Выразим
Выразим  из уравнения Клапейрона:
из уравнения Клапейрона: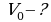
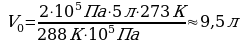

 в задаче речь идет о изменении макропараметров без
в задаче речь идет о изменении макропараметров без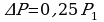 изменения массы газа.
изменения массы газа. 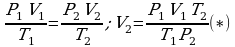
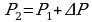 и
и 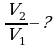 подставим в (*), получим:
подставим в (*), получим: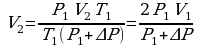
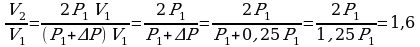

 Воспользуемся законом Бойля-Мариотта, так как в задаче
Воспользуемся законом Бойля-Мариотта, так как в задаче 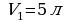 идет речь о изотермическом процессе без изменения массы
идет речь о изотермическом процессе без изменения массы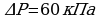
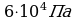 газа.
газа. 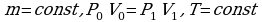
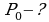 Так как
Так как 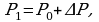 то имеем
то имеем
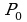 из предыдущего выражения, получим:
из предыдущего выражения, получим: 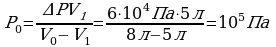
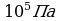

 Дано СИ Решение
Дано СИ Решение В данной задаче переводить литры в м3 нет необходимости, так как
В данной задаче переводить литры в м3 нет необходимости, так как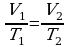 1=270C воспользуемся законом Гей-Люссака (давление постоянно).
1=270C воспользуемся законом Гей-Люссака (давление постоянно).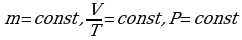
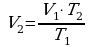 2 = 770C
2 = 770C  T2=350K
T2=350K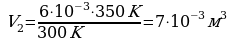

 Дано СИ Решение
Дано СИ Решение Так как сосуд закрыт, следовательно, масса газа не изменятся и объем
Так как сосуд закрыт, следовательно, масса газа не изменятся и объем газа не изменен. Значит, воспользуемся законом Шарля.
газа не изменен. Значит, воспользуемся законом Шарля.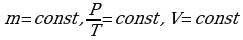
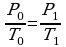 , но
, но 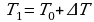 и
и 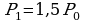
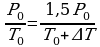 , на Р0 можно сократить и преобразовать выражение:
, на Р0 можно сократить и преобразовать выражение: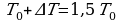 Перенесем в левую часть все Т0 , а в правую все остальное .
Перенесем в левую часть все Т0 , а в правую все остальное .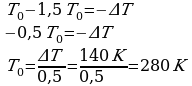
 называют отношение парциального давления
называют отношение парциального давления  водяного пара, содержащегося в воздухе при данной температуре, к давлению
водяного пара, содержащегося в воздухе при данной температуре, к давлению 
 Для решения задачи воспользуемся алгоритмом «Точка росы»
Для решения задачи воспользуемся алгоритмом «Точка росы»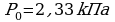 ; 2.
; 2. 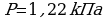

 3.
3. 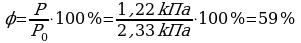
 Задача 2. Влажный термометр психрометра показывает 100С, а сухой 140С. Найти относительную влажность воздуха.
Задача 2. Влажный термометр психрометра показывает 100С, а сухой 140С. Найти относительную влажность воздуха. Дано СИ Решение
Дано СИ Решение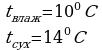 Для решения данной задачи воспользуемся психрометрической таблицей:
Для решения данной задачи воспользуемся психрометрической таблицей:

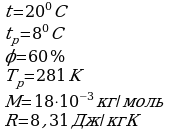 Для решения задачи необходимо воспользоваться формулами
Для решения задачи необходимо воспользоваться формулами 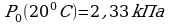
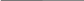 (из таблицы)
(из таблицы) 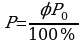
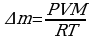
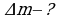


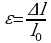
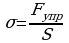
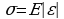 6
6
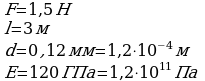
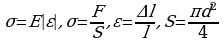

 Сравним правые части закона Гука и механического напряжения, учтем при этом относительное удлинение и площадь, получим:
Сравним правые части закона Гука и механического напряжения, учтем при этом относительное удлинение и площадь, получим: 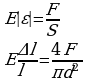 Выразим из этого выражения искомую величину:
Выразим из этого выражения искомую величину: 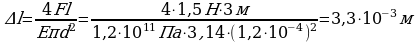 Ответ: 3,3 мм
Ответ: 3,3 мм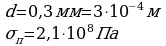 Для решения задачи воспользуемся определением механического
Для решения задачи воспользуемся определением механического 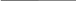 круглая).
круглая). 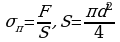

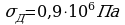 ?
? Созданное весом стен давление равно
Созданное весом стен давление равно  , где
, где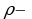 плотность кирпича,
плотность кирпича, 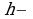 высота кладки
высота кладки
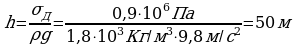
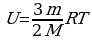 . Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.
. Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.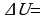

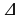 h=pS(h
h=pS(h )
)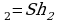 , поэтому А’=p(V
, поэтому А’=p(V -изменение объема газа.
-изменение объема газа. 
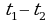 )=cm
)=cm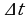
 . Qпл=
. Qпл=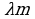 ; Qкр=-
; Qкр=-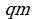 ; Qкр=-
; Qкр=- ; Q=
; Q=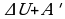


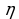
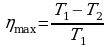 →
→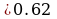 →
→ 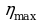 =62%
=62%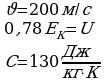 Так часть кинетической энергии перешла во внутреннюю, следовательно,
Так часть кинетической энергии перешла во внутреннюю, следовательно,  пуля нагрелась. Значит
пуля нагрелась. Значит 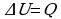
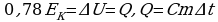 ,
, 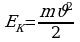 Получим:
Получим: 
 , массу можно сократить. Выразим
, массу можно сократить. Выразим 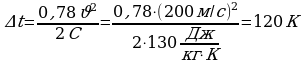
 А-? А=Р*∆V=2*105*0.0366 = 7326 Дж =7.3 кДж
А-? А=Р*∆V=2*105*0.0366 = 7326 Дж =7.3 кДж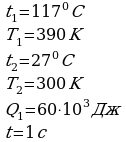 ано СИ Решение
ано СИ Решение
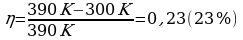
 Найдем количество теплоты, отданной холодильнику.
Найдем количество теплоты, отданной холодильнику. 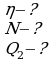
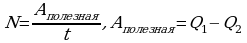 ,
, 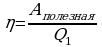 ,
,