Лабораторная работа № 2.
«Определение жесткости воды»
Тема: «Вода и её экологическое значение»
Цель работы: с помощью метода комплексонометрии определить жесткость воды в различных природных водоемах.
Задачи: 1) образовательная: с помощью объемного метода анализа определить катионы кальция и магния в воде.
2) развивающая: развивать в процессе формирования понятий диалектического подхода и специфических способов познания;
3) воспитательная: формирование химической картины природы, необходимых норм отношения к окружающей действительности.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Жесткость — один из технологических показателей, принятых для характеристики состава и качества природных вод.
Жесткой называют воду с повышенным содержанием ионов Са2+ и Mg2+ . Сумма концентрации ионов Са2+ и Mg2+ . является количественной мерой жесткости воды:
Ж = ССа2+ + СMg2+
Измеряют жесткость числом миллимолей ионов жесткости (Ca2+ и Mg2+ в 1 кг воды (ммоль/кг). В связи с тем, что плотность воды близка к единице, жесткость можно измерять в ммоль/дм3 или ммоль/л. Различают жесткость воды общую Жо, карбонатную Жк и некарбонатную Жнк.
Комплексонометрическое определение общей жесткости воды производится с помощью реактива, который имеет целый ряд названий: трилон Б, комплексон III, хелатон 3 и др. По химической номенклатуре – это динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА)
(HOОCH2)2N – CH2 – CH2 – N(CH2COONa)2·H2O
Трилон Б образует очень устойчивые комплексы с большинством катионов: Ca2+; Mg2+; Co2+; Cu2+; Ni2+; Zn2+; Fe2+ и др. При рН=10 трилон Б связывает катионы кальция и магния. В качестве индикатора применяется хромоген черный, который в присутствии этих ионов образует комплексы [Ca Ind]- и [Mg Ind]- вино-красного цвета. В результате титрования раствора, содержащего кальций, магний и индикатор, раствором комплексона III, ионы жесткости связываются в более прочный комплекс с комплексоном и в точке эквивалентности анионы индикатора освобождаются и придают раствору синюю окраску.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ
Отберите мерным цилиндром 100 мл воды и перенесите ее в коническую колбу. Добавьте к исследуемой воде 5 мл аммонийной буферной смеси и несколько кристаллов хромогена до получения вино-красного раствора.
Приготовленную пробу оттитруйте 0,05н раствором трилона Б до перехода вино-красной окраски индикатора в синюю.

Результат титрования запишите.
Повторите титрование еще раз. Если результаты двух титрований совпадут (∆V
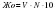
где V— объем раствора трилона Б; N - молярная концентрация эквивалентов раствора трилона Б , 10 - коэффициент перевода моль/л в ммоль/л.
ОПРЕДЕЛЕНИЕ КАРБОНАТНОЙ И НЕКАРБОНАТНОЙ ЖЕСТКОСТИ ВОДЫ
Отберите мерным цилиндром 100 мл воды и перенесите ее в коническую колбу. Добавьте к исследуемой воде несколько капель метилового оранжевого, чтобы окраска раствора в колбе по интенсивности была близкой к окраске контрольного раствора с этикеткой «до титрования».

Приготовленную пробу оттитруйте раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую (но не розовую, см. контрольные растворы.) Результат титрования запишите.
Повторите титрование еще раз. Если результаты двух титрований совпадут (∆V

где V1— объем анализируемой воды, мл; V2 - объем раствора НСl, с - молярная концентрация эквивалентов раствора НС1, моль/л; 1000 - коэффициент перевода моль/л в ммоль/л.
Некарбонатную жесткость воды ЖНК находят по разности
ЖНК = ЖО - ЖК.
Результаты опыта сведите в таблицу:
| Объем раствора НСl V2 | Молярная концент-рация эквивалентов раствора HС1 cэк(2) | Объем исследуемой пробы V1 | Жесткость воды |
| Жк | Жнк |
|
|
|
|
|
|
Контрольные задания:
На чем основан метод комплексометрии?
Какой технологический показатель качества воды называют жесткостью?
Какие катионы называют ионами жесткости?
Как рассчитать карбонатную жесткость воды?
Основная литература
Коровин, Н.В. Лабораторные работы по химии / Н.В.Коровин, Э.М. Мингулина, Н.Г. Рыжова; Под ред. Н.В Коровина. – М.: Высшая школа, 2001. – 256 с.
Дополнительная литература
Ахметов, Н.С. Общая и неорганическая химия : учеб. / Н.С.Ахметов. – М.: Высшая школа. 1998. – 448 с.
Гельфман, М.И. Химия : учеб. / М.И.Гельфман, В.П.Юстратов. – СПб.: Издательство «Лань», 2008. – 480 с.
Горшков, В.И. Основы физической химии : учеб. / В.И.Горшков, И.А.Кузнецов. – М.: БИНОМ. Лаборатория знаний, 2006. – 407 с.
Гуров, А.А. Химия: учеб. / Гуров А.А. М.: МГТУ им.Н.Э.Баумана, 2008. -784с.
Попков, В.А. Общая химия: учеб. / В.А. Попков, С.А. Пузаков. – М.: ГЭОТАР-Медиа. 2007. – 420 с.
Пожидаев, Е.Д. Химия : учеб. пособие. / Е.Д.Пожидаев. М. : ООО «Группа ИДТ», 2008. – 392 с.