
Нитрат кислотасының оксидлаштыру үзлекләре.

Дәреснең максаты:
Оксидлаштыручы буларак нитрат кислотасының үзенә генә хас үзлекләре белән танышу, аның аксымнар, металлар һәм неметаллар белән реагирлашу үзенчәлекләрен билгеләү . Электрон баланс методы ярдәмендә нитрат кислотасы катнашында барган оксиидлаштыру- кайтарылу реакцияләрен тигезләү

Түбәндә бирелгән матдәләрнең нитрат кислотасы белән барган тигезләмәләрен язарга :
1 вариант
2вариант
- Бакыр (II) оксиды белән ,
- Натрий гидроксиды белән
- Цинк оксиды белән,
- натрий силикаты белән
Электролитик диссоциация күзлегеннән чыгып, реакцияләрне молекуляр, тулы һәм кыскартылган ионлы тигезләмәләрен языгыз.

Үзара тикшерү
2 вариант
1 вариант
2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O
2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O
2H + + 2NO 3 – + Zn(OH) 2 = Zn 2+ +2NO 3 – +
+2H 2 O
2H + + Zn(OH) 2 = Zn 2+ + 2H 2 O
2HNO 3 + Na 2 SiO 3 = ↓H 2 SiO 3 + 2NaNO 3
2H + + 2NO 3 – + 2Na + + SiO 3 2– = ↓H 2 SiO 3 +
+2Na + + 2NO 3 –
2H + + SiO 3 2– = ↓H 2 SiO 3
2H + + 2NO 3 – + CuO = Cu 2+ + 2NO 3 – + H 2 O
2H + + CuO = Cu 2+ + H 2 O
HNO 3 + NaOH = NaNO 3 + H 2 O
H + + NO 3 – + Na + + OH – = Na + + NO 3 – + H 2 O
H + + OH – = H 2 O

Нитрат кислотасының специфик үзлекләре.
1. Яктыда һәм җылытканда таркала.
HNO 3 → NO 2 + O 2 + H 2 O

Нитрат кислотасының специфик үзлекләре.
2.Куертылган нитрат кислотасы аксымнар белән тәэсир итешә.
Нитрат кислотасы органик матдәләрне дә оксидлаштыра. Кислота тәнгә тигәндә тиредә пешкән эзләр, ә җиңелчә очракта сары тап кала.
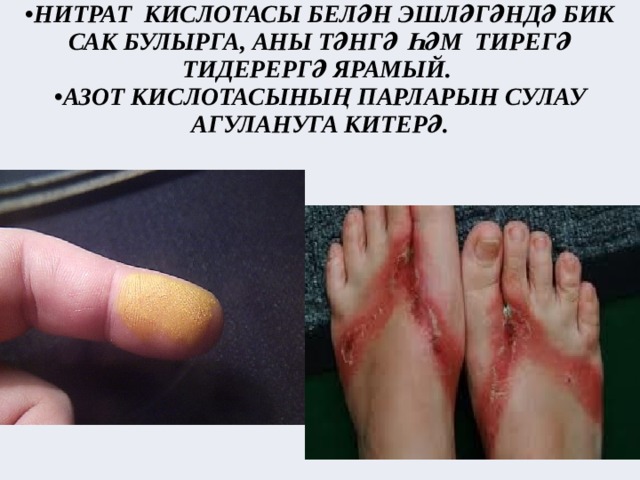
- НИТРАТ КИСЛОТАСЫ БЕЛӘН ЭШЛӘГӘНДӘ БИК САК БУЛЫРГА, АНЫ ТӘНГӘ ҺӘМ ТИРЕГӘ ТИДЕРЕРГӘ ЯРАМЫЙ.
- АЗОТ КИСЛОТАСЫНЫҢ ПАРЛАРЫН СУЛАУ АГУЛАНУГА КИТЕРӘ.

3.Нитрат кислотасы неметаллар белән реакциягә керә.
Нитрат кислотасы көчле оксидлаштыручы. Ул барлык неметаллар белән диярлек реагирлаша. Бу вакытта HNO 3 неметаллны аның туры килгән кислотасына кадәр оксидлаштыра һәм үзе куертылган ( әгәр кислотаның концентрациясе 60% тан югары) булса NO 2 гә, әгәр сыегайтылган (әгәр кислотаның концентрациясе 15-20%) булса NO га кадәр кайтарыла.

Тәҗрибә1: Нитрат кислотасының углерод белән тәэсир итешүе .
Тәҗрибә 2: Нитрат кислотасының фосфор белән тәэсир итешүе .
Реакция тигезләмәләрен язырга һәм электрон баланс методы белән тигезләргә..

Тәҗрибә1: Нитрат кислотасының углерод белән тәэсир итешүе .
HNO 3 + С → СO 2 + H 2 O + NO 2
2
4
4
HNO 3 ( N +5 ) –оксидлаштыручы, кайтарылу процессы .
N +5 + 1e → N +4 1
C – кайтаручы, окислашу процессы
С 0 – 4e → С +4 4
4
4
1
Тәҗрибә1: Нитрат кислотасының фосфор белән тәэсир итешүе .
5
5
HNO 3 + P → H 3 PO 4 + NO 2 + H 2 O
N +5 + 1e → N +4
P 0 – 5e → P +5
1
5
HNO 3 ( N +5 ) – оксидлаштыручы, кайтарылу процессы .
P – кайтаручы, окислашу процессы
5
5
1

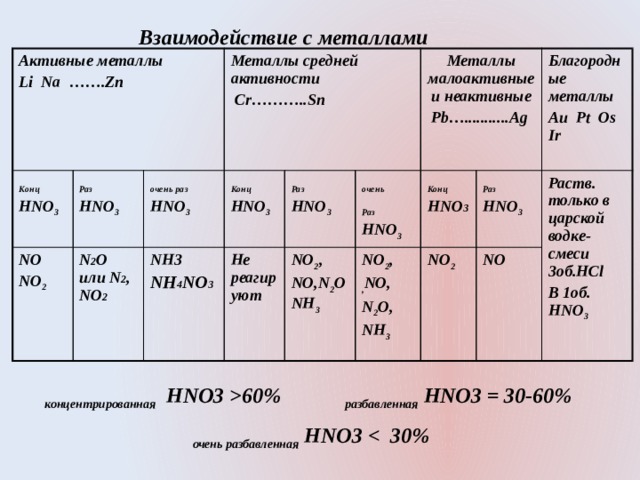
- Нитрат кислотасы барлык диярлек металлар белән реакциягә керә, шул исәптән активлык рәтендә водородтан торучылар белән дә.
- Бу реакцияләрдә азотның кайтарылуы каислотаның концентрациясенә, металлының активлыгына һәм температурага бәйле. Температура түбән булган азот ныграк кайтарыла. Бу реакцияләрдә беркайчан да водород хасил булмый . Чөнки азот оксидлаштыру үзлеклекләре Н + хисабына түгел, ә N +5 тәэсир ендә бара.
- Al, Fe, Be, Cr, Ni, Pb кебек металлар белән салкын куертылган нитрат кислотасы белән реагирлашмый. Нитрат кислотасын җылытканда яки сыеклаганда бу металлар кислотада эриләр.
 60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 " width="640"
60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 " width="640"
Взаимодействие с металлами
Активные металлы
Li Na …….Zn
Конц
NO
HNO 3
Раз
Металлы средней активности
N 2 O или N 2 , NO 2
NO 2
HNO 3
очень раз
Конц
NH3
HNO 3
Cr………..Sn
NH 4 NO 3
Не реагируют
HNO 3
Раз
NO 2 ,
HNO 3
очень
Металлы малоактивные и неактивные
NO,N 2 ONH 3
Раз
Конц
NO 2 ,
Pb…...........Ag
, NO,
NO 2
HNO 3
Раз
HNO 3
Благородные металлы
Раств. только в царской водке-смеси 3об.HCl
HNO 3
N 2 O,
Au Pt Os Ir
NO
B 1об. HNO 3
NH 3
концентрированная HNO3 60% разбавленная HNO3 = 30-60%
очень разбавленная HNO3

Тәҗрибә3. «Нитрат кислотасының металлар белән тәэсир итешүе . ( бакыр мисалында)
Запишем уравнения этих реакций .
1) HN +5 O 3(конц.) + Cu 0 = Cu +2 (NO 3 ) 2 + N +4 O 2 + H 2 O
2
2
4
окисидлаштыручы (кайтарылу процессы
N +5 + 1e → N +4
Cu 0 – 2e → Cu +2
2
1
2
1
Кайтаручы ( оксидлашу процессы)
2
3
3
8
2
2) HN +5 O 3(сыек.) + Cu 0 = Cu +2 (NO 3 ) 2 + N +2 O + H 2 O
4
N +5 + 3e → N +2
Cu 0 – 2e → Cu +2
3
2
окисидлаштыручы (кайтарылу процессы
6
2
3
Кайтаручы ( оксидлашу процессы)

Өйрәнелгән материалны ныгыту
- Цинкның куертылган һәм бик сыегайтылган нитрат кислотасы белән реакция тигезләмәсен язырга һәм электрон баланс методын кулланып тигезләргә.

1) HN +5 O 3(конц.) + Zn 0 = Zn +2 (NO 3 ) 2 + N +4 O 2 + H 2 O
2
4
2
2
1
окислитель (процесс восстановления)
N +5 + 1e → N +4
2
Zn 0 – 2e → Zn +2
1
2
восстановитель (процесс окисления)
2) HN +5 O 3(сыег.) + Zn 0 = Zn +2 (NO 3 ) 2 + N -3 H 3 + H 2 O
9
3
4
4
2
окислитель (процесс восстановления)
N +5 + 3e → N +2
3
6
Zn 0 – 2e → Zn +2
2
3
восстановитель (процесс окисления)

Рефлексия

Өйгә эш
- § 19 кабатларга, дәфтәрдәге язмаларны өйрәнергә, 59 нчы биттәге 4,7 күнегү.
- Таблицадан файдаланып нитрат кислотасының металлар белән ике тигезләмәсен язарга һәм электрон баланс методы белән тигезләргә.

Литература:
- Химия 9 класс, Рудзитис Г.Е, Фельдман Ф.Г, изд. Просвещение 2008, 2012 г
- Окислительно – восстановительные реакции. Хомченко Г. П , Севастьянова К.И изд. Просвещение 2012 г
- А.Г. Кульман. Общая химия, Москва-1989.
- Интернет ресурсы: http://school-collection.edu.ru
http://fcior.edu.ru
















 60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 " width="640"
60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 " width="640"

























