Нуклеиновые кислоты – это макромолекулы, построенные из нуклеотидов, соединенных фосфодиэфирными связями. Последовательность нуклеотидов в составе цепи ДНК составляет сущность генетического кода. Рассмотрим структуры оснований из состава нуклеиновых кислот:
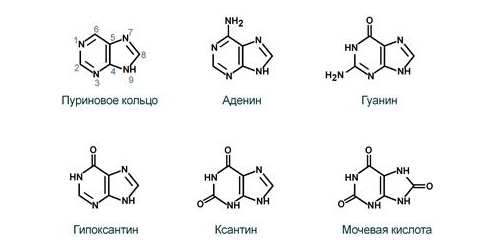
Рисунок 1Строение пиримидиновы оснований
Основания связываются с углеводной частью (D-рибозой, 2-дезокси-D-рибозой) N-гликозидной связью, образуя нуклеозид. Нуклеозид, в свою очередь, сочетаясь с одним или несколькими остатками фосфата в 3' или 5' положении, образует нуклеотид. Нуклеиновые кислоты отличаются углеводной частью, а также одним из пиримидиновых оснований (тимин в ДНК, урацил в РНК). Как правило, цепи РНК одноцепочечны, а ДНК – двуцепочечны, причем основания строго комплементарны.[5] Установлено, что ионы металлов необходимы для нормального функционирования нуклеиновых кислот и принимают активное участие в их реакциях. Одним из ключевых является вопрос о центрах связывания данных молекул с ионами металла и их взаимной конкуренции. Для азотистых оснований таковыми являются донорные атомы азота и кислорода. Нуклеозиды, кроме того, содержат гидроксильные группы углевода, а нуклеотиды – еще одну донорную группу – фосфатную. Следует отметить, что для свободных оснований комплексообразование активно происходит за счет вытеснения подвижного протона, а у их производных положения N-1 пиримидинов и N-9 пуринов лишены такой возможности.[10]
Из-за большого количества донорных центров изучение комплексообразования в таких системах – непростая задача. Однако можно выделить следующие закономерности:
1.по мере усложнения молекулы в ряду основание–нуклеозид–нуклеотид устойчивость образуемых комплексов возрастает (сравнение с нуклеиновыми кислотами здесь неправомерно в силу их полимерной природы);
2.для большинства ионов металлов прочность координационной связи ослабевает в ряду фосфат основание углевод;
3.среди молекул с различными основаниями устойчивость комплексов изменяется в ряду гуанин цитозин аденин урацил тимин;
4.комплексы ДНК устойчивее аналогичных для РНК.[7]
Для иллюстрации вышесказанного приведем величины констант устойчивости комплексов некоторых металлов с аденозином и его нуклеотидами состава 1 : 1 (табл. 1). Укажем на их соответствие ряду Ир-винга – Уильямса. Аналогичные данные получены для комплексов одно-го металла с различными основаниями. Так, для меди lоg β комплексов с аденозином равен 0,8, с цитидином – 1,6, а с гуанозином – 2,2.
Особенностью пуриновых и пиримидиновых оснований является амбидентантность лигандов и, как следствие, сложность в установлении строения их комплексов. Пуриновые и пиримидиновые основания имеют два реакционных центра, связанных в единую мезомерную (сопряженную) систему. [10] Причиной этому служит молекулярное структура оснований, а именно наличие нескольких эндоциклических атомов азота, а также потенциально донорных экзоциклических групп и атомов (например NH2, О).
Для определения строения комплексов пуриновых и пиримидиновых оснований используют физические, преимущественно спектральные, методы: УФ-, ИК- и КР-спектроскопию, рентгеноэлектронную спектроскопию, круговой дихроизм, флуоресцентный анализ, атомную абсорбцию и, в большей степени, радиоспектроскопию на ядрах Ή, 13С, 15N, I95Pt. Сложность ИК-спектров лигандов и малая чувствительность УФ-спектров их к изменению способа связи ограничивает применение этих методов для определения строения комплексов. Наиболее информативны и однозначны методы ЯМР. Во многих работах спектральные методы применяются для изучения комплексообразования Rh(Ⅲ) с пуриновыми и пиримидиновыми основаниями в растворах. Однако в этих условиях возможно существование ряда комплексных cоединений. Большая определенность в отношении состава и строения комплексов может быть достигнута при спектральном изучении выделенных соединений. К окончательным заключениям относительно строения комплексов приводят рентгеноструктурные исследования, но их не всегда можно осуществить из-за монокристаллов.
Потенциометрическое титрование щелочью используют для обнаружения протонированных NH-групп в координированных лигандах, характеристики влияния координации на кислотность лигандов, исследования состояния комплексов в различных средах.
Кондуктометрический метод применяют для изучения кинетического замещения хлорид-ионов в реакциях соединений родия с пуриновыми и пири-мидиновыми основаниями и их нуклеозидами. Главная роль в установлении строения комплексов отводится методам ЯМР.
Укажем здесь подробнее на возможности применения протонного магнитного резонанса (ПМР). Сравнение спектров ПМР свободных и координированных лигандов позволяет получить сведения о нелабильных протонах (например Η (2) и Η (8) в молекуле аденозина). Координация вызывает изменения в спектре ПМР лигандов в следствие уменьшения электронной плотности при образовании донорно-акцепторной связи наблюдается дезэкранирование ближайшего к донорному атому протона и сдвиг его сигнала в слабое поле. Изучение спектров ПМР позволяет охарактеризовать также состояние лабильных протонов групп NH2, ОН и SH в координированных лигандах. В дальнейшем будут приведены примеры применения и других радиоспектроскопических методов к исследованию строения комплексов Rh(Ⅲ) с пуриновыми и пиримидиновыми основаниями.
Для координационных соединений металлов VIII группы отмечена также бактерицидная активность: это K3[Rh(NO2)6],транс-[RhCl(py)4]ClH2O, K2[RuCl5(NO)], (NH4)2[IrCl6], [Pd(NH3)ox], [Pd(Q)2] 2H2O (Q = меркаптопурин или др. гетероциклический амин), (NH4)2[OsCl6].
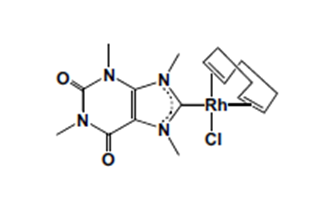
Рисунок 2
Каждый этап выражения генетической информации в организме осуществляется с участием ионов металлов.
Репликация представляет собой процесс полуконсервативного удвоения молекул ДНК на основе принципа комплементарности. Установлено, что для протекания полимеразной реакции помимо присутствия четырех нуклеотидов необходимо наличие в среде ионов Mg2+. Один из ключевых ферментов процесса – ДНК-полимераза, содержит прочно связанные ионы Zn2+, посредством которых реализуется связывание молекулы ДНК. Ионы же Mg2+ необходимы для присоединения нуклеозидтрифосфата к ферменту. В модельных экспериментах показано, что ионы Mg2+ могут заменяться ионами Mn2+, однако при этом процесс дает сбои – происходит включение в состав растущей цепи ДНК рибонуклеотидов. Исчерпывающего объяснения данного факта не предложено. Кроме того, открыта система биосинтеза ДНК на РНК в качестве матрицы, где ключевую роль играет ревертаза – Zn-содержащий фермент, активируемый ионами Mg2+ и Mn2+.
Транскрипция – процесс переписывания содержащейся в ДНК-матрице генетической информации в последовательность нуклеотидов в новообразуемой молекуле РНК. Основной фермент процесса – РНК-полимераза нуждается в содействии ионов металлов (Mg2+, Mn2+, Co2+). При этом, как и в предыдущем случае, ионы Mg2+ обеспечивают нор-мальное протекание процесса, а ионы Mn2+ неселективны и зачастую обусловливают гомополимеризацию рибонуклеотидов. Отметим, что в некоторых белковых факторах транскрипции содержится цинк(II). Кро-ме того, ряд ионов металлов определяет частоту экспрессии генов, участвуя в индукции или репрессии процесса транскрипции.
Трансляция – процесс синтеза белка на матрице РНК. Роль ионов металла в данном процессе – формирование необходимой конформации транспортной РНК и рибосом. Так, ионы Mg2+ необходимы для удержания субчастиц рибосом, и при отклонении в их концентрации наблюда-ется диссоциация или же, наоборот, агрегирование. Кроме того, в случае их высокой концентрации в среде усиливается ложное кодирование.
Рассмотрим особенности комплексов нуклеиновых кислот. Как отмечалось выше, основные центры связывания – фосфатные группы и азотистые основания, причем у пиримидинов особенно активно положение N-3, а у пуринов – положение N-7. В случае ДНК, как и для белков, общепринято рассматривать несколько уровней организации: первичная структура – последовательность нуклеотидов в цепи, вторичная – конформационная организация двойной спирали, третичная – форма существования молекулы в организме. Ионы металла необходимы для реализации последних двух структур. Установлено, что при снижении концентрации электролита ниже 2,10–3 моль/л, инициируется самопроизвольное раскручивание цепей ДНК. Протеканию этого процесса препятствуют ионы Mg2+ и Co2+, что объясняется их связыванием с фосфатными группами (в результате нейтрализуется их заряд и происходит стабилизация спирали). Напротив, ионы Cu2+, связываясь с азотистыми основаниями, нарушают систему водородных связей, дестабилизируют си-стему и вызывают раскручивание цепей. Более того, их присутствие препятствует ренатурации и новообразованию спиральных структур. Однако прямых доказательств этой роли in vivo не получено. Установле-но, что ионы Mg2+, Mn2+ и Cа2+ повышают порог термоденатурации ДНК. Ионы тяжелых металлов, такие как Ag+ и Hg2+, реализуют интеркаляцию, прочно встраиваясь в спиральную структуру между основаниями. Константы устойчивости комплексов различных металлов с ДНК лежат в пределах от 104 до 106; причем комплексы меди(II) и поливалентных катионов нерастворимы.
Отмечено положительное влияние ионов Mg2+, Mn2+, Cа2+ и Co2+ на реактивацию денатурированных молекул РНК; как и в случае ДНК, ионы Cu2+ оказывают дестабилизирующее влияние. РНК более лабильный биополимер и ионы металла катализируют его деполимеризацию, при-чем в случае ионов Cd2+ и Zn2+ основной продукт – нуклеотиды, в случае Pb2+ – нуклеозиды, а для Al3+ и Bi3+ – олигомеры.
Нуклеопротеины являются комплексами нуклеиновых кислот и белков. Это основная форма существования нуклеиновых кислот в клетке, играющая ключевую роль в стабилизации ДНК и регуляции передачи генетической информации. Поэтому последние годы данная группа соединений интенсивно изучается в связи с регуляцией активности генома.Установлено, что белковая часть необходима для поддержания третичной структуры ДНК. Первый уровень сверхскрученного состояния нуклеиновой кислоты в хроматине поддерживается гистонами, удерживающими участок молекулы протяженностью около 200 нуклеотидных пар и образующими нуклеосомы. Аминокислотный состав гистонов обогащен остатками Lys и Arg, что приводит к положительному заряду макромолекулы при биологических значениях рН. Гистоны и ДНК соединяются ионными связями по типу белок(+)ДНК(–) и силами слабых взаимодействий. Сам процесс перехода в суперспиральное состояние и обратно осуществляется с помощью специальных ферментов – топоизомераз. Очевидно, что гистоны блокируют транскрипцию, и некоторые исследователи полагают, что ионы металлов в конкуренции с ними обеспечивают дерепрессию генома.