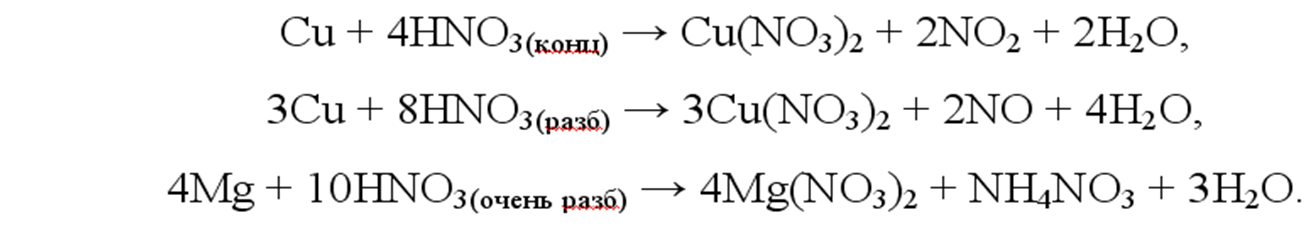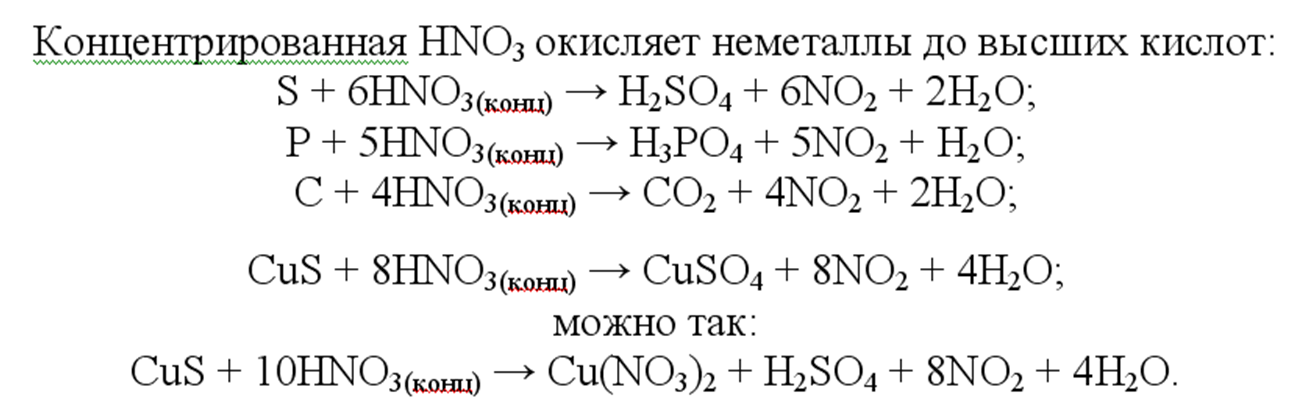Задания 30 ориентированы на проверку следующих умений:
определять степень окисления химических элементов, окислитель и восстановитель;
прогнозировать продукты окислительно-восстановительных реакций, в том числе с учетом характера среды (кислой, щелочной, нейтральной);
составлять уравнения окислительно-восстановительных реакций;
составлять электронный баланс, на его основе расставлять коэффициенты в уравнениях реакций.
Шкала оценивания заданий 30 включает следующие элементы:
• выбраны вещества, и записано уравнение окислительно-восстановительной реакции – 1 балл;
• составлен электронный баланс, указаны окислитель и восстановитель – 1 балл.
Элемент 1.
Записано уравнение реакции (1 балл):
выбраны окислитель и восстановитель;
записаны продукты ОВР с учетом представлений об относительной устойчивости степеней окисления элементов и характера среды (кислой, нейтральной или щелочной);
расставлены все коэффициенты (допустимо использование дробных и удвоенных коэффициентов).
Элемент 2.
Составлен электронный баланс, указаны окислитель и восстановитель – 1 балл
При оценивании ответа экзаменуемого необходимо учитывать, что единых требований к оформлению ответа на это задание не предъявляется.
В качестве верного ответа принимается составление как электронного, так и электронно-ионного баланса.
Указание окислителя и восстановителя может быть сделано любыми однозначно понятными способами.
Тем не менее, если в ответе содержатся взаимоисключающие по смыслу элементы ответа, то они не могут считаться верными.
Критерии оценивания задания 30

Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) – это реакции, которые протекают с изменением степеней окисления атомов.
Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предположения, что все связи в соединении ионные (то есть электронные пары полностью смещены в сторону атомов с большей электроотрицательностью), а соединение – нейтральное. Степень окисления может быть положительной, отрицательной, нулевой и даже дробной.
Окисление – процесс отдачи электронов атомом, молекулой или ионом. При окислении степень окисления увеличивается. Атом, молекула или ион, которые отдают электроны, называются восстановителем.
Нº2 – 2ē = 2 ;
;
Мgº - 2ē =  .
.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при восстановлении уменьшается, а атом, молекула или ион, которые принимают электроны, называются окислителем.
Cl º2 + 2ē = 2 ;
;
 + 2ē = Znº.
+ 2ē = Znº.
Окисление и восстановление – взаимосвязанные процессы.
Число электронов, отданных окислителем в ОВР, всегда равно числу электронов, принятых восстановителем.
Важнейшие окислители и восстановители
| Окислители | Восстановители |
| O2, Cl2, Br2 , соединения, содержащие элемент в максимальной (HNO3, Н2SO4 (конц.), KMnO4, K2Cr2O7, K2CrO4) или промежуточной степени окисления (H2O2, MnO2, KCIO, KCIO3, соединения Fe (III), NaNO2, «царская водка»), анод при электролизе. | Простые вещества – металлы, Н2, С, СО, соединения неметаллов в минимальной степени окисления (S-2, N-3, CI-1 и др.), а также Н2S, HI, HBr, HCI, NH3, PH3, соединения, содержащие элемент в промежуточной степени окисления (SO2, H2SO3, HNO2, H3PO3, соединения Fe(II), Cr(II), Cr(III), Cu(I), (H2O2), альдегиды, спирты, муравьиная кислота, катод при электролизе. |
Примеры реакций с участием HNO3:
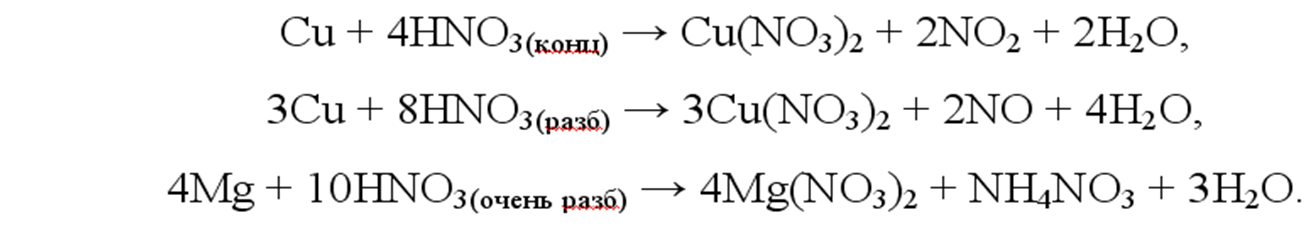
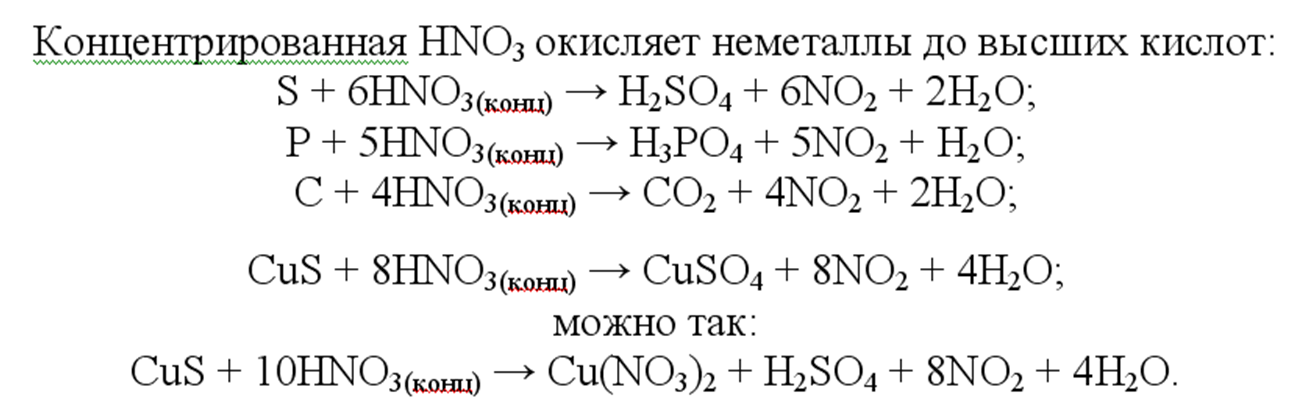
Примеры реакций с участием H2SO4 (конц.):

Примеры реакций с участием KMnO4 и MnO2:
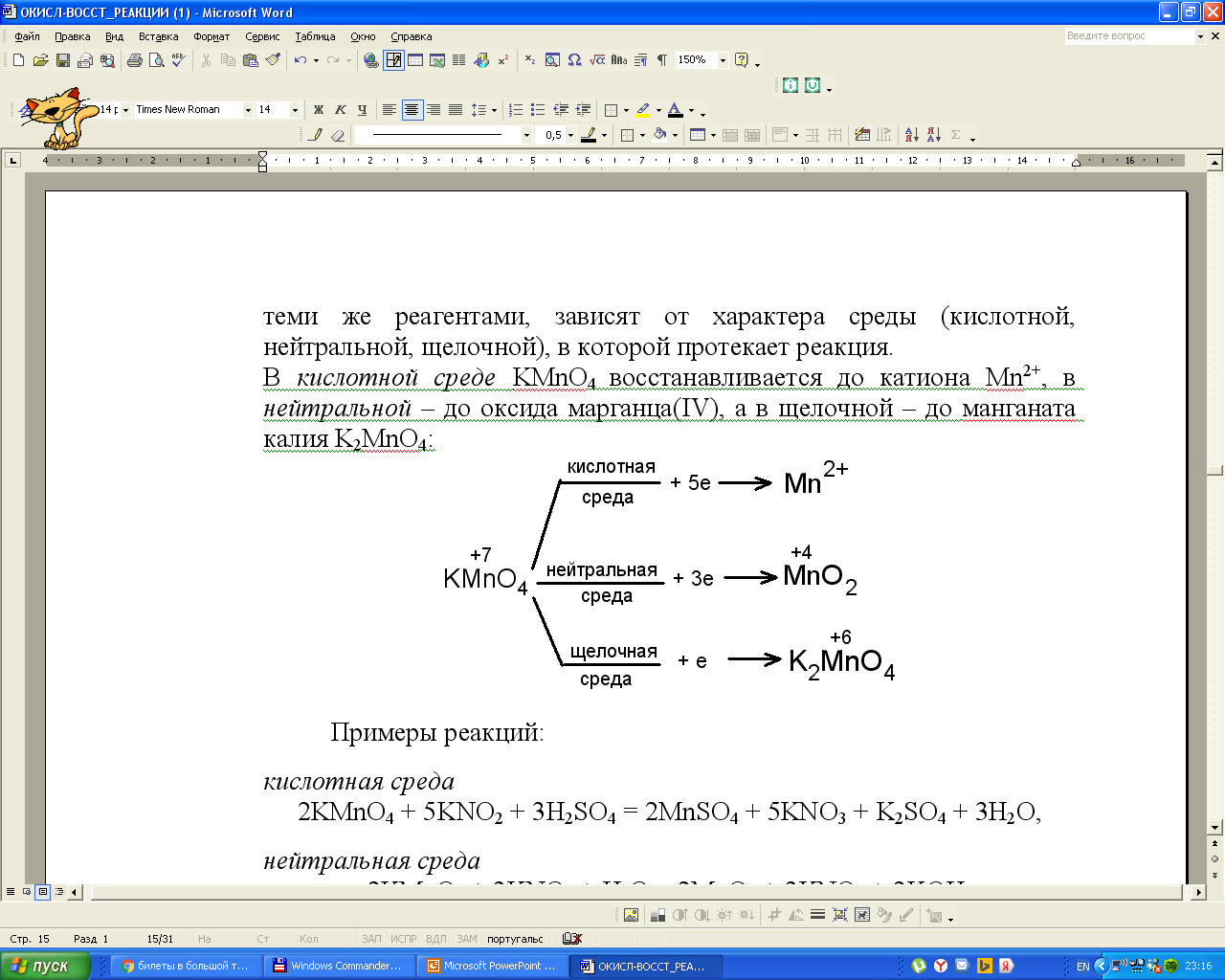
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
2KMnO4 + KNO2 + 2KOH = 2K2MnO4 + KNO3 + H2O
2KMnO4 + 16 HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
MnO2 обычно используют в кислой среде:
MnO2 + 2NaBr + 2H2SO4 = MnSO4 + Br2 + Na2SO4 + 2H2O
Хроматы и дихроматы чаще используют в кислой среде, восстановление протекает до соединений Cr(III):
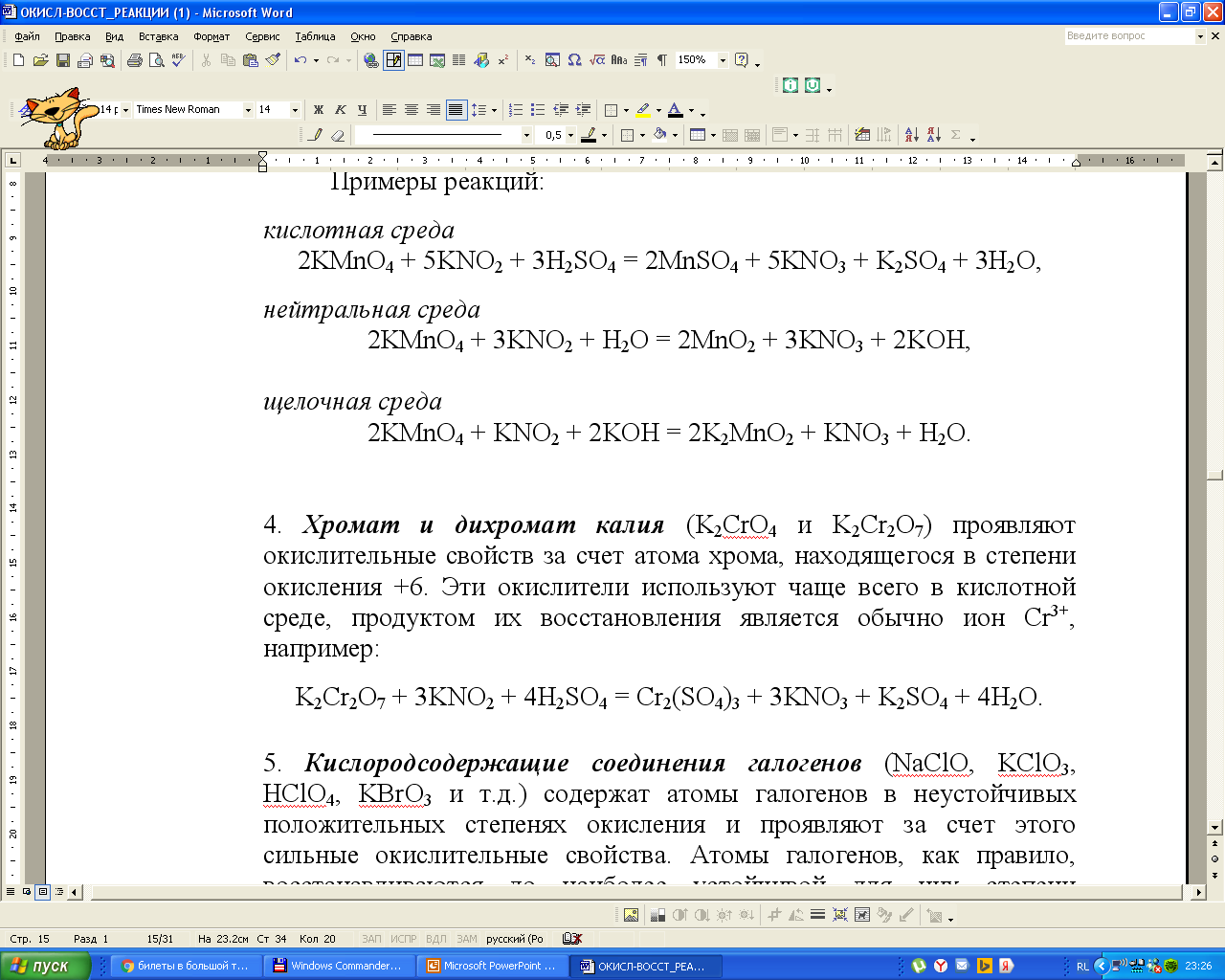
Важно, чтобы продукты реакции были выбраны с учетом характера среды:
2K2СrO4 + 3Zn + 8KOH + 8H2O = 2K3[Cr(OH)6] + 3K2[Zn(OH)4]
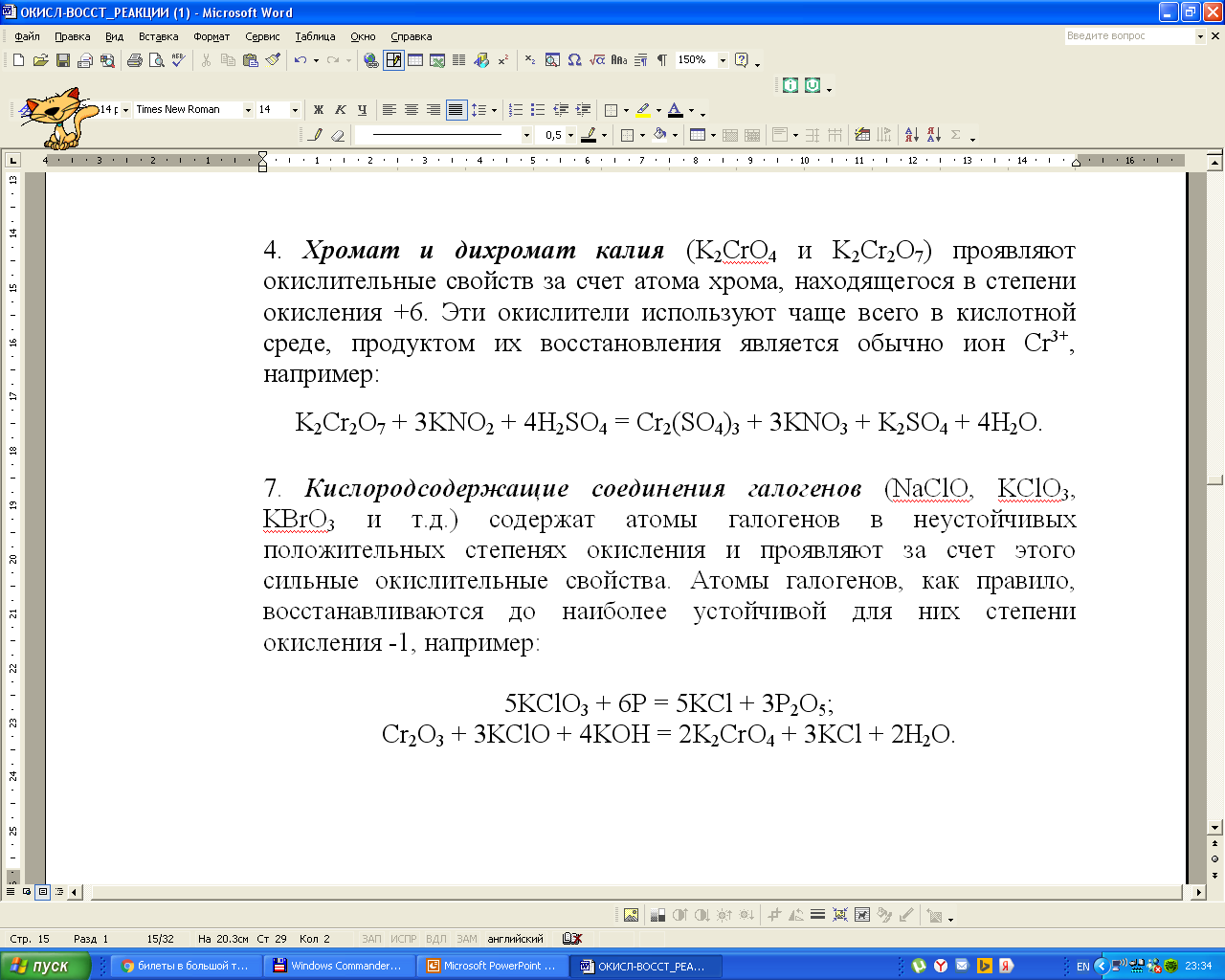
При использовании кислородсодержащих соединений хлора в качестве окислителей атомы галогенов восстанавливаются до устойчивой степени окисления -1:
О важнейших восстановителях и продуктах их окисления:
Cложные вещества, содержащие атом в низшей степени окисления: HI, KI, H2S, Na2S, NH3, PH3 и т.п.
Как правило образуются следующие продукты их окисления:
2I-1 -2e → I2
2Br-1 -2e → Br2
2Cl-1 -2e → Cl2
S-2 -2e → S0 (при использовании сильных окислителей (KMnO4, K2CrO7, HNO3 допустима запись H2SO4, сульфатов)
NH3 → N2
PH3 → PO43- (H3PO4, K3PO4)
О важнейших восстановителях и продуктах их окисления:
Сложные вещества, содержащие катионы металлов, заряд которых может возрасти, например, Fe2+, соединения меди(I), соединения хрома(III):
2Cr(OH)3 + 3H2O2 + 4КОН = 2K2CrО4 + 8H2O;
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Сульфиты, нитриты:
KNO2 + Br2 +2KOH = KNO3 + 2KBr + H2O;
Na2SO3 + Cl2 +H2O = Na2SO4 + 2HCl.








 ;
; .
. ;
; + 2ē = Znº.
+ 2ē = Znº.