
Тема урока: « Окислительно-восстановительные реакции»
9 КЛАСС
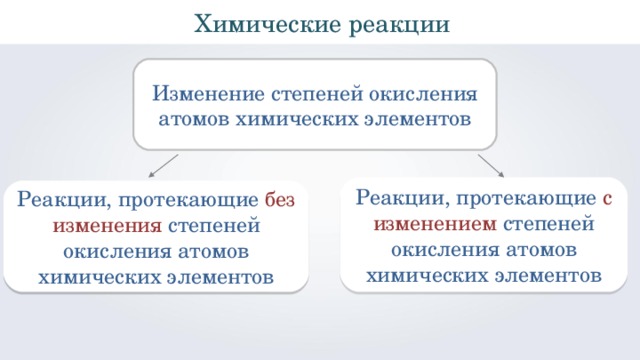
Химические реакции
Изменение степеней окисления атомов химических элементов
Реакции, протекающие с изменением степеней окисления атомов химических элементов
Реакции, протекающие без изменения степеней окисления атомов химических элементов

Реакции без изменения степени окисления
Реакции обмена
+6
– 2
+2
– 1
+1
+2
+6
– 2
+1
– 1
CaF 2 + H 2 SO 4 = Ca SO 4 + 2 HF ↑
Степени окисления до реакции и после остались неизменными .

Реакции без изменения степени окисления
Реакции обмена
– 2
+1
+5
– 2
– 2
+1
+1
– 2
+1
+1
+5
KOH + H NO 3 = KNO 3 + H 2 O
Степени окисления до реакции и после остались неизменными .

Окислительно - восстановительные
реакции
Окислительно-восстановительными реакции - химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества.

Окислительно-восстановительные реакции
+1
– 1
0
+2
– 1
0
2 HCl + Mg = MgCl 2 + H 2 ↑
0
+2
Mg – 2 е - → Mg
+1
0
2 H + 2 е - → H 2
процесс восстановления

+5
+2
N + 3 e - → N
Fe + 1 e - → Fe
+3
+2
0
– 1
F + 1 e - → F
Восстановление — процесс присоединения электронов атомами, ионами или молекулами.

0
+2
Mg – 2 е - → Mg
Окисление — процесс отдачи электронов атомами, ионами или молекулами.
Степень окисления при этом всегда повышается.
Окислители — атомы, ионы или молекулы, принимающие электроны.

Окислительно - восстановительные
реакции
Число электронов до реакции и после неё останется неизменным.
+1
– 1
0
+2
– 1
0
2 HCl + Mg = MgCl 2 + H 2 ↑
Если атомы одного элемента в ходе реакции отдадут электроны, повысив степень окисления, то атомы другого элемента примут их, понизив свою степень окисления.

Окислительно - восстановительные
реакции
окисление
– 2 e -
+1
0
+2
– 1
– 1
0
2
HCl + Mg = MgCl 2 + H 2
окислитель
восстановитель
+ e -
восстановление
электронный баланс реакции

Окислительно - восстановительные
реакции
окисление
– 3 e -
0
+2
0
– 2
– 2
ZnSO 4 + Al → Al 2 (SO 4 ) 3 + Zn
+3
+2
0
+ 2 e -
3
Zn + 2 e - Zn
восстановление
восстановление
0
+3
2
окисление
Al – 3 e - Al
2 Al + 3 ZnSO 4 = Al 2 ( SO 4 ) 3 + 3 Zn
Окислительно - восстановительные
реакции
+4
+1
– 2
– 2
– 2
+5
+1
– 2
+6
+1
0
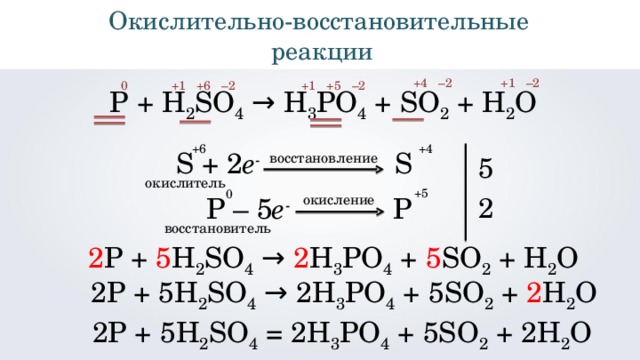
Р + H 2 SO 4 → H 3 PO 4 + SO 2 + H 2 O
+4
+6
5
S + 2 e - S
восстановление
окислитель
+5
0
2
окисление
P – 5 e - P
восстановитель
2 Р + 5 H 2 SO 4 → 2 H 3 PO 4 + 5 SO 2 + H 2 O
2Р + 5 H 2 SO 4 → 2 H 3 PO 4 + 5 SO 2 + 2 H 2 O
2 Р + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O
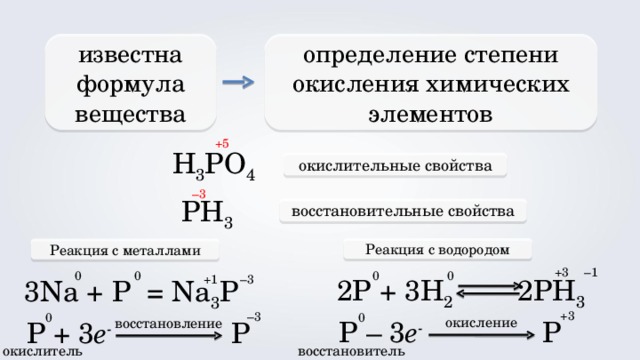
определение степени окисления химических элементов
известна формула вещества
+5
H 3 PO 4
окислительные свойства
– 3
PH 3
восстановительные свойства
Реакция с водородом
Реакция с металлами
+ 3
– 1
0
0
0
0
+1
– 3
2P + 3H 2 2 PH 3
3 Na + P = Na 3 P
+3
– 3
0
0
окисление
восстановление
P – 3 e - P
P + 3 e - P
окислитель
восстановитель

Основные окислители: кислород, галогены, азотная и серная кислоты, перманганат калия ( KMnO 4 ) и т.д.
Основные восстановители: активные металлы, водород, уголь, оксид углерода ( II ) ( CO ) , сероводород ( H 2 S ), аммиак ( NH 3 ).






































