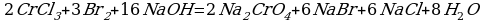Открытый урок элективного курса
«Решение задач повышенной сложности по химии. Подготовка к ЕГЭ. 11 класс»
Тема урока: «Окислительно-восстановительные реакции. Электронно-ионный метод составления уравнений ОВР. Системный подход к решению задания ЕГЭ №30»
Тип урока: Изучение новой темы на основе комплексного применения ранее полученных знаний.
Основные цели и задачи:
А) Образовательные:
* сформировать у обучающихся понятия о важнейших окислителях и восстановителях;
* научить общим принципам составления уравнений ОВР, протекающих в растворах (электронно-ионный метод);
* научить прогнозировать окислительные или восстановительные свойства веществ, а также продукты их восстановления или окисления в зависимости от условий;
* научить системному подходу к решению задания №30 в формате ЕГЭ.
Б) Развивающие:
* развивать мышление учащихся, научить их делать логические выводы из наблюдений;
* развивать умение выделять общие и существенные признаки; отличать несущественные признаки; умение применять знания на практике;
* закрепить умения и навыки химического эксперимента, умение работать со справочным материалом (таблицы, опорные схемы, справочники и т.д.);
* развивать познавательные умения: выделять главное, вести конспект, делать выводы.
В) Воспитательные:
* формировать интерес учащихся к изучению химии, умение использовать приобретённые знания в практических целях (например, применение ОВР для получения металлов и других веществ; роль окислительно-восстановительных процессов в коррозии металлов и защита от неё и т.д.);
* воспитание мотивации к обучению, ответственного и серьёзного отношения к занятиям;
* воспитание дисциплинированности, умения работать в коллективе, уважения к учителю и одноклассникам.
Интегративная учебная проблема: «Почему одни вещества в реакции проявляют свойства восстановителя, а другие – окислителя? Как безошибочно определить роль того или иного вещества в ОВР, а также продукты их превращений?»
Тип урока: урок усвоения нового материала.
Технологии: проблемное, исследовательское, групповое и дифференцированное обучение; ИКТ.
Форма организации учебной деятельности учащихся: частично-поисковая деятельность, создание проблемных ситуаций; индивидуальная работа и в группах.
Учебно-методическое и материально-техническое обеспечение:
- учебник О.С. Габриеляна «Химия. 11 класс»;
- Комплекс материалов для подготовки учащихся к ЕГЭ по химии (под ред. Кавериной А.А.)
- таблица растворимости веществ в воде;
- электрохимический ряд напряжения металлов; опорные схемы по теории ОВР;
- мультимедийные средства (ПК, проектор и экран для демонстрации слайдов);
- доска ученическая, мел.
Оборудование: карточки задания для самостоятельной работы.
Ход урока
Учитель:
Мы продолжаем изучать окислительно-восттановительные процессы. Давайте вспомним основные положения теории ОВР:
-
Какие реакции относятся к ОВР?
-
Дайте определение понятия «степень окисления».
-
Как определяется степень окисления атома элемента в молекуле вещества?
-
Что такое окисление? Восстановление? Могут ли эти процессы существовать независимо друг от друга?
-
Что такое окислитель и восстановитель?
-
Как изменяется степень окисления в процессах окисления и восстановления?
-
Можно ли подбирать коэффициенты при составлении уравнений ОВР «на глазок»? Какие вам известны приемы при подборе коэффициентов?
Какое важнейшее правило лежит в основе составления электронного баланса?
Ответы учеников:
-
ОВР – это реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ.
-
Степень окисления (С.О.) – это условный заряд атома элемента в молекуле, вычисленный из предположения, что молекула состоит только из ионов. Положительная С.О. определяется числом электронов, оттянутых от данного атома, а отрицательная – числом электронов, смещённых от других атомов.
-
Чтобы рассчитать С.О. элемента в соединении, необходимо знать постоянные степени окисления некоторых химических элементов, а также то, что алгебраическая сумма степеней окисления всех атомов в молекуле вещества равна нулю. С.О. простых веществ равна нулю!
-
Окислением называется отдача электронов атомом, молекулой или ионом. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Эти два взаимопротивоположных процесса неразрывно связаны между собой: не существует окисления без восстановления и наоборот.
-
Вещество, атомы, молекулы или ионы которого в процессе реакции отдают электроны, называется восстановителем. Вещество, атомы, молекулы или ионы которого в процессе реакции принимают электроны, называется окислителем.
-
В процессе окисления С.О. восстановителя повышается. При восстановлении С.О. окислителя понижается.
-
Изменение С.О. элементов в ОВР обусловлено распространением электронов между окислителем и восстановителем. При этом число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Метод электронного баланса основан на сравнении С.О. атомов в исходных и конечных веществах, для чего составляют электронные уравнения и на их основе вычисляют коэффициенты.
Учитель:
Для ОВР, протекающих в растворах, существенную роль играет среда раствора, так как часто продукты восстановления большинства окислителей зависят от реакции среды, в которой протекает данная ОВР. Метод электронного баланса для таких ОВР имеет ряд недостатков: не учитывает реально существующие ионы в растворе; не позволяет прогнозировать продукты ОВР.
Влияние среды раствора, в котором протекает восстановление перманганат-иона, можно отразить следующей схемой:
Mn2+←(H+)← MnO4-→(OH-)→MnO42-
↓
(H2O)
↓
MnO2
Рассмотрим реакцию восстановления перманганата калия нитритом натрия в сернокислой среде. Нитрит натрия в результате окисления превращается в нитрат натрия. Катионы Mn2+, образующиеся в результате восстановления перманганата калия, связываются сульфат-ионами в сульфат марганца (II).
KMnO4 + NaNO2 + H2SO4 → MnSO4 + NaNO3 + K2SO4 + H2O.
Электронный баланс: Mn+7 (+5е-) → Mn+2│5 │2
N+3 (- 2e-) → N+5 │2 │5
2KMnO4 + 5 NaNO2 +3 H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O.
Как видно, при составлении электронных уравнений мы вычленяем отдельные атомы, которые на самом деле в растворе отсутствуют.
В электронно-ионном методе (метод полуреакций) коэффициенты находят с помощью электронно-ионных уравнений. Последние отличаются от электронных уравнений (метод электронного баланса) тем, что в них учитывают ионы, образующиеся в результате диссоциации реагирующих веществ и реально существующие в водном растворе (учитель предлагает написать данное уравнение в полной ионной форме, после чего выписать из него частицы, несущие в себе окислитель и восстановитель и продукты их превращений).
При составлении электронно-ионных уравнений следует учитывать изменение не только зарядов ионов, но, весьма часто, и их состава, например, при восстановлении перманганат-иона по схеме: MnO4- → Mn2+, и во многих других случаях. Такие взаимные переходы сопряжены в общем случае с участием в них молекул воды или содержащихся в расвторе ионов Н+ и ОН-. Если реакция идет в кислой среде, то при составлении полуреакций используют ионы Н- или молекулы Н2О; в щелочной среде – ионы ОН- или молекулы Н2О; в нейтральной среде – ионы Н+, ОН- и молекулы Н2О.
При составлении электронно-ионных уравнений необходимо обратить внимание на число атомов кислорода в исходных и образующихся частицах – молекулах, ионах. В связи с этим целесообразно опираться на следующие правила:
Правило 1
Если исходная частица (А) содержит кислорода больше, чем образующаяся (Б), то освобождающийся кислород связывается в кислых растворах ионами Н+ в воду (1), а нейтральных и щелочных растворах – в гидроксид-ионы (2):
-
О2- + 2Н+ → Н2О или А + Н+ → Б + Н2О
-
О2- + Н2О → 2ОН- или А + Н2О → Б + ОН-
Правило 2
Если исходная частица (А) содержит кислорода меньше, чем образующаяся (Б), то недостаток атомов кислорода восполняется в кислых и нейтральных растворах за счет молекул воды (1), а в щелочных – за счет гидроксид-ионов (2):
-
Н2О → О2- + 2Н+ или А + Н2О → Б + 2Н+
-
2ОН- → О2- + Н2О или Б + ОН- → Б + Н2О
В соответствии с вышеописанными правилами составим электронно-ионные уравнения (полуреакции).
Рассмотрим последовательность, которой рекомендуется придерживаться при составлении окислительно – восстановительных реакций.
Пример 1. При окислении K2SO3 перманганатом калия в кислой среде последний восстанавливается в ионы 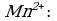
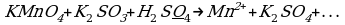
Решение. Составляем электронно-ионные уравнения по этапам.
1 этап.
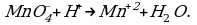
Так как в ионе 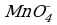 содержится кислорода больше, чем в образующемся ионе Mn2+, то избыток кислорода в кислой среде связывается ионами Н+, образуя воду (для связывания четырех ионов
содержится кислорода больше, чем в образующемся ионе Mn2+, то избыток кислорода в кислой среде связывается ионами Н+, образуя воду (для связывания четырех ионов 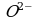 требуется восемь ионов Н+):
требуется восемь ионов Н+):
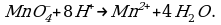
Чтобы стрелку заменить знаком равенства, надо, чтобы равенство было не только по числу атомов элементов, но и по зарядам.
Подсчитаем суммарные заряды в левой и правой частях полуреакции:
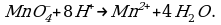
+7 +2
Для сохранения равенства зарядов левую часть схемы следует дополнить пятью электронами:

2 этап. Составляем полуреакцию процесса окисления:
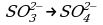
Так как в исходном ионе содержится меньше кислорода, чем в образующемся, то недостаток атомов кислорода восполним за счет молекулы воды:
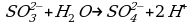
Число атомов каждого элемента одинаково в левой и правой частях схемы; для восполнения условия равенства зарядов из левой части вычитаем два электрона:

3 этап. Запишем две полуреакции вместе и по правилам нахождения наименьшего кратного определим множители, на которые надо умножить обе полуреакции:
 | 2
| 2
 | 5
| 5
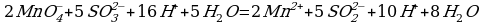
Производим сокращение:

Из этого уравнения видно, что окисление ионов 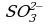 в ионы
в ионы 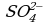 перманганат-ионами
перманганат-ионами 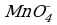 сопровождается связыванием ионов Н+, которые идут на образование воды. Следовательно, кислая среда является необходимым условием этой реакции.
сопровождается связыванием ионов Н+, которые идут на образование воды. Следовательно, кислая среда является необходимым условием этой реакции.
4 этап. Составляем молекулярное уравнение. Для этого к левой части ионного уравнения приписываем каждому иону противоион, такое же число ионов приписываем к правой части уравнения:
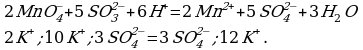
При написании продуктов реакции необходимо учитывать, что каждый ион из верхней строчки соединится с противоположным ионом из нижней (2 иона 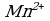 с 2 ионами
с 2 ионами 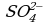 ) и оставшиеся в нижней строчки ионы (2 иона К+ и 1 ион
) и оставшиеся в нижней строчки ионы (2 иона К+ и 1 ион 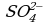 ) соединяются между собой.
) соединяются между собой.
Записываем молекулярное уравнение:
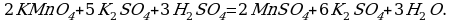
Как мы с вами убедились, данную реакцию можно уравнять как с помощью метода электронного баланса, так и с позиции метода полуреакций. Однако, существуют такие ОВР, уравнения которых невозможно составить, опираясь на метод электронного баланса:
FeSO4 + KMnO4 + H2O → ?
Метод полуреакций позволит нам правильно спрогнозировать продукты данной ОВР. Окислителем являются перманганат-ионы MnO4-, которые в нейтральной среде восстанавливается до MnO2↓, а восстановителем – ионы Fe2+, которые могут быть окислены в ионы Fe3+. Cоставим электронно-ионные уравнения и просуммируем их с учетом коэффициентов:
Fe2+ (-e-)→ Fe3+ │1│3
MnO4- + 2H2O (+3e-)→ MnO2↓ + 4OH- │3 │1
3Fe2+ + MnO4- + 2H2O → 3Fe3+ + MnO2↓ + 4OH- (суммарное уравнение в сокращенной ионной форме)
Как видно, в продуктах ОВР имеем одновременно ионы Fe3+ и OH-, которые будут взаимодействовать между собой с образованием гидроксокатиона FeOH+:
3Fe3+ + 4OH- → 3FeOH+ + OH-.
Cледовательно, правая часть суммарного уравнения преображается следующим образом:
... → 3FeOH+ + OH- + MnO2↓
Преобразуем сокращенную ионную форму ОВР в молекулярную и получим:
3FeSO4 + KMnO4 + 2H2O = 3FeOHSO4 + MnO2 + KOH
Задания для самостоятельного выполнения (раздается группам учеников на карточках):
Карточка 1.
Cоставьте уравнение реакции восстановления дихромата калия концентрированной соляной кислотой.
Решение:
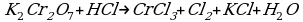
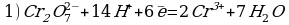 | 2 | 1
| 2 | 1
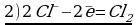 | 6 | 3
| 6 | 3
Сr2O72- + 14H+ + 6Cl- = 2Cr3+ + 3Cl2 + 7H2O
K2Сr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Комментарий:
Восстановитель (HCl) в ходе реакции дополнительно выполняет функцию солеобразователя. Одна молекула K2Cr2O7 окисляет шесть модекул HCl, образуя три молекулы хлора (3Cl2), а восемь молекул HCl расходуются на образование солей (2KCl+2CrCl3).
Карточка 2.
Cоставьте уравнение реакции окисления хлорида хрома (III) бромной водой в щелочной среде.
Решение:
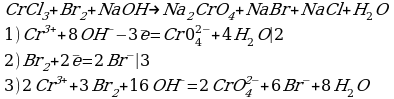
Комментарий:
Из этого ионного уравнения видна роль щелочи: окисление ионов Cr3+ в  бромом сопровождается потреблением ионов
бромом сопровождается потреблением ионов  .Поэтому реакцию надо проводить в щелочной среде.
.Поэтому реакцию надо проводить в щелочной среде.
4)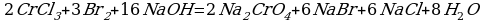
Учитель:
По опыту сдачи ЕГЭ в 2018 году мы знаем насколько усложнилось задание №30 второй части. Если раньше требовалось доставить пропущенные вещества в левой и правой частях уравнения и подобрать коэффициенты методом электронного баланса, то теперь перед выпускником стоит сложнейшая задача - самому выбрать окислитель, восстановитель и реакцию среды, в которой протекает ОВР, а также спрогнозировать продукты ОВР. Это на порядок усложняет данное задание.
Предлагаю разработать системный подход к решению данного задания. Для этого мы должны четко представлять себе, какие свойства (окислительные или восстановительные ?) способно проявлять то или иное вещество. В качестве вспомогательного материала будем использовать составленную ранее таблицу, в которой отражены не только важнейшие окислители и восстановители, но также наиболее типичные превращения веществ.
Важнейшие восстановители и окислители
| Воссстановители | Окислители |
| Все металлы (Ме0): Ме0 – ne- → Me+n Уголь (углерод, кокс): С0 – 2е- → С+2 С0 – 4е- → С+4 Оксид углерода (II): С+2О – 2е- → С+4О2 Сульфид-ион (сероводород, сульфиды): S-2 – 2e- → S0 (часто) S-2 – 6e- → S+4 (реже) S-2 – 8e- → S+6 (реже) Сернистая кислота и ее соли (сульфиты): (SO3)-2 – 2e- → (SO4)-2 Галогенид-ионы Наl- (Cl-, Br-, I-): 2Hal- - 2e- → Hal02 Хлорид олова (II): SnCl2 -2e- → SnCl4 Сульфат железа (II); 2FeSO4 -2e- → Fe2(SO4)3
Cульфат марганца (II); (MnO4)-2 ß (+OH)Mn+2(+H+) à (MnO4)- ↓ (+H2O) MnO2
Сульфат хрома (II) CrSO4: 2CrSO4 – 2e- → Cr2(SO4)3
Сульфат хрома (III) Cr2(SO4)3: (CrO4)-2 ß (+OH-) Cr+3 (+H+) à (Cr2O7)-2
Азотистая кислота и ее соли (нитриты): (NO2)- - 2e- → (NO3)-
Аммиак NH3: NO ß NH3 à N2 ↓ NO2 Фосфористая кислота Н3РО3 и ее соли (фосфиты): (РО3)-3 – 2е- → (РО4)-3 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 - 2e- → O20↑
Катод при электролизе
| Галогены Hal20 (F2, Cl2, Br2): Hal20 + 2e- → 2Hal-
Перманганат-ион (MnO4)-: (MnO4)-2 ß (+OH-)(MnO4)-(+H+) à Mn+2 (+Н2О)↓ MnO2
Ди(би)хромат-ион (Сr2O7)-2: (CrO4)-2ß (+OH-)(Сr2 O7)-2(+H+) à Cr+3 (+H2O)↓ Cr(OH)3 Азотная кислота HNO3: HNO3 (конц.) + малоакт.Ме → NO2 HNO3 (разб.) + малоакт.Ме → NO HNO3 (разб.) + активный Ме → N2, N2O HNO3 (оч.разб.) + активный Ме → NH4NO3
Кислород О2: О2 +4е- → 2О-2 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 + 2e- → 2O-2 В кислой среде: Н2О2 + 2Н+ + 2е- → 2Н2О В щелочной среде: Н2О2 + 2е- → 2ОН-
Концентрированная серная кислота: H2SO4 (конц.) + малоакт.Ме → SO2 H2SO4 (конц.) + среднеакт.Ме → S0 H2SO4 (конц.) + активныйМе → H2S Оксид меди (II): СuO + e → Cu+ СuO + 2e → Cu0 Оксид серебра: Ag2O +2e- → 2Ag0 Хлорид железа (III): FeCl3 + e- → FeCl2 Оксид свинца (IV): PbO2 + 2e- → Pb+2 ( в кислой среде, напр., PbCl2) Анионы (ClO)-, (ClO2)-, (ClO3)-, (ClO4)- при восстановлении переходят в Cl- или Cl20
Анод при электролизе
|
Таким образом, решение задания №30 можно представить в виде следующего пошагового алгоритма:
1 ШАГ
На основании данной таблицы и понимания зависимости окислительно-восстановительных свойств сложных веществ от степени окисления элементов, входящих в состав молекул, делаем вывод об ОВ-свойствах данных в задании веществ. При этом присваиваем выбранным веществам «ярлычок»: «окислитель», «восстановитель», «ОВ-двойственность».
2 ШАГ
Помним, что в перечень веществ могут входить «лишние» вещества, которые не участвуют в предполагаемых ОВР (но участвуют в РИО, см. Задание №31), а также вещества, которые могут быть использованы в качестве среды раствора. Им мы тоже присваиваем «ярлычки»: «среда», «РИО», «лишнее».
3 ШАГ
После того как «развесили ярлычки» начинаем составлять левую часть уравнения ОВР: выбираем из перечня веществ восстановитель, окислитель и среду раствора.
4 ШАГ
Зватем, прогнозируя продукты ОВР, составляем правую часть уравнения. Для сложных реакций на стадии прогнозирования можно воспользоваться методом полуреакций.
5 ШАГ
Составляем электронные уравнения окисления и восстановления (электронный баланс) и определяем коэффициенты.
Пример решения задания №30 ЕГЭ
Задание:
Перечень веществ: водород, гидроксид магния, серная кислота (конц.), магний, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Решение:
ШАГ 1.
Запишем химические формулы веществ из предложенного перечня:
H2, Mg(OH)2, H2SO4 (конц.), Mg, KMnO4.
Определим окислительно-восстановительные свойства веществ – присвоим веществам «ярлычки»:
H2 – восстановитель, но по отношению к магнию – окислитель (t0);
Mg(OH)2 – не будет проявлять ОВ-свойств, т.к. в состав вещества входят химические элементы с постоянной С.О. («РИО»);
H2SO4 (конц.) – окислитель (за счет S+6);
Mg – восстановитель;
KMnO4 – окислитель в растворе (за счет Mn+7).
ШАГ 2.
Выберем вещества, между которыми возможна ОВР: Mg и H2SO4 (конц.)
ШАГ 3.
Составим левую часть уравнения:
Mg + H2SO4(конц.)→ ...
ШАГ 4.
Прогнозируем продукты:
Mg окисляется в ион Mg2+, который в условиях данной реакции входит в состав соли – сульфата магния MgSO4;
H2SO4 (конц.) восстанавливается металлом, расположенным в ряду напряжений до алюминия, до сероводорода H2S.
Концентрированная серная кислота в данной ОВР играет двоякую роль – окислителя и среды (солеобразователя), при этом в продуктах образуется также вода.
Таким образом, схема данной ОВР имеет вид:
Mg + H2SO4 (конц.) → MgSO4 + H2S + Н2О
ШАГ 5.
Составляем уравнения электронного баланса и определяем коэффициенты:
Mg0 – 2e- → Mg+2 │2 │8│4
S+6 + 8e- → S-2 │8 │2 │1
Окончательное уравнение ОВР:
4Mg + 5H2SO4 (конц.) → 4MgSO4 + H2S + 4Н2О
Задания для самостоятельного выполнения с последующим обменом между группами:
Вариант 1.
Перечень веществ: йодоводород, фтор,хлорат калия, йод, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Вариант 2.
Перечень веществ: оксид хрома (III), сероводород, гидроксид калия, серная кислота, хлор. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.






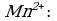
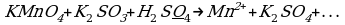
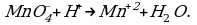
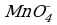 содержится кислорода больше, чем в образующемся ионе Mn2+, то избыток кислорода в кислой среде связывается ионами Н+, образуя воду (для связывания четырех ионов
содержится кислорода больше, чем в образующемся ионе Mn2+, то избыток кислорода в кислой среде связывается ионами Н+, образуя воду (для связывания четырех ионов 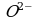 требуется восемь ионов Н+):
требуется восемь ионов Н+):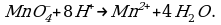

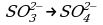
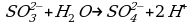

 | 5
| 5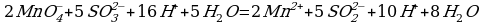

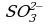 в ионы
в ионы 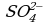 перманганат-ионами
перманганат-ионами 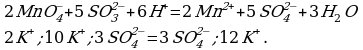
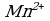 с 2 ионами
с 2 ионами 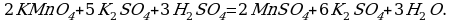
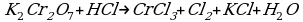
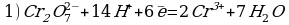 | 2 | 1
| 2 | 1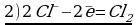 | 6 | 3
| 6 | 3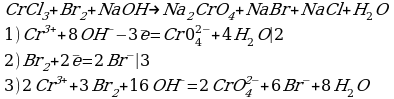
 бромом сопровождается потреблением ионов
бромом сопровождается потреблением ионов  .Поэтому реакцию надо проводить в щелочной среде.
.Поэтому реакцию надо проводить в щелочной среде.