Решение задач и система оценивания
11-1
Продукт горения газа Б – газ Г при пропускании над раскаленным углем увеличивает свой объем вдвое, вновь превращаясь в газ Б; можно предположить, что Г - это углекислый газ, а Б - монооксид углерода:
2СО + O2 = 2СO2,
СO2 + С = 2СО.
Предположение о том, что газ Б - монооксид углерода, подтверждается тем фактом, что металл А соединяется с Б по донорно-акцепторному механизму, а в молекуле СО у атома углерода есть неподеленная электронная пара. Поэтому монооксид углерода может выступать в роли донора электронов.
По условию задачи, структура молекулы В соответствует правильному тетраэдру с атомом А в центре. Из этого можно сделать вывод что каждый атом А присоединяет четыре молекулы СО:
А + 4СО = А(СО)4.
Теперь можно определить металл А:
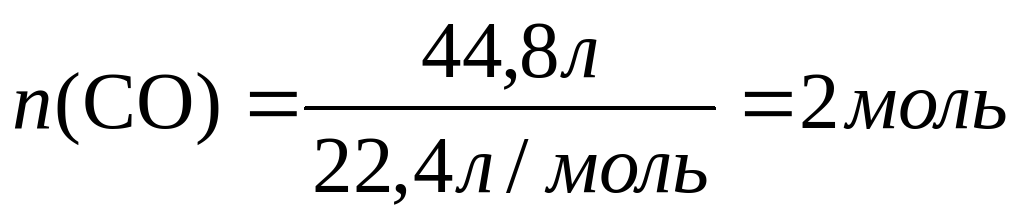
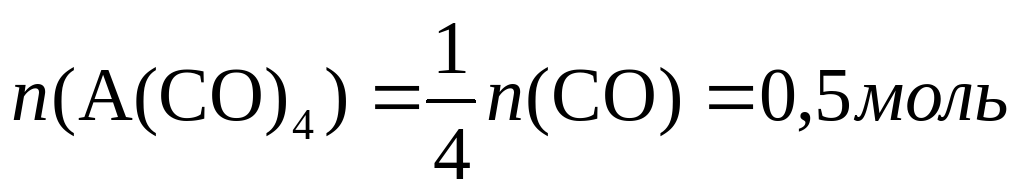
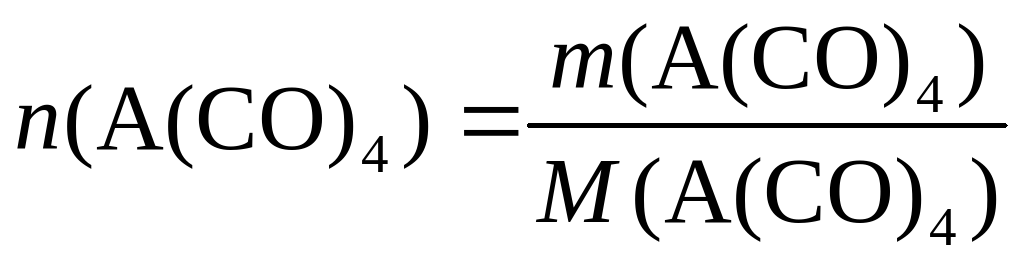
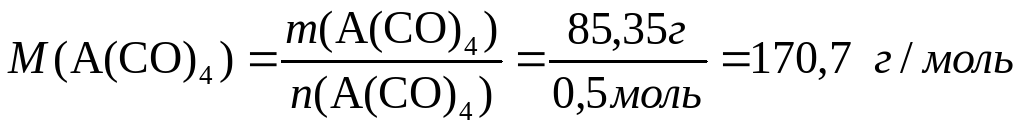
Теперь нетрудно вычислить молярную массу металла А:
170,7-28∙4 = 58,7.
Металл А — Ni, Б- СО, Г – CO2, соединение В - тетракарбонилникель Ni(CO)4.
Уравнения реакций, происходящих при получении никеля из руды:
3) 2NiS + 3O2 = 2NiO+2SO2
4) NiO + CO = Ni + CO2
5) Ni + 4СО = Ni(СО)4.
Система оценивания
За определение вещества А - 2 балла
За определение веществ Б и Г по 1 баллу - 2 балла
За определение вещества В - 4 балла
За уравнения 1,2 по 0,5 балла - 1 балл
За уравнения 3-5 по1 баллу - 3 балла
За расчет молярной массы комплекса - 3 балла
Итого: 15 баллов
11-2
2K3[Fe(CN)6] + C6H12O6 +3K2CO3 + H2O = 2K4[Fe(CN)6] + C6H11O7K + 3KHCO3
2K3[Fe(CN)6] + 2KI = 2K4[Fe(CN)6] + I2
2 Na2S2O3 + I2 = Na2S4O6 +2Na I
Из стехиометрии уравнений 1-3 следует, что
n(I2) = 0,5n (Na2S2O3 ) =0,5 C V = 0,5 ·5·10-3 ·1,28·10-3 = 3,2·10-6 моль.
По уравнению 2:
n1 (K3[Fe(CN)6]) = 2 n(I2) = 6,4·10-6 моль.
Исходное количество вещества комплекса :
n0 (K3[Fe(CN)6]) = C V = 5,00·10-3 · 2,00·10-3 = 1,00·10-5моль.
По уравнению 1: n(C6H12O6) = 0,5(n0 – n1) = 0,5· (1,00·10-5 - 6,4·10-6) = 1,8·10-6 моль.
С(C6H12O6) = n /V = 1,8·10-6 : 0,1·10-3 = 1,8·10-2 моль/л или 18 ммоль/л.
Донору грозит диабет.
Система оценивания
За уравнение 1 - 3 балла
За уравнения 2,3 по 2 балла - 4 балла
За расчет исходного количества комплекса - 4 балла
За расчет концентрации глюкозы - 1 балл
Итого : 12 баллов
11-3 (автор Лебедева О.К.)
Винный спирт – этанол.
Из опытов ясно, что нафталидам имеет формулу CxHyNz , его солянокислая соль имеет состав CxHyNzCl.
Исходя из данных таблицы, содержание азота в соли составляет
100 - 66,59 – 5,61 – 19,03 = 8,77%, отсюда
n(C ): n(H) : n(N) : n(Cl) = 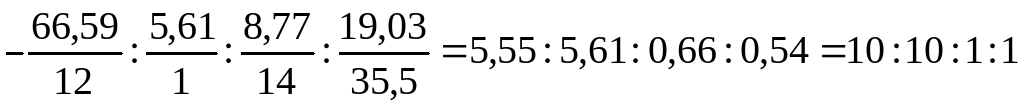
Аналогичный расчет для образца нафталидама дает результат по усредненным данным 1 и 2 опытов:
n(C ): n(H) : n(N) =
На основании результатов всех опытов, с учетом погрешности эксперимента, формула нафталидама С10Н9N.
1) 4С10Н9N + 49O2 = 40CO2 + 18H2O + 2N2 ( опыты 1,2)
2) 4С10Н10NCl + 49O2 + 2СuO = 40CO2 + 2CuCl2 + 20H2O + 2N2
В опытах 1 и 2 оксид меди и хромат свинца нужны для полного окисления нафталидама в углекислый газ.
Система оценивания:
За определение винного спирта -1 балл
За установление формул нафталидама и его соли по 2 балла - 4 балла
За уравнение реакции1 - 2 балла
За уравнение реакции 2 - 3 балла
Итого : 10 баллов
11-4 (автор Теренин В.И.)
Возможные пути синтеза
1) 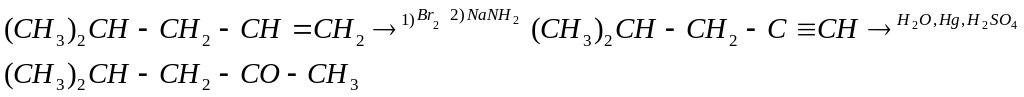
2) 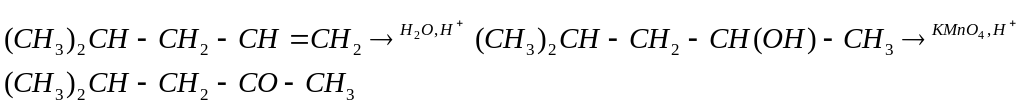
Система оценивания:
За любой из вариантов - 6 баллов.
11-5
При действии соляной кислоты происходит гидролиз полиамидной цепи капрона (поли-ε-капронамида):
… −CО−(CH2)5−NH−CО−(CH2)5−NH−… H2O, HCl …−CО−(CH2)5−NH3+ Cl- +
−CО−(CH2)5−NH−CО−(CH2)5−NH−… H2O, HCl …−CО−(CH2)5−NH3+ Cl- +
+ HO−CО−(CH2)5−NH−…
Система оценивания:
За формулу полиамидной цепи капрона - 3 балла
За уравнение гидролиза - 4 балла
Итого: 7 баллов
10 класс
10-1
1) 3Na2CO3 + 12HF + 2Al(OH)3 = 2 Na3[AlF6] + 3CO2 + 9H2O
Гексафтроалюминат натрия, необходим для создания электропроводной среды и снижения температуры плавления электролита.
2) 2Al2O3 =эл.ток 4Al + 3O2
В 100 кг электролита содержится 80 кг криолита.
n(Na3[AlF6] =80000г : 210 г/моль = 381 моль.
Количество плавиковой кислоты с учетом избытка:
n(HF) =6n(Na3[AlF6]) ⋅1,2 = 381⋅6⋅1,2 = 2743 моль
m(HF) = 2743 моль⋅19 г/моль = 54900 г = 54,9 кг
mp-pa = 54,9 кг : 0,4 =137 кг
Vp-pa = 137 кг : 1,13кг/л = 121 л
В электролизе участвует только оксид лалюминия
m(Al2O3) = m(электроита)⋅ω(Al2O3) = 100⋅0,05=5 кг
n(Al2O3) = 5000 г: 102 г/моль = 49 моль.
n(Al) = 98 моль m(Al) = n(Al) ⋅М ⋅ = 98⋅27⋅0,75 = 1,95 кг.
Система оценивания
За уравнение 1 - 3 балла
За название и установление роли криолита - 3 балла
За уравнение 2 - 1 балл
За расчет плавиковой кислоты - 2 балла
За расчет массы алюминия - 2 балла
Итого: 11 баллов
10-2 (автор Круподер С.А.)
Судя по брутто-формуле, углеводород может быть алкеном или циклоалканом.
По свойству г) алкеном он быть не может.
По свойствам а) и б) мы имеем дело с малым циклом – производным циклопропана или циклобутана.
По свойству в) при гидрировании с разрывом малого цикла получается единственный продукт, стало быть молекула симметрична.
Из структурной формулы 3-метилпропана СН3- СН2- СН(СН3) – СН2 – СН3 очевидно, что исходный углеводород 1,2,3-триметилциклопропан.
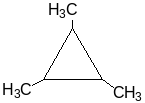
Уравнения реакций
C6H12 + Br2 = C6H12 Br2 СН3- СН(Br)- СН(СН3) – СН(Br) – СН3
C6H12 + HI = C6H13I СН3- СН2- СН(СН3) – СНI – СН3
C6H12 + H2 = C6H14 СН3- СН2- СН(СН3) – СН2– СН3
Система оценивания
Обоснование формулы C6H12 - 3 балла
Графическая формула - 2 балла
Уравнения реакций по 1 баллу - 3 балла
Графические формулы продуктов по 1 баллу - 3 балла
Итого: 11 баллов
10-3
Решение
Уравнение электролиза : 2Н2О = 2Н2 + О2
На катоде выделяется водород, количество которого рассчитаем по закону Менделеева - Клапейрона : 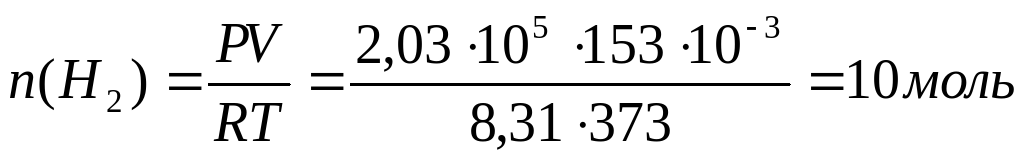
Поскольку электролиз прошел количественно, n(H2O) = 10 моль.
Из 188 г «тяжелой воды» 160 г кислорода и 28 г смеси водорода с дейтерием.
n(смеси ) = 20 моль.
Обозначим n(дейтерия) = x и составим уравнение 2х+1 ⋅(20-х) = 28, откуда х= 8.
Тогда количество водорода равно 20-8=12, а мольное соотношение H : D = 12 : 8 = 3 : 2.
Система оценивания
За уравнение электролиза - 1 балл
За расчет количества вещества водорода - 1 балл
За расчет мольного отношения - 3 балла
Итого: 5 баллов
10-4
Количество вещества хлороводородной кислоты, вступившей в реакцию составляет
n(HCl) = CV = 1 моль/л∙0,125л = 0,125 моль
Количество вещества хлорида натрия составляет
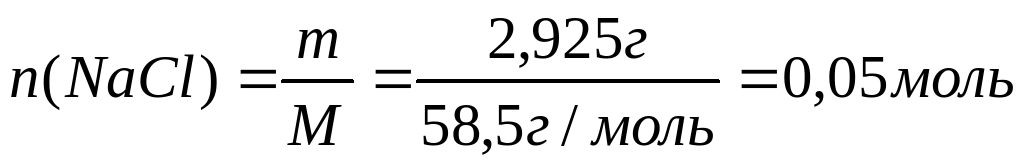
Описание газа В (вызывает помутнение известковой воды) позволяет предположить, что это углекислый газ или диоксид серы:
Са(ОН)2 + СO2 = CaCO3↓ + Н2O;
Са(ОН)2 + SO2 = CaSO3↓ + Н2O.
Следовательно, солью А может быть одна из следующих солей: Na2SO3; NaHSO3; Na2CO3; NaHCO3:
Na2CO3 + 2HC1 = 2NaCl + CO2↑+ H2O; (a)
NaHCO3 + HC1 = NaCl + CO2↑+ H2O; (б)
Na2SO3 + 2НС1 = 2NaCl + SO2↑+ H2O; (в)
NaHSO3 + HC1 = NaCl + SO2↑+ H2O. (г)
Исходя из уравнений реакций рассчитываем массы газов, выделившихся при образовании 0,05 моль хлорида натрия.
т = n∙М
т(CO2) = 44 (г/моль)∙0,025 моль = 1,1 г; (а)
т(CO2) = 44 (г/моль)∙0,05 моль = 2,2 г; (б)
т(SO2) = 64 (г/моль)∙0,025 моль = 1,6 г; (в)
т(SO2) = 64 (г/моль)∙0,05 (моль) = 3,2 г. (г)
Условию задачи соответствует уравнение (а). Следовательно, соль А - Na2CO3, а газ В - СO2:
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O.
Вторая соль даёт то же количество хлорида натрия (0,5 моль) при том же количестве исходной соли; следовательно, второй газ также имеет молярную массу 44 г/моль. Известны по крайне мере ещё два газа с такой же молярной массой: C3H8 и N2O. Из этих двух соединений только оксид азота (I) поддерживает горение и обладает наркотическим или возбуждающим действием.
Следовательно, газ Г - N2O. Сравнение количественных данных показывает, что во второй соли С02 формально заменён на N20, и формула соли Б - Na2N2O2 (гипонитрит натрия - соль неустойчивой азотноватистой кислоты). Разложение гипонитрита натрия соляной кислотой протекает по уравнению:
Na2N2O2 + 2HC1 = 2NaCl + N2O↑+ H2O.
Ответ. А – Na2CO3; Б – Na2N2O2; В – СО2; Г – N2O.
Система оценивания
За определение веществ А, В и Г по 1 баллу - 3балла
За определение вещества Б - 3 балла
За расчеты, дающие обоснование определению А и В - 4 балла
За уравнения 1-6 по 0,5 балла -3 балла
За расчет количества соляной кислоты и хлорида натрия по 0,5 балла – 1 балл
Итого: 14 баллов
10-5
В ходе описанного синтеза получается этиленгликоль:
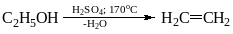
С2Н4 + 2КМnО4 + 4Н2О = С2Н4(ОН)2 + 2МnО2 + 2КОН
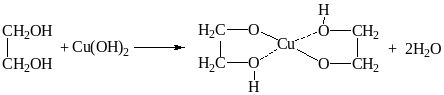
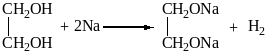
Этиленгликоль взаимодействует с гидроксидом меди (II) и натрием:
3)
4)
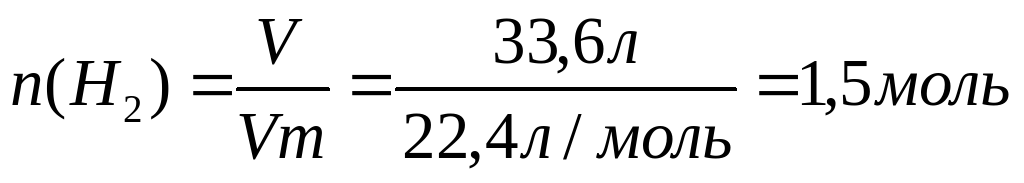
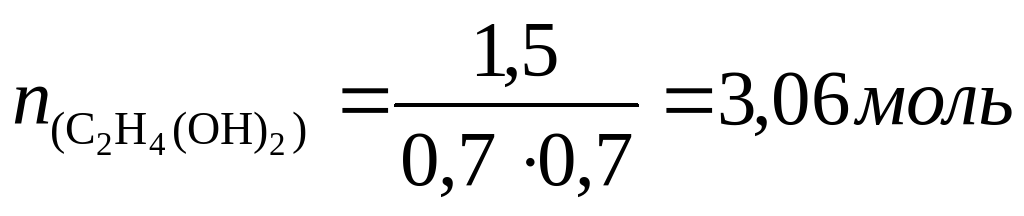 m(C2H4(OH)2) = 3,06 моль ⋅ 62 г/моль = 18,97 г≈19 г
m(C2H4(OH)2) = 3,06 моль ⋅ 62 г/моль = 18,97 г≈19 г
Система оценивания
За определение этиленгликоля - 2 балла
За уравнения 1 и 4 по 1 баллу - 2 балла
За уравнения 2 и 3 по 2 балла - 4 балла
За расчет -1 балл
Итого: 9 баллов
9 класс
9-1
M(NaOH) в исходном растворе 60⋅0,2 = 12 г
В конечном растворе 96⋅0,125= 12 г
Следовательно, щелочь не реагировала с оксидом.
∆mp-pa = 96 – 60 = 36 г
m(оксида) = 36 г
m(O) = 36 – 4 = 32 г n(O) = 2 моль
Вторым элементом в оксиде может быть только Н.
Система оценивания
За определение роли щелочи - 2 балла
За расчет массы оксида - 1 балл
За определение элемента - 3 балла
Итого: 6 баллов
9-2
Na2SO4 + BaCl2 = BaSO4 + 2 NaCl
n(BaSO4) = 23,3 : 233 = 0,1 моль
n(Na2SO4) = 0,1 моль m(Na2SO4) = 14,2 г
m(H2O) = 28,6 – 14,2 = 14,4 г
n(H2O) = 14,4 : 18 = 0,8 моль
формула соли Na2SO4⋅8 H2O
Система оценивания
За составление уравнения - 1 балл
За расчет массы безводной соли - 1 балл
За определение состава кристаллогидрата - 1 балл
Итого: 3 балла
9-3
В состав дыма входят окрашенный диоксид азота и его бесцветный димер. Интенсивность окраски зависит от содержания NO2.
Поскольку в ходе реакции 2NO2⇄ N2O4 число объемов уменьшается, повышение давления способствует смещению равновесия вправо, что будет уменьшать интенсивность окраски.
Летом с увеличением температуры воздуха равновесие процесса сдвигается в сторону эндотермической реакции, что ведет к увеличению концентрации мономера. Это свидетельствует о том, что прямая реакция – экзотермическая.
A) 4NO2 + O2 +H2O = 4 HNO3
HNO3 + NH3 = NH4NO3
NH4NO3→t N2O + 2H2O
Б) 8HNO3 (разб) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
В) NO + NO2→на холоду N2O3
Система оценивания
За описание химизма процесса - 1 балл
За объяснение смещения равновесия - 2 балла
За объяснение теплового эффекта реакции - 2 балла
За уравнения получения N2O - 2 балла
За уравнения Б и В по 2 балла - 4 балла
Итого : 11 баллов
9-4
Составим уравнения реакций, о которых идет речь в условии:
Ti +O2 = TiO2
2Mg + O2 = 2MgO
Молярная масса титана составляет 48 г/моль, а магния - 24 г/моль, поэтому на сжигание одинаковых масс данных металлов расходуется одно и то же количество кислорода и для решения данной задачи неважно известен ли состав смеси металлов или нет.
Если при сгорании 48 г любого из металлов (или их смеси) расходуется 22400 мл О2, то при сгорании 1,5 г любого из металлов (или их смеси) израсходуется Х мл О2.
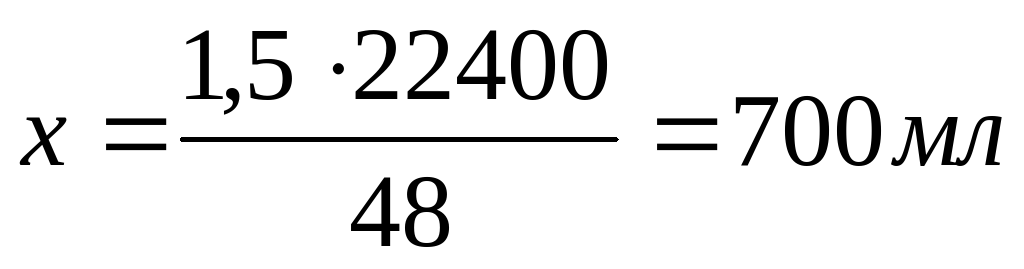
Система оценивания
За уравнения реакций по 1 баллу - 2 балла
За расчет объема кислорода - 3 балла
Итого : 5 баллов
9-5
Рассчитаем молярные концентрации ионов в растворе:
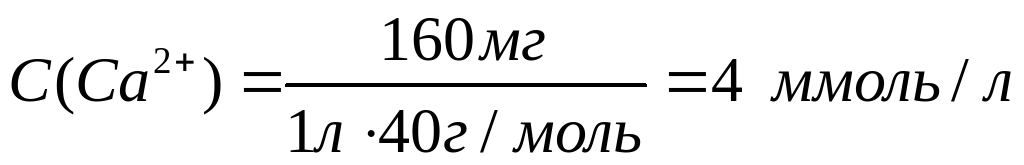
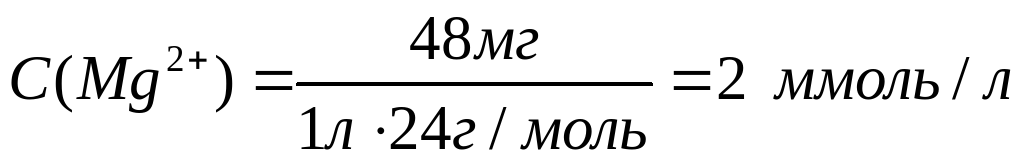
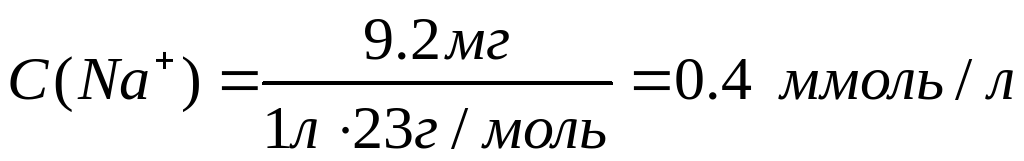
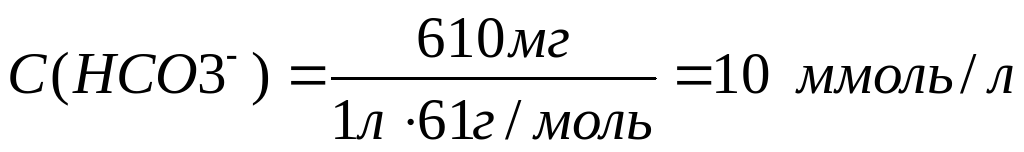
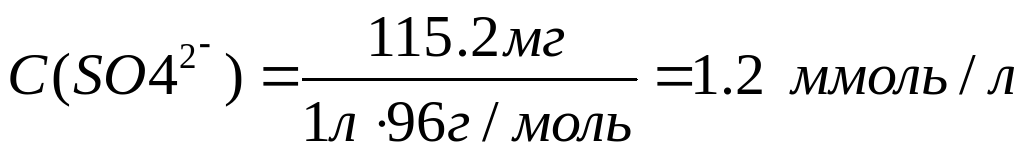
Необходимо учесть, что гидрокарбонаты кальция и магния в твердом виде не выделены, и для приготовления раствора их использовать невозможно.
Для приготовления раствора с заданным составом необходимо взять: 0,2 ммоль Na2SO4; 1 ммоль MgSO4; 1 ммоль MgCO3; 2 ммоль CaCO3 и пропустить углекислый газ для перевода карбонатов магния и кальция в гидрокарбонаты, затем довести дистиллированной водой объем полученного раствора до 1 л.
CaCO3 + CO2 + H2O = Ca(HCO3)2
MgCO3 + CO2 + H2O = Mg(HCO3)2
Рассчитаем навески солей, необходимых для приготовления раствора:
m(Na2SO4) = 0,2 ммоль ∙ 142 г/моль = 28,4 мг
m(MgSO4) = 1 ммоль ∙ 120 г/моль = 120 мг
m(MgСO3) = 1 ммоль ∙ 84 г/моль = 84 мг
m(CaСO3) = 2 ммоль ∙ 100 г/моль = 200 мг
Система оценивания
За установление необходимых солей по 1 баллу - 4 балла
За расчет масс солей по 2 балла - 8 баллов
За объяснение перевода карбонатов в гидрокарбонаты - 3 балла
Итого : 15 баллов






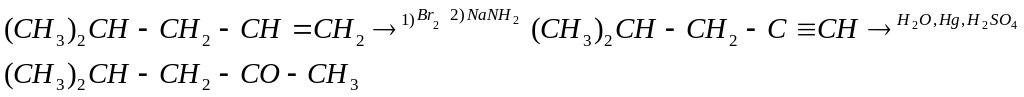
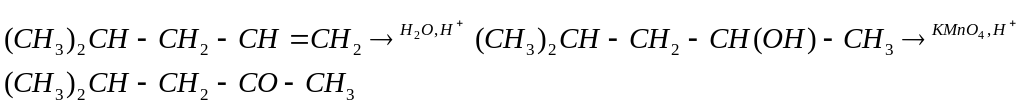
 −CО−(CH2)5−NH−CО−(CH2)5−NH−… H2O, HCl …−CО−(CH2)5−NH3+ Cl- +
−CО−(CH2)5−NH−CО−(CH2)5−NH−… H2O, HCl …−CО−(CH2)5−NH3+ Cl- +