Описание инновационного опыта учителя
Развитие познавательного интереса учащихся при изучении химии в условиях введения ФГОС - одна из основных задач, которую приходится решать учителю в современной школе. Я в своей работе применяю следующие приемы:
1. Для соотношения новой информации с системой прежних знаний провожу на уроках работу с обобщающими таблицами. Например, изучая тему „Ароматические углеводороды" в 10 классе (Приложение 1), составляем таблицу, с помощью которой, пользуясь приемом сравнения, объясняем изменение свойств бензола и толуола. Или в 9 классе при изучении темы «Оксиды углерода» составляем таблицу, с помощью которой даем сравнительную характеристику. Одним из путей развития познавательного интереса я вижу использование на обобщающем уроке различных видов знаний типа кроссвордов, ребусов, чайнвордов. Такие задания способствуют усвоению определенных химических величин, понятий, законов, запоминанию имен ученых, названий и назначений приборов.
2. В химии очень много уроков, связанных с решением задач. Учу ребят решать задачи по алгоритму и самим его составлять. Например, в 8 классе все задачи по теме „Расчеты по уравнениям химических реакций" учащиеся решают по алгоритму (Приложение 2). Считаю, что даже в слабых классах виден неплохой результат, особое внимание уделяю решению качественных задач, где ребята учатся мыслить и применять знания на практике.
3. Самостоятельно найденный ответ – это маленькая победа ребенка в познании сложного мира природы, победа, придающая уверенность в своих возможностях, победа, создающая положительные эмоции, устраняющая неосознанное сопротивление процессу обучения. Чем больше задач и упражнений будет иметь учитель по теме каждого урока, тем лучше он сможет организовать самостоятельную работу учащихся. Многовариантные карточки содействуют повышению активности учащихся на уроках, удобны в обращении и позволяют рационально использовать учебное время. Важно, что при работе по многовариантным карточкам была задействована вся аудитория. Контроль знаний осуществляется по индивидуальным вариантам, но по единой схеме. Результативность самостоятельных работ определяется индивидуальным и дифференцированным подходом к учащимся в процессе их обучения. Мной созданы комплекты данных заданий по некоторым темам, которые я использую на урока в качестве проверки пройденного материала или домашнего задания (Приложение 3).
4. Для того, чтобы у ученика была достаточность опорных знаний, без которых он не может продвинуться в учении, использую работу с опорными конспектами.
Опорные конспекты позволяют ученику составить план изучения химического явления или закона, а также при необходимости очень быстро выполнить и повторить пройденный материал в следующих классах. Например, конспект по теме „Чугун и сталь" (Приложение 4) можно использовать в 9 и 11 классах.
5. На своих уроках использую элементы занимательности - одно из средств формирования устойчивого познавательного интереса, который является своеобразной, эмоциональной разрядкой на уроке и способствует мобилизации внимания и волевых усилий учащихся. Это занимательные и интересные факты из художественной, научно-популярной литературы и других источников. Например:
Чтение лекции сопровождаю необходимыми записями опорных конспектов, рисунками, схемами, знакомлю учащихся с противоречиями в науке, жизнью и деятельностью ученых-химиков (Приложение 5 и 6).
6. Как правило, в ходе урока я создаю проблемные ситуации. Поставленный перед учащимися проблемный вопрос - это прием, при помощи которого мне удается организовать творческое применение предшествующей и усвоение последующей информации, правильно сделать важные выводы, закрепить необходимые знания, умения, навыки.
7. Важную роль имеет химический демонстрационный эксперимент. Он является не только необходимым условием достижения осознанных опорных знаний по химии, но и облегчает понимание технологии химических производств, способствует развитию наблюдательности, умений объяснять наблюдаемые явления, используя для этого теоретические знания, устанавливать причинно-следственные связи.
8. На уроках-практикумах (Приложение 7) широко использую самостоятельный учебный эксперимент, имеющий те же цели, что и демонстрационный эксперимент. Он формирует у учащихся практические умения и умения рационального использования учебного времени; развивает самостоятельность, дает возможность проведения работ исследовательского характера, убедиться в значимости химии как науки в жизненных ситуациях.
9. Активизация процесса обучения достигается применением самостоятельных работ учащихся, организуемых в соответствии с особенностями их интересов и конкретных учебно-воспитательных задач.
Самостоятельная работа как форма развития познавательного интереса учащихся на всех этапах урока и в домашнем задании характеризуется как активная, так как позволяет управлять процессом учения, способствует развитию самостоятельности мышления и стимулирует учебную деятельность. Результативность самостоятельных работ определяется индивидуальным и дифференцированным подходом к учащимся в процессе их обучения.
Приложение 1.
Обобщающая таблица теме „Ароматические углеводороды"
| Характеристика | Бензол | Толуол |
| 1. Состав и строение: |
1.
2.
3. 4. |
1.
2.
3. 4. |
| 2. Получение (указать тип и условия реакции): Из алканов (Д/з); Из циклоалканов (Д/з); Из ацетилена для бензола, из хлорбензола для толуола; Получение толуола из бензола (через оба столбика). |
1. 2. 3.
4. |
1. 2. 3.
4. |
| 3. Физические свойства: Агрегатное состояние; Цвет и запах; Растворимость в воде; Токсичность. |
|
|
| 4, Химические свойства (указать тип и условия реакции): |
1. а) б) 2. 3. 4. 5. |
1. а) б) 2. 3. 4. 5. |
| 5. Применение (домашнее задание). | 1. 2… | 1. 2… |
Приложение 2.
Алгоритм решения задач по теме „Расчеты по уравнениям химических реакций".
m

 1 (V1) 1 n1 2 n2 3 m2 (V2)
1 (V1) 1 n1 2 n2 3 m2 (V2)
n=m/M сравнить m=n·M
n=V/Vm V=n·Vm
Приложение 3.
Задачи по уравнениям химических реакций.
Задание 1. Вычислите массу соли, полученную при взаимодействии вещества А массой m с избытком вещества В.
| Вариант | Вещество А; масса m | Вещество В |
|
| 1 | Серная кислота, 49г | Гидроксид натрия |
| 2 | Соляная кислота, 7,3г | Гидроксид бария |
| 3 | Гидроксид кальция, 18,5г | Соляная кислота |
| 4 | Азотная кислота, 31,5г | Гидроксид кальция |
| 5 | Ортофосфорная кислота, 49г | Гидроксид калия |
|
| 6 | Гидроксид алюминия, 19,5г | Азотная кислота |
| 7 | Гидроксид меди (II), 24,5г | Серная кислота |
| 8 | Гидроксид магния, 29г | Соляная кислота |
| 9 | Серная кислота, 24,5г | Гидроксид калия |
| 10 | Соляная кислота, 7,3г | Гидроксид магния |
|
| 11 | Гидроксид бария, 57г | Серная кислота |
| 12 | Гидроксид натрия, 10г | Ортофосфорная кислота |
| 13 | Гидроксид железа (III), 53,5г | Соляная кислота |
| 14 | Ортофосфорная кислота, 68,6г | Гидроксид лития |
| 15 | Гидроксид кальция, 44,4г | Серная кислота |
|
| 16 | Гидроксид магния, 14,5г | Азотная кислота |
| 17 | Гидроксид цинка, 33г | Азотная кислота |
| 18 | Гидроксид свинца (II), 12,05г | Соляная кислота |
| 19 | Гидроксид алюминия, 3,9г | Серная кислота |
| 20 | Гидроксид лития, 12г | Серная кислота |
|
| 21 | Гидроксид магния, 1,16г | Серная кислота |
| 22 | Гидроксид цинка, 11г | Соляная кислота |
| 23 | Гидроксид меди (II), 1,96г | Соляная кислота |
| 24 | Гидроксид натрия, 10г | Азотная кислота |
| 25 | Гидроксид бария, 3,42г | Азотная кислота |
Задачи по уравнению реакции на растворы.
Задание 1. Определите массу образовавшегося осадка, если в реакцию вступили раствор А массой m с массовой долей ω и избыток раствора В.
| Вариант | Раствор вещества А; масса m; массовой долей ω | Вещество В |
| 1 | Серная кислота, 20г, 5% | Гидроксид бария |
| 2 | Сульфат натрия, 100г, 10% | Хлорид бария |
| 3 | Серная кислота, 150г, 15% | Хлорид бария |
| 4 | Гидроксид кальция, 300г, 25% | Оксид углерода (IV) |
| 5 | Карбонат натрия, 100г, 20% | Нитрат кальция |
| 6 | Хлорид натрия, 50г, 10% | Нитрат серебра |
| 7 | Сульфат меди (II), 100г, 8% | Гидроксид калия |
| 8 | Хлорид железа (III), 140г, 7% | Гидроксид калия |
| 9 | Нитрат алюминия, 200г, 15% | Гидроксид натрия |
| 10 | Хлорид магния, 40г, 6% | Карбонат калия |
| 11 | Нитрат серебра, 70г, 10% | Соляная кислота |
| 12 | Хлорид меди (II), 30г, 5% | Гидроксид бария |
| 13 | Сульфид натрия, 80г, 8% | Нитрат свинца (II) |
| 14 | Нитрат свинца (II), 100г, 9% | Гидроксид калия |
| 15 | Гидроксид бария, 100г, 45% | Оксид углерода (IV) |
| 16 | Ортофосфорная кислота, 200г, 5% | Гидроксид бария |
| 17 | Серная кислота, 80г, 10% | Нитрат бария |
| 18 | Нитрат железа (III), 150г, 15% | Гидроксид натрия |
| 19 | Нитрат ртути (II), 250г, 25% | Сульфид калия |
| 20 | Хлорид Алюминия, 100г, 40% | Гидроксид калия |
| 21 | Хлорид Алюминия, 140г, 7% | Ортофосфорная кислота, |
| 22 | Хлорид Алюминия, 300г, 20% | Фосфат калия |
| 23 | Гидроксид кальция, 300г, 10% | Ортофосфорная кислота, |
| 24 | Нитрат свинца (II), 70г, 7% | Серная кислота, |
| 25 | Нитрат свинца (II), 90г, 9% | Сульфат натрия |
Типы химической связи.
Задание 1.:
1. Определите вещества, в которых осуществляется следующий тип связи:
а) металлическая б) ионная в) ковалентная полярная
г) ковалентная неполярная.
2. Определите №№ веществ, у которых обобществленные электроны в одинаковой степени принадлежат атомам, образующим связи.
Назовите №№ соединений, способных образовывать водородные связи.
| Вариант | №№ заданий |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | N2 | SiF4 | Fe | Na2O | H2O | Al2S3 |
| 2 | Ba | Li3N | BF3 | HJ | J2 | ZnCl2 |
| 3 | K2S | Zn | KJ | Si | H2S | PCl5 |
| 4 | HBr | F2 | K | CO2 | Na3P | MgH2 |
| 5 | O2 | NH3 | Cl2O7 | Ca | ZnS | CaO |
| 6 | Ag | PbO | O2 | ZnS | H2S | SO3 |
| 7 | Cl2O3 | Na | Al2O3 | NO | S | FeCl3 |
| 8 | SeO3 | CuO | P | Ca | CH4 | Li2S |
| 9 | Br2 | KBr | Li | B2O3 | MgO | PH3 |
| 10 | CrCl3 | C | NO2 | H2S | Cu | Na2S |
| 11 | MnO2 | P2O5 | NH3 | O2 | LiBr | Mg |
| 12 | Al | FeS | CaI | P2O3 | Cl2 | HCl |
| 13 | HI | I2 | Zn | ZnI2 | SO2 | Al2S3 |
| 14 | BaO | Pb | CO | K2O | H2Se | F2 |
| 15 | H2 | FeBr3 | CuS | Sn | HBr | SiO2 |
| 16 | Br2O7 | Br2 | MgCl2 | NH3 | Ba | NiO |
| 17 | P2O5 | N2O5 | Ni | AlN | KH | S |
| 18 | CrO3 | P | H2S | I2O7 | MgS | Mn |
| 19 | Au | SiH4 | N2O3 | Si | Na2O | MnCl2 |
| 20 | ZnI2 | Hg | PH3 | CO2 | N2 | LiCl |
| 21 | B | B2O3 | H2S | Pt | Al2S3 | CuF2 |
| 22 | CaS | SO3 | C | HI | CoCl2 | Co |
| 23 | PCl3 | O2 | FeBr3 | Br2O5 | W | NiCl2 |
| 24 | SrCl2 | SO3 | Sr | N2 | KCl | SiO2 |
| 25 | H2S | Rb | MnBr2 | H2O | NaI | Cl2 |
Приложение 4.
Схема-конспект по теме «Чугун и сталь»
Производство чугуна
Чугун – это сплав железа (92,7%), углерода (от 2 до 4,4%), серы (0,07%), марганца (1,75%), фосфора (0,03%), кремния (1,75%).
Ч
 угун
угун
Серый Белый
(литейный) (передельный)
Углерод в виде графита Углерод в виде цементита Fe3C,
повышенное
содержание марганца и серы (до 1%)
Сырье: 1) железная руда (гематит Fe2O3 или магнетит Fe3O4)
2) топливо (кокс С или природный газ СН4)
3) флюсы (известняк CaCO3)
Этапы: 1. Обогащение – освобождение от пустой породы. Переделка руды на концентрат
(большое содержание железа) и хвосты (пустая порода)
2. Подготовка плавильных материалов: 1) дробление; 2) усреднение (увеличивают
поверхность соприкосновения реагирующих веществ, для равномерного протекания процесса и высокой скорости); 3) спекание мелких кусков в агломераты.
3. Выплавка.
Химизм процесса:
Руда: Fe2O3 → Fe3O4 → FeO →Fe → Fe3C (восстановление железа)
3 Fe2O3 + CO → 2Fe3O4 + CO2 + Q (t = 200 - 400°C)
Fe3O4 + CO → 3FeO + CO2 - Q (t = 500°C)
FeO + CO → Fe + CO2 + Q (t = 600°C)
Частично железо растворяет в себе углерод, образуя карбид железа (цементит Fe3C)
3Fe + 2CO → Fe3C + CO2 (t = 1000 - 1300°C)
Топливо: C → CO2 → CO (восстановитель)
С + О2 → СО2 + Q
СО2 + C → 2 СО - Q
или природный газ (процесс ускоряется)
СН4 + 2О2 → СО2 + 2Н2О + Q
Флюсы (шлакообразователи): СаСО3 → СаО → Са3(РО4)2 или СаSiO3 или CaS
CaCO3 → CaO + CO2 (t = 2000°С)
CaO + SiO2 → CaO∙SiO2 (СаSiO3)
3CaO + P2O5 → Са3(РО4)2
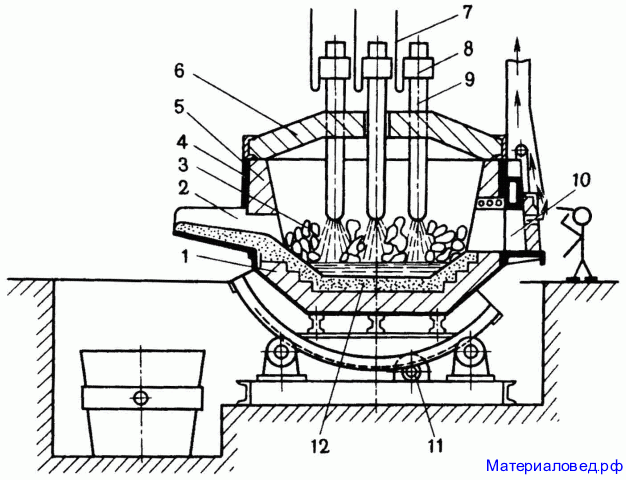
У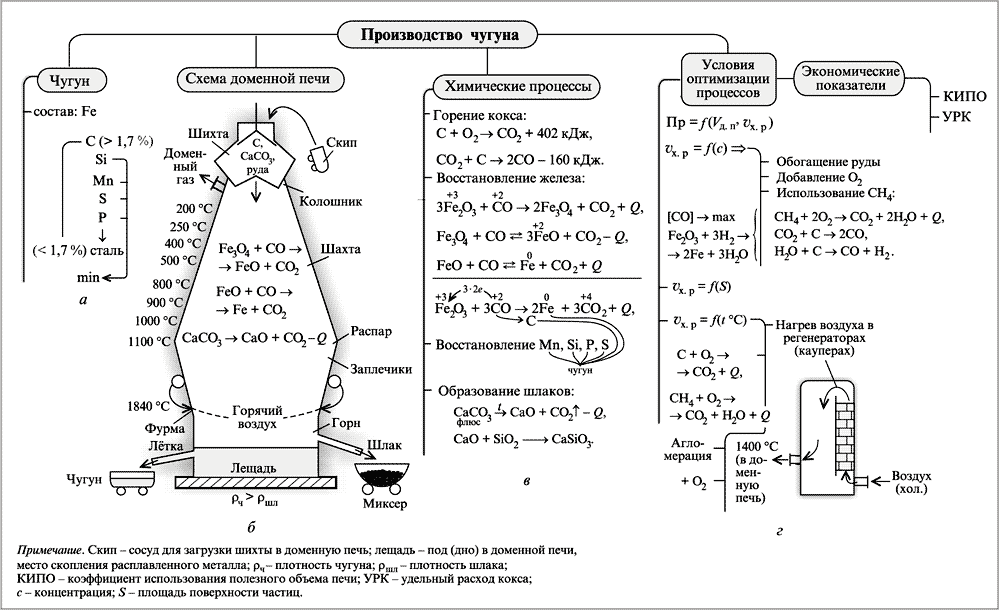

 стройство доменной печи: печь имеет форму усеченного конуса высотой до 80м, диаметром 5-6м, емкостью 5000м3. Ежесуточный выход чугуна – 2000т, годовой – 4млн.т.
стройство доменной печи: печь имеет форму усеченного конуса высотой до 80м, диаметром 5-6м, емкостью 5000м3. Ежесуточный выход чугуна – 2000т, годовой – 4млн.т.
Домна состоит из скипа, по которому подают шихту; колошника – загрузочного аппарата; шахты; распара – расширенная часть; горна; фурмы; летков для вывода шлака и чугуна.
Научные принципы производства:
1. Непрерывность процесса.
2. Механизация и автоматизация.
3. Использование противотока.
4. Теплообмен.
5. Увеличение поверхности соприкосновения.
1800кг 300кг 400кг 2500 – 3500кг
 руда топливо флюсы воздух
руда топливо флюсы воздух
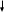
1000кг 400кг 500кг
чугун шлак доменный
(колошниковый) газ
Производство стали
Сталь – это продукт черной металлургии, сплав железа с углеродом (менее 2 %), а так же марганца, кремния, фосфора и серы.
Сырье: 1) передельный (белый) чугун
2) металлолом
3) руда
4) топливо (кокс, мазут, природный газ)
5) кислород
6) известняк (СаСО3 → СаО)
Химизм процесса: сущность передела чугуна в сталь – снижение содержания углерода и примесей путем их избирательного окисления и перевода в шлак и газы в процессе плавки.
2Fe + O2 → 2FeO
С + 2FeO → 2Fe + CO2
Mn + FeO → Fe + MnO
Si + 2FeO → 2Fe + SiO2
2P + 5FeO → 5Fe + P2O5
S + 2FeO → 2Fe + SO2
Для удаления остатков FeO в расплавленную сталь добавляют раскислитель (ферромарганец)
CaO + SiO2 → CaO∙SiO2 (СаSiO3)
3CaO + P2O5 → Са3(РО4)2
MnO + SiO2 → MnSiO3
Условия протекания реакции:
Кислородное дутье.
Температурный режим.
Измельчение сырья.
Использование определенного сырья для каждого метода производства стали.
С пособы производства стали
пособы производства стали
Кислородно-конверторный (метод Бессемера)
Периодическое действие
Использование теплоты термохимической реакции
Используют жидкий чугун
Температура 1700°С
Время выплавки партии 30 -40 минут
Экономично и производительно
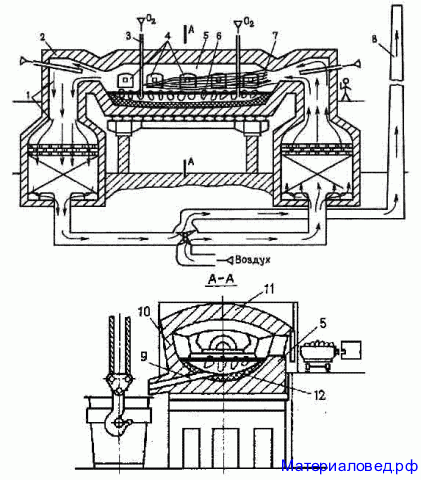
II.Мартеновский
Используют мазутное топливо
Переплавляют металлолом и чугун
Используют сырье любого качества
Получают высококачественную сталь
Температура 1700 - 1750°С
Время выплавки партии 6 - 8 часов
III. Электродуговой
Используют электричество
Получают любую сталь, даже легированную и
тугоплавкую
Температура 2000°С
Приложение 5.
Духовно-нравственное воспитание на уроках химии.
Дать образование и не внушить
моральных и гражданских принципов –
значит воспитать ещё одну угрозу обществу.
Теодор Рузвельт
Наверное, каждый взрослый хочет, чтобы его дети выросли здоровыми, жизнерадостными, аккуратными, честными, справедливыми, настойчивыми, трудолюбивыми, заботливыми по отношению к своим близким. Как бы это ни было обидно для учителей - предметников, но содержание предмета «отходит» всегда на второй план. Родитель скорее предъявит требования к учителю, как к педагогу. Ему нет дела до государственных стандартов и степени обученности. Его волнует, как чувствует себя ребенок на уроке, найден ли контакт с ним, нет ли предвзятости, оказывает ли школа воспитательное воздействие.
ФЕДЕРАЛЬНЫЙ ГОСУДАРСТВЕННЫЙ ОБРАЗОВАТЕЛЬНЫЙ СТАНДАРТ СРЕДНЕГО (ПОЛНОГО) ОБЩЕГО ОБРАЗОВАНИЯ
Введение
Настоящий Федеральный государственный образовательный стандарт среднего (полного) общего образования устанавливает нормативные основы обеспечения государством конституционных прав граждан на общедоступное и бесплатное среднее (полное) общее образование в интересах становления личности, гражданственности и самосознания обучающихся, их духовно-нравственного развития, обеспечения национальной сплоченности, безопасности и социального прогресса, качества и конкурентоспособности российского образования.
Стандарт направлен на обеспечении духовно-нравственного развития, воспитания и социализации обучающихся; стандарт ориентирован на становление в процессе обучения и воспитания личностных характеристик выпускника. Это гражданин, любящий свой край и свою Родину, уважающий свой народ, его историю, культуру и духовные традиции, стремящийся к личному нравственному совершенствованию; основные цели среднего (полного) общего образования состоят в обеспечении условий обучения и воспитания, формирования гражданской идентичности, социального становления личности, самореализации в социально и личностно значимой деятельности, социализации и, конечно, духовно- нравственного развития обучающихся.
Мыслители разных веков трактовали понятие нравственности по-разному. Еще в древней Греции в трудах Аристотеля о нравственном человеке говорилось: ”Нравственно прекрасным называют человека совершенного достоинства… Ведь о нравственной красоте говорят по поводу добродетели: нравственно прекрасным зовут человека справедливого, мужественного, благоразумного и вообще обладающего всеми добродетелями”.
С годами понимание нравственности изменилось. У Ожегова С. И. мы видим: “Нравственность - это внутренние, духовные качества, которыми руководствуется человек, этические нормы, правила поведения, определяемые этими качествами “.
В. И. Даль толковал слово мораль как “нравственное ученье, правила для воли, совести человека”.
В кратком словаре по философии понятие нравственности приравнено к понятию мораль. “Мораль (латинское mores-нравы) - нормы, принципы, правила поведения людей, а также само человеческое поведение (мотивы поступков, результаты деятельности), чувства, суждения, в которых выражается нормативная регуляция отношений людей друг с другом и общественным целым (коллективом, классом, народом, обществом)”.
В этическом словаре под моралью, или нравственностью понимается специфическая форма общественного сознания, которая представляет собой совокупность принципов, требований. Норм и правил, регулирующих поведение человека во всех без исключения сферах его общественной и личной жизни, его отношение к обществу, к той социальной группе. Представителем, которой он является, к себе как к члену данного общества, а также к выполнению возложенных на него социальных обязанностей.
В отношении между людьми всегда высоко ценились нравственные чувства, такие моральные качества как доброта, милосердие, терпимость, порядочность, вежливость, умение правильно вести себя в обществе, семье, быту, в коллективе. Это и многое другое входит в содержание нравственной культуры. Она не передается по наследству, не возникает сама по себе, а требует специального нравственного воспитания.
Педагог Л. С. Выготский считает, что нравственное воспитание только тогда эффективно, когда оно не идет вслед за спонтанным развитием учащихся, а способствует обогащению их поведенческого опыта, формированию личностных качеств, находящихся в стадии зарождения. Его вывод таков: нравственное воспитание должно идти впереди личностного развития.
Ряд современных ученых проводят диагностику нравственной сферы. Их выводы сводятся к следующему; несмотря на гуманизацию современного образования, на увеличение предметов гуманитарного цикла, нравственное состояние общества продолжает падать, если сравнивать его с советской эпохой. В обществе снижается престиж таких понятий, как патриотизм, самопожертвование, альтруизм, гуманизм, коллективизм. Психолог А. Гармаев даже вывел законы, связанные с падением нравственности человека. Они выглядят следующим образом:
1) в обществе действует закон оскудения нравственных сил, вызванный
дефицитом добра, любви в душах людей по причине того, что у них отсутствует источник пополнения нравственных сил,
2) закон хранения истины, суть которого сводится к попытке отыскать
источник нравственного, чтобы выработать духовные ценности;
3) закон опережения нравственного развития над умственным.
Вывод А. Гармаева совпадает с точкой зрения Л. С. Выготского: духовное развитие человека должно опережать интеллектуальное. Практически это означает, что сначала надо воспитывать нравственные чувства в учениках, подключать их к нравственному опыту человечества, а затем на этой основе наделять их знаниями и учить их добывать новые. Поэтому педагогика нравственного воспитания должна строится в основном на внутреннем духовном росте ребенка, а педагог должен создать условия для этого роста.
Итак, главная цель нравственного воспитания заключается в следующем: включить учащихся в процесс осознания и переживания нравственных ценностей в качестве потребностей личности, субъективно-значимых, устойчивых жизненных ориентиров на основе исторических фактов.
Одним из важнейших путей раскрытия человеческого смысла любой науки является обращение к ее истории. Сведения по истории науки в школьных учебниках или вообще отсутствуют, или представлены датами, именами и кратким описанием основных достижений. Поэтому они не выполняют воспитательной функции. Каким образом, какой ценой было достигнуто новое в науке, часто остается «за кадром». Личность ученого исчезает, ее достоинства и недостатки не поддаются анализу, от внимания ускользает значение пройденного человеком жизненного пути. Для усиления воспитательного воздействия «героем» курса истории науки должна стать научная мысль, ее победы и поражения, взлеты и падения, ее трагедии. Только в этом случае возможно доказать, что научные открытия являются уникальными достижениями ученых, имеющими значение для человечества в целом, а не для отдельного химического процесса или области применения.
Направления нравственного воспитания на уроках химии:
1) Люди. Биографии ученых химиков. (Не бывает имени без отчества, а отчества без отечества. «Огорчающий ближнего, едва ли сам избежит огорчения»). Научное открытие: случайность, поиск, трудолюбие, гениальная догадка. Цель: учащиеся должны понимать, что любое открытие завершает кропотливую, многолетнюю деятельность многих ученых.
2) Дела. Открытия элементов, веществ и химических реакций. (Не говори о любви к Родине, сделай доброе дело для Родины. «Статую красит вид, а человека – деяние его»). «Человеческое лицо» химической реакции: какой путь научного поиска стоит за химическими формулами. Цель: учащиеся должны знать, что к любому знаку в уравнении химической реакции надо относиться с большим уважением, как к результату чужого труда.
3) Культура. Краеведческие материалы. (Народ познаётся по отношению к своим святыням. «Истинное отечество там, где есть благие нравы»). Ответственность за научное открытие, или можно ли поставить знак равенства между ученым и высоконравственным человеком? Цель: учащиеся должны анализировать поступки и мотивы других людей, оценивать последствия этих поступков, любить и уважать родную культуру.
4) Природа. Экология. Почему человек стремится совершить научное открытие? Цена научного открытия. Цель: учащиеся должны объяснять, какие мотивы деятельности движут познавательной активностью человека.
Важную роль в духовно-нравственном воспитании играет личность самого учителя, «его позиция и образ: эмоциональность, ответственность, педагогическая любовь, педагогический оптимизм». (А. С. Макаренко).
Если на уроке химии учащиеся хотя бы немного прикоснутся к миру прекрасного, доброго, то можно сказать, что в какой-то мере их душа и мысли станут чище, нравственнее.
Есть выражение: «Капля камень точит». Надеюсь, что такой каплей среди разнообразнейших форм нравственного воспитания учащихся в школе являются и уроки химии.
"В добрый путь по безбрежному морю
нравственной культуры!"
С.В.Михалков.
Список источников и литературы:
Данилюк А.Я., Кондаков А.М., Тишков В.А. Концепция духовно-нравственного развития и воспитания личности гражданина России. М.: Просвещение, 2011.
Янушкевичене Р. В., Янушкевичене С. Л. Основы нравственности. - М., 1999.
http://area7.ru/metodic-material.php?3161
http://www.pravsemia.ru/articles/1061/1064.htm
http://www.proshkolu.ru/user/kucherjavaja65/blog/211974/
http://standart.edu.ru/
Приложение 6
Дмитрий Иванович Менделеев
Интересные факты из жизни великого ученого
Цели презентации:
Раскрыть образ Менделеева – человека, учёного и гражданина;
Познакомиться с интересными фактами из жизни Д. И. Менделеева;
Убедиться в разносторонности и многогранном мире интересов в жизни и науке нашего соотечественника – Д. И. Менделеева.
"Д.И. Менделеев - это воплощение глубокого Ума и тонкого Восприятия всей действительности" (А. Блок)
«... Я люблю свою страну, как мать, а свою науку - как дух, который благословляет, освещает и объединяет все народы для блага и мирного развития духовных и материальных богатств» (Д.И. Менделеев)
"Опережать время" - этот девиз был лейтмотивом творчества Д.И.Менделеева.
Автор фундаментальных исследований по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, экономике и др. Он всегда был увлечен разнообразными идеями и проектами и настойчиво претворял их в жизнь, мог одновременно работать в нескольких направлениях. Всюду успевал, быстро, иногда почти в невероятно короткие сроки создавал крупные монографии или решал важные научные и научно-технические проблемы. Кажется, что в человеческом опыте нет такой области, в которой не оставил бы след великий русский ученый Д.И.Менделеев.
Биография
Д.И.Менделеев родился 8 февраля 1834 года в Тобольске и прожил 73 года. За это время произошли большие изменения как в жизни страны, где он жил, так и в науке, которой он служил. Со временем менялся и сам ученый: он становился мудрее, чего-то достигал и от чего-то отказывался, но в главном - в своих устремлениях, правилах, привычках - он почти не менялся. Это была натура цельная и самобытная.
Д.И.Менделеев был 17 (последним) ребенком в семье. Ко времени рождения в семье Менделеевых в живых осталось два брата и пять сестер, восемь детей умерли еще в младенческом возрасте и троим из них, родители не успели дать даже имени.
Родители Менделеева
Мария Дмитриевна Менделеева (1793 - 1830), мать ученого.
Иван Павлович Менделеев (1783 - 1847), отец ученого.
Почему у Дмитрия Ивановича фамилия Менделеев, хотя дед его звался Соколов?
Отец Дмитрия Ивановича- Иван Павлович- родился в 1783 г. в семье священника Павла Максимовича Соколова. Четырем его сыновьям, как это было принято тогда у священнослужителей, были даны разные фамилии. Отец Дмитрия Ивановича получил фамилию соседних помещиков Менделеевых.
Полный тёзка.
У Менделеева был племянник Дмитрий Иванович Менделеев(1851-1911)- сын брата Менделеева Ивана Ивановича. Племянник окончил Казанский университет, служил железнодорожным врачом во многих местах России, часто встречался со своим знаменитым дядей, а однажды вместе с ним совершил путешествие по Волге. Поскольку дядя и племянник были полными тезками, их нередко путали.
Биография
Д.И.Менделеев - великий ученый, во время обучения в педагогическом институте был оставлен на второй год.
Учеба вначале давалась нелегко. На первом курсе института он умудрился по всем предметам, кроме математики, получить неудовлетворительные отметки. Да и по математике он имел всего лишь "удовлетворительно"... Но на старших курсах дело пошло по-другому: среднегодовой балл у Менделеева был равен 4,5 при единственной тройке.
Дмитрий Иванович окончил институт в 1855 г. с золотой медалью, получив диплом старшего учителя.
Мастер чемоданных дел.
Менделеев любил переплетать книги, клеить рамки для портретов, изготовлять чемоданы. Покупки для этих работ он обычно делал в Гостинном дворе. Однажды, выбирая нужный товар, он услыхал за спиной вопрос одного из покупателей:
- Кто этот почтенный господин?
- Таких людей надо знать, - с уважением в голосе ответил приказчик.
- Это мастер чемоданных дел Менделеев
Первая жена учёного
В 1862 году Менделеев обвенчался с Феозвой Никитичной. Она была старше его на 6 лет. Феозва Никитична не интересовалась научной работой мужа, а его беспокойный образ жизни вызывал только ее раздражение.
Второй брак Менделеева
В 1880 г. у Дм. Ивановича возник интерес к Анне Ивановне Поповой (1860-1942), художнице, которая часто бывала в доме Менделеевых. Жена Менделеева на развод не соглашалась, а расторжение брака в то время было трудным делом. Посредником между супругами Менделеевыми стал А.Н.Бекетов, которому удалось получить согласие Феозвы Никитичны на развод. В 1881 г. брак был расторгнут. В апреле 1882 года священник Адмиралтейской церкви Куткевич за 10000 рублей обвенчал Менделеева и Попову.
Менделеев и Блок.
У Дмитрия Ивановича и Анны Ивановны было четверо детей. Дочь Любовь Дмитриевна окончила Высшие женские курсы в Петербурге, в 1903 г. вышла замуж за поэта Александра Блока. Впоследствии Блок посвятил Любе "Стихи о Прекрасной Даме".
Увлечения Менделеева
В 90-х годах Д.И.Менделеев был избран членом Совета Академии художеств в Петербурге. Он любил живопись, даже публиковал рецензии о картинах.
Менделеев любил музыку. Друзья даже прозвали его "Леонорой" за то, что он часто напевал увертюру из оперы Бетховена "Леонора". Одно из своих писем к Менделееву композитор Бородин заканчивает шутливыми словами: "Прощай, Леонора!".
Научная работа отнимала много сил у Д.И.Менделеева, но он все же находил время и для своего досуга - игра в шахматы, литература, музыка, балет. Особенно ему нравился балет П.И.Чайковского "Лебединое озеро", опера М.И.Глинки "Иван Сусанин", байроновская
"Тьма", лирическая драма "Три смерти" Майкова и стихотворение Тютчева "Молчание!"
Как истинный русский человек, Д.И. любил русскую баню. Он ходил в общую баню, любил поговорить с банщиками.
Первый русский учебник
С 1861 г. Менделеев читает лекции в Петербургском университете. В этом же году публикует свой первый русский учебник. За него автор удостоен Демидовской премии.
Деятельность Менделеева
При деятельном участии Д.И.Менделеева было создано Русское химическое общество (ныне Всесоюзное химическое общество имени Д.И. Менделеева).
В 1866 г. А. И. Шпаковский изобрел форсунку с паровым распылением для сжигания мазута. В результате этого мазут получил широкое применение в качестве топлива. Д.И.Менделеев первым предложил перевести на нефтяное топливо морской флот. В 1887 г. на Черном море были проведены испытания на миноносцах "Сова" и "Лука". Они дали весьма положительные результаты.
В 1892 г. под Москвой по проекту Д.И. Менделеева была построена установка непрерывного действия по переработке нефти.
Менделеев был редактором нескольких энциклопедий (технической, библиотеки промышленных знаний, энциклопедии Брокгауза и Ефрона).
Трепетно относился к своей работе педагога. Д.И.Менделеев стоял у истоков высшего женского образования в России. Он был в числе первых лекторов на Высших женских курсах.
"Менделеевские среды".
По средам Д.И.Менделеев принимал в своей квартире друзей. Здесь бывали А.П.Бородин, Н.Н.Зинин, И.Н. Крамской, И.Е.Репин, А.И.Куинджи, Н.А. Ярошенко и другие. Это были "менделеевские среды".
Дом в имении Боблово
Менделеев считал, что человек должен активно вмешиваться в химический режим почвы. Приобретя небольшое имение под Москвой, он ввел многопольное хозяйство с рациональным внесением минеральных удобрений. Изучать его опыт приезжали профессора из Сельскохозяйственной академии.
"Дедушка русской химии"
"Дедушкой русской химии" Менделеев называл своего учителя, профессора Петербургского главного педагогического института Александра Абрамовича Воскресенского.
В 1894 г. Дм. Иванович получил приглашение из Кембриджа и Оксфорда, где ему присудили докторскую степень. Докторскую степень в Кембридже и Оксфорде дают как исключение - это университеты противоположных направлений. Получивший докторскую степень в Кембридже, не получает ее в Оксфорде, и наоборот. Менделеев получил обе. Д.И.Менделеев первый русский ученный, получивший докторскую степень в Кембридже.
Д.И.Менделеев - почетный член более 90 академий наук, научных обществ университетов и институтов разных стран мира. Российская Академия наук забаллотировала кандидатуру Менделеева в академики из-за его прогрессивных взглядов.
Поездка на Урал
В 1899 г. Д. И. Менделеев совершил большую поездку на Урал для выяснения причин застоя уральской железной промышленности. К участию в экспедиции он привлек П. А. Земятченского, С. П. Вуколова и К. Н. Егорова. Участниками экспедиции была написана книга «Уральская железная промышленность в 1899 г.»
Достижения Менделеева
Д.И.Менделеев интересовался воздухоплаванием. Он понимал, что для этого необходимо изучить как нижние, так и верхние слои атмосферы. В 1875 г. он изобрел стратостат, а в 1887 г. во время солнечного затмения в возрасте 53 лет он один поднялся на воздушном шаре для изучения явлений, наблюдаемых при затмении. В таком возрасте это был действительно героический поступок.
Дмитрий Иванович разработал методику получения дополнительных количеств бензина и керосина из паров нефти, его интересовали вопросы происхождения и распространения нефти.
Весы для взвешивания газообразных и твёрдых веществ, созданные Менделеевым
Менделеев сконструировал пикнометр — прибор для определения плотности жидкости.
Менделеев опубликовал 431 научную работу, в том числе 146 - по различным вопросам химии, 99 работ посвящены различным областям техники, 36 - по экономике и социологии, 22 - по географии, 29 - по другим вопросам.
Проект ледокола
В 1901—1902 годах Д. И. Менделеев создал проект арктического экспедиционного ледокола. Учёным разработан высокоширотный «промышленный» морской путь, подразумевавший прохождение судов вблизи Северного полюса.
В области химии Менделеев был физиком и, наоборот, в физике интересовался особо химической проблемой
О создании таблицы:
В 1869 году Д. И. Менделеев знакомит химиков со статьёй «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» и докладывает эту работу на заседании только что созданного Русского химического общества. После дальнейшей доработки в 1871 году появилась его знаменитая статья «Периодический закон для химических элементов»
Он закупил штук семьдесят пустых визитных карточек и на каждой из них написал с одной стороны название элемента, а с другой - его атомный вес и формулы его важнейших соединений. После этого он уселся за большой квадратный стол и начал по-всякому раскладывать эти карточки. Сначала у него ничего не получалось. Десятки и сотни раз он их раскладывал, перетасовывал и снова раскладывал. При этом, как он потом вспоминал, в его сознании всплывали какие-то новые закономерности, и он с хорошо знакомым ему волнением, предшествующим открытию, продолжал свое занятие. Так он проводил целые часы и дни, запершись в своем кабинете. Благо, к тому времени он уже был женат на Анне Григорьевне, которая сумела создать ему наилучшие условия для творческих занятий.
Легенду о том, что идея периодической таблицы пришла к нему во сне, Менделеев придумал специально для настырных поклонников, не ведающих о том, что такое творческое озарение. На самом же деле его просто осенило. Иными словами, ему сразу и окончательно стало ясно, в каком порядке надо разложить карточки, чтобы каждый элемент занял подобающее ему место, согласно законам природы.
Из письма Д.И.Менделеева своим детям: "Первое и главное в жизни - труд для других. Один каждый - нуль, ...Труд всякий; если не про себя одного, самый скромный, самый невидимый - осветит жизнь, потому что светло и ладно в жизни, даже в веселье, только от других, и плод труда - польза другим. ...Учение себе - плод учения другим. Другого смысла в учении нет, иначе его бы не надо".
Умер Д.И.Менделеев 2 февраля 1907 года.
На всех родных самое сильное впечатление произвела несметная толпа народа, провожавшая ученого в последний путь. Молодежь несла в руках периодические таблицы. Это было лучшим венком и лучшим украшением на похоронах ученого, трудившегося всю жизнь для своей страны.
Заключение
«Широта ума, сила воображения и активность души – вот что такое гений», - писал Дени Дидро. Эти слова в полной мере можно отнести к Д.И. Менделееву, хотя он себя гением не считал: «Трудился всю жизнь, вот и стал гений». Открытия Менделеева в области химии трудно переоценить – он заложил основу современной науки
Кроме того, он сделал ряд открытий в физике, испытал радости полевода-новатора, совершил путешествие на воздушном шаре, придумал ряд приборов для воздухоплавания, подготовил введение в стране метрической системы, выдвинул и обосновал идею подземной газификации топлива
Во всех этих и многих других славных деяниях Менделеев предстает как энциклопедист, ученый необычайной разносторонности и всеохватного ума. Движущей силой каждой работы ученого был патриотический порыв – пламенное стремление принести пользу стране
Д.И.Менделееву установлены памятники:
г. Ленинград (ныне Санкт-Петербург) - три памятника, один из них около института метрологии;
Именем ученого - химика названы:
Подводный хребет, расположенный в центральной части Северного Ледовитого океана, его протяженность 1500 км.
Вулкан на о. Кунашир, расположенный к юго-западу от города Южно-Сахалинск.
Ледник, находящийся в массиве Вольта, 71°54' ю.ш. и 14°30'в.д.
Кратер на Луне, вблизи моря Москва
101 химический элемент, открытый группой американских ученых - Г.Сиборгом, А.Джиорзо, Б.Харвеем, Дж.Чоппином и С.Томсоном.
Воспоминания родных и близких людей о Д.И.Менделееве
Характерная черта - не любил, когда при нем про кого-нибудь говорили дурно
Не любил в характере - неуверенность, необдуманность, торопливость в работе
Любимое качество - правда, труд, прощение
Любимое животное - кошки, собаки
Место, где любил жить – Боблово
Любимые писатели - Жюль Верн, Гюго, Пушкин, Гоголь
Любимые поэты - Шекспир, Шиллер, Гете, Байрон, Пушкин, Жуковский, Майков, Тютчев
Любимые художники – Микеланджело, Рафаэль, Крамской, Куинджи, Шишкин,
Общий вывод
Раскрыли образ Менделеева – человека, учёного и гражданина;
Познакомились с интересными фактами из жизни Д. И. Менделеева;
Убедились в разносторонности и многогранном мире интересов в жизни и науке нашего соотечественника – Д. И. Менделеева.
Приложение 7.
СТРУКТУРА И ХОД УРОКА
«Приготовление растворов с заданной концентрацией» 8 класс
| № | Этап урока | Деятельность учителя | Деятельность ученика | Формируемые УУД |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Самоопределение к деятельности. Организационный момент (1 мин) | Приветствует обучающихся, определяет готовность к уроку
| Приветствуют учителя, проверяют свои рабочие места | Коммуникативные: планирование учебного сотрудничества с учителем и сверстниками. |
| 2 | Актуализация знаний и фиксация затруднений в деятельности (5 мин) | Что изображено на этом рисунке? (1 слайд) Сформулируйте тему урока. (2 слайд) Являются ли данные понятия растворами: молоко, морская вода, гранит, растительное масло с водой, газированная вода? Растворы встречаются везде. Что такое растворы? (3 слайд) Какие компоненты входят в состав раствора? Какие виды растворов вы знаете? Что такое концентрация? Какие способы выражения концентрации вы знаете? (4 слайд) Условия быстрого растворения? (5 слайд) | Обучающиеся отвечают на вопросы. Формулируют тему урока и записывают ее в технологическую карту. Отвечают на вопросы «Да-Нет».
Дают определения раствора, концентрации раствора, способов выражения концентрации раствора, условия быстрого растворения.
| Познавательные: логические – анализ объектов с целью выделения признаков; Коммуникативные: планирование учебного сотрудничества с учителем и сверстниками.
|
| 3 | Постановка учебной задачи (2 мин) | Сформулируйте цель нашего урока. (слайд 6)
| Обучающиеся формулируют цель урока и записывают ее в технологическую карту.
| Регулятивные: целеполагание; Коммуникативные: постановка вопросов; Познавательные: общеучебные –самостоятельное выделение и формулирование познавательной цели. |
| 4 | Построение проекта выхода из затруднения (2 мин) | Определите план ваших действий по решению этой задачи. | Составляют план достижения цели и определяют средства. | Регулятивные: планирование, прогнозирование; Коммуникативные: инициативное сотрудничество в поиске и выборе информации; Познавательные: моделирование, логическое решение проблемы. |
| 5 | Первичное закрепление (2 мин) | Подготовка к практическому решению задач: вспомнить правила техники безопасности при работе в кабинете химии. (слайд 7) Выбрать формулы для расчетов концентрации раствора. (8 слайд)
| Обучающиеся формулируют правила техники безопасности при работе в кабинете химии.
Учащиеся предлагают формулы для расчетов концентрации раствора.
. | Коммуникативные: инициативное сотрудничество в поиске и выборе информации; Регулятивные: самостоятельно анализируют условия достижения цели на основе учета выделенных учителем ориентиров действия; Познавательные: общеучебные – смысловое чтение, поиск и выделение необходимой информации, умение структурировать знания; логические – построение логической цепочки рассуждений, анализ, синтез. |
| 6 | Самостоятельная работа (10 мин) | Организует работу в группах по решению задач 1, 2 и 3 (слайды 9-12)
| Работа обучающихся над решением предложенных задач с помощью эксперимента и запись результатов работы в технологическую карту. | Регулятивные: контроль, оценка, коррекция; Познавательные: общеучебные. |
| 7 | Включение в систему знаний и повторение (15 мин) | Учитель организует деятельность по применению новых знаний, анализирует выполнение обучающимися заданий, корректирует. (слайды 13-18) | Учащиеся по группам демонстрируют результаты решения предложенных им задач 1, 2 и 3. Все ученики записывают результаты в свою технологическую кару. Обучающиеся осуществляют самопроверку заданий. Оценивают результаты своей работы. | Регулятивные: контроль, коррекция, выделение и осознание того, что уже усвоено и что еще подлежит усвоению; Личностные: самоопределение. |
| 8 | Рефлексия деятельности (итог урока) (2 мин) | Организует рефлексию в форме заполнения таблицы и подведения итогов работы на уроке. (слайд19) | Обучающиеся осуществляют поведение итогов работы на уроке в виде формулировки вывода и заполнения рефлексивной карты. | Познавательные: рефлексия Личностные: смыслообразование Коммуникативные: умение с достаточной полнотой и точностью выражать свои мысли. |
| 9 | Домашнее задание (1 мин) | Учитель формулирует задание, комментируя его по необходимости: Определите, какой процентной концентрации чай вы пьете, если учесть массу кусочка рафинада (чайной ложки сахара) равной 4г. Вычислите, какую массу сульфата цинка необходимо взять для получения 10 г раствора глазных капель, применяемых для лечения конъюнктивита, если известно, что массовая доля соли в растворе составляет 0,25%? (слайд 20) Учитель заканчивает урок словами: Чтоб изучить любое вещество: Состав, строение и свойства надо знать. Тогда поймешь любое волшебство И будешь лишь пятерки получать. (слайд 21) | Обучающиеся воспринимают информацию, фиксируют задание. | Регулятивные: определяют последовательность промежуточных целей с учетом конечного результата, составление плана последовательности действий Коммуникативные: поиск и сбор информации. |







 угун
угун

 стройство доменной печи: печь имеет форму усеченного конуса высотой до 80м, диаметром 5-6м, емкостью 5000м3. Ежесуточный выход чугуна – 2000т, годовой – 4млн.т.
стройство доменной печи: печь имеет форму усеченного конуса высотой до 80м, диаметром 5-6м, емкостью 5000м3. Ежесуточный выход чугуна – 2000т, годовой – 4млн.т. 
 руда топливо флюсы воздух
руда топливо флюсы воздух
 пособы производства стали
пособы производства стали




















