Учителя, применяющие презентации в Power Point отмечают, что это приводит к целому ряду положительных эффектов: облегчается процесс усвоения материала, урок обогащается эмоциональной окрашенностью, возрастает уровень наглядности, повышается интерес к предмету, учащиеся легче усваивают учебный материал.
Просмотр содержимого документа
«Опыты Резерфорда. Модели атома»

Строение атома.
Опыты Резерфорда.

«Нет ничего кроме атомов и пустоты.
Все прочее - впечатления»
«атом» греч. - «нерассекаемое», «неразрываемое»
Демокрит
(460-370 гг. до н. э.)

Существует предел деления - атом
Демокрит
(460-370 гг. до н.э.)
Делимость вещества бесконечна
Аристотель
(384-322 гг. до н. э.)

Только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова и других ученых
Михаил Васильевич Ломоносов
(1711 - 1765) русский учёный
была доказана реальность существования атомов.
Лавуазье Антуан Лоран
(1743- 1794) французский химик

В 1897 году
Джозеф Джон Томсон открыл электрон.
Опыты Томсона подтвердили, что электроны входят в состав атомов.
(1856-1940)
английский физик
В 1903 году Томсон впервые предложил модель атома.

Атом – это шар, по всему объёму которого равномерно распределён положительный заряд.
Внутри шара находятся электроны.
Электрический заряд атома в целом равен нулю.
«Пудинг с изюмом»

Модель строения атома, предложенная Томсоном, нуждалась в экспериментальной проверке.
В 1911 г.
Эрнест Резерфорд совместно со своими сотрудниками провёл ряд опытов по исследованию состава и строения атомов.
(1871-1937)
английский физик
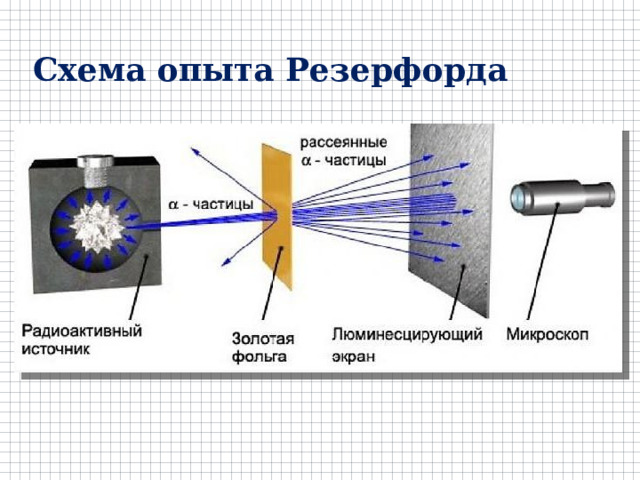
Схема опыта Резерфорда

Сцинтилляции на экране в отсутствие фольги
Сцинтилляции на экране, когда на пути пучка помещена фольга
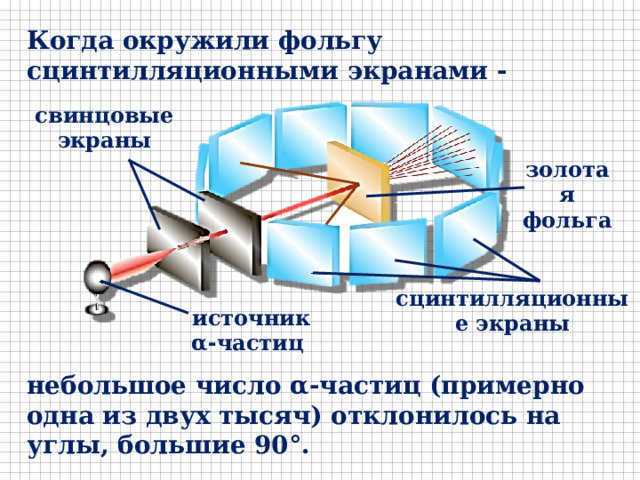
Когда окружили фольгу сцинтилляционными экранами -
свинцовые экраны
золотая фольга
сцинтилляционные экраны
источник 𝛂- частиц
небольшое число α-частиц (примерно одна из двух тысяч) отклонилось на углы, большие 90°.

Резерфорд о рассеянии α-частиц на большие углы: «Это почти столь же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
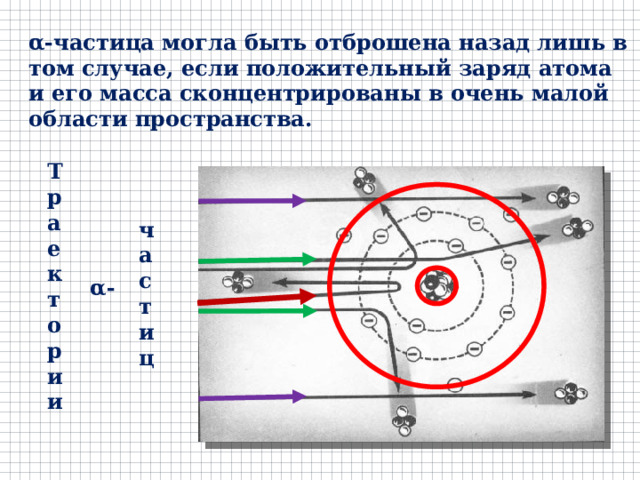
α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства.
Траектории
частиц
α-
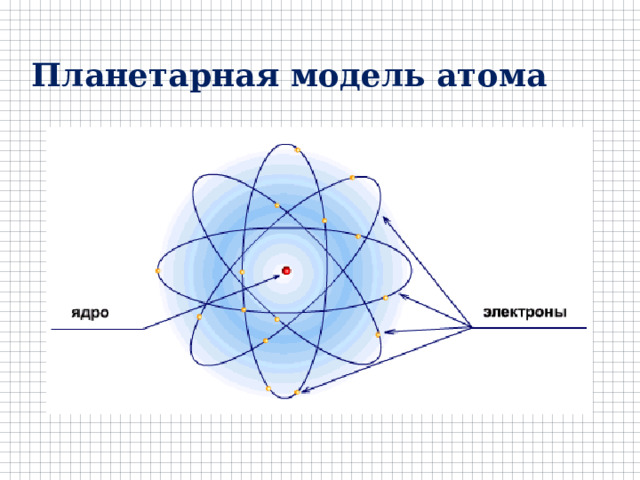
Планетарная модель атома

Протонно-нейтронная модель атомного ядра

Порядковый номер Z элемента в периодической таблице
Д.И. Менделеева – это число электронов в атоме, число протонов в ядре.


Но эта модель
не объясняет устойчивость атома.
Электрон излучает и теряет энергию и должен упасть на ядро.
Атом должен прекратить свое существование.

В микромире свои законы.
В макромире свои законы.
Итак,

Домашнее задание:
- подготовить конспект по материалам презентации
- подготовить ответ на вопрос: «В чем причины устойчивости атома?»












































