

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Органическая химия. Лабораторный практикум
Данная работа содержит лабораторные работы для студентов 2 курса дисциплины "Органическая химия"
Просмотр содержимого документа
«Органическая химия. Лабораторный практикум»
| МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное АВТОНОМНОЕ образовательное учреждение высшего образования «Национальный исследовательский ядерный университет «МИФИ» |
| Московский областной политехнический колледж– филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ» (МОПК НИЯУ МИФИ) |
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
к лабораторным работам по дисциплине
по специальности
среднего профессионального образования
18.02.03 «Химическая технология неорганических веществ»
Электросталь, 2019
Содержание
| 1. | Паспорт программы лабораторного практикума учебной дисциплины «Органическая химия»………………………………………………………… | 4 |
| 1.1. | Область применения программы лабораторного практикума………………... | 4 |
| 1.2. | Место дисциплины в структуре основной профессиональной образовательной программы……………………………………………………. | 4 |
| 1.3. | Цели и задачи лабораторного практикума-требования к результатам освоения лабораторного практикума дисциплины……………………………. | 4 |
| 1.4 | Рекомендуемое количество часов на освоение программы лабораторного практикума дисциплины………………………………………………………… | 6 |
| 2. | Структура и содержание программы лабораторного практикума учебной дисциплины «Органическая химия»…………………………………………… | 7 |
| 2.1. | Объем программы и виды учебной работы……………………………………. | 7 |
| 2.2 | Тематический план и содержание лабораторного практикума учебной дисциплины «Органическая химия»…………………………………………… | 8 |
| 2.3. | Приложение. Методические указания для студентов по выполнению программы лабораторного практикума учебной дисциплины «Органическая химия»……………………………………………………………………………... | 10 |
| 2.3.1 | Введение…………………………………………………………………………... | 10 |
| 2.3.2 | Порядок работы…………………………………………………………………... | 11 |
| 2.3.3 | Меры предосторожности, которые необходимо соблюдать во время проведения практических работ………………………………………………… | 12 |
| 2.3.4 | Простейшие правила первой помощи при несчастных случаях в лаборатории………………………………………………………………………. | 13 |
| 2.4. | Методики выполнения лабораторных работ…………………………………... | 14 |
| 2.4.1 | Лабораторная работа №1. Тема: Качественный анализ органических соединений……………………….. | 14 |
| 2.4.2 | Лабораторная работа 2 Тема: Предельные, непредельные углеводороды……………………………... | 17 |
| 2.4.3 | Лабораторная работа №3 Тема: Спирты, фенол, глицерин…………………………………………………. | 23 |
| 2.4.4 | Лабораторная работа № 4 Тема: Альдегиды…………………………………………………………………. | 31 |
| 2.4.5 | Лабораторная работа №5 Тема: Карбоновые кислоты……………………………………………………... | 34 |
| 2.4.6 | Лабораторная работа №6 Тема: Синтез уксусно-этилового эфира………………………………………… | 37 |
| 2.4.7 | Лабораторная работа №7 Тема: Жиры………………………………………………………………………. | 39 |
| 2.4.8 | Лабораторная работа №8. Тема: Углеводы…………………………………………………………………… | 46 |
| 2.4.9 | Лабораторная работа №9. Тема: Белки……………………………………………………………………….. | 52 |
| 2.5 | Решение расчетных задач……………………………………………………….. | 55 |
| 3. | Условия реализации программы лабораторного практикума учебной дисциплины «Органическая химия»……………………………………………. | 58 |
| 3.1 | Требования к материально-техническому обеспечению………………………. | 58 |
| 3.2 | Информационное обеспечение обучения………………………………………. | 58 |
|
| Основная литература…………………………………………………………….. | 58 |
|
| Дополнительная литература……………………………………………………. | 58 |
Паспорт программы лабораторного практикума учебной дисциплины "Органическая химия"
Область применения программы
Программа лабораторного практикума учебной дисциплины "Органическая химия" является частью основной профессиональной образовательной программы в соответствии с ФГОС по профессии СПО при подготовке квалифицированных рабочих и специалистов среднего звена по специальности 18.02.03 "Химическая технология неорганических веществ", входящей в укрупненную группу 18.00.00 «Химические технологии».
Место дисциплины в структуре основной образовательной программы: дисциплина входит в цикл общепрофессиональных дисциплин.
Цели и задачи лабораторного практикума дисциплины – требования к результатам освоения лабораторного практикума дисциплины:
В результате освоения лабораторного практикума дисциплины "Органическая химия" обучающийся должен:
Знать:
особенности строения органических веществ, их молекулярное строение, валентное состояние атома углерода;
природные источники, способы получения и области применения органических соединений;
углеродный скелет, функциональные группы, изомерию органических соединений, гомологические ряды;
теоретические основы строения органических соединений, номенклатуру и классификацию органических соединений
Уметь:
составлять и изображать структурные полные и сокращенные формулы органических веществ и соединений, принадлежность веществ к разным классам – углеводороды, углеводы, спирты, сложные и простые эфиры, жиры, мыла, анилин, аминокислоты, белки, синтетические волокна, пластмассы;
проводить реакции с органическими веществами в лабораторных условиях;
проводить химический анализ органических веществ и оценивать его результаты;
применять безопасные приемы при работе с органическими веществами, химической посудой и химическими приборами.
самостоятельный поиск химической информации с использованием источников знаний
решать расчетные задачи по химическим формулам и уравнениям
Использовать приобретенные знания и умения в практической деятельности:
для объяснения химических явлений, происходящих в природе, быту и на производстве;
экологически грамотного поведения в окружающей среде;
безопасного обращения с горючими и токсичными веществами.
Программа направлена на формирование у студентов следующих компетенций:
общие компетенции:
ОК1. Понимать сущность и социальную значимость своей будущей профессии и проявлять к ней устойчивый интерес.
ОК2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество;
ОК3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность;
ОК4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития;
ОК5. Использовать информационно-коммуникативные технологии в профессиональной деятельности;
ОК6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями;
ОК7. Брать на себя ответственность за работу членов команды (подчиненных), результат выполнения заданий;
ОК8. Самостоятельно определять задачи профессионального и личностного развития. Заниматься самообразованием, осознанно планировать повышение квалификации;
ОК9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
профессиональные компетенции:
ПК1. Подготавливать к работе технологическое оборудование, инструменты, оснастку.
ПК2. Контролировать и обеспечивать бесперебойную работу оборудования, технологических линий.
ПК3. Выявлять и устранять отклонения от режимов в работе оборудования, коммуникаций.
ПК4. Подготавливать к ремонту и принимать оборудование из ремонта.
ПК5. Проводить анализ сырья, материалов и готовой продукции.
ПК6. Осуществлять обработку и оценку результатов анализов.
ПК7. Получать продукты производства заданного количества и качества.
ПК8. Выполнять требования безопасности производства и охраны труда.
ПК9. Контролировать и регулировать параметры технологических процессов.
ПК10. Применять аппаратно-программные средства для ведения технологических процессов.
ПК11. Анализировать причины брака, разрабатывать мероприятия по их предупреждению и ликвидации.
ПК12. Планировать и организовывать работу подразделения.
ПК13. Участвовать в обеспечении и оценке экономической эффективности работы подразделения.
ПК14. Осуществлять руководство подчиненным персоналом подразделения.
ПК15. Проверять состояние охраны труда и промышленной безопасности на рабочих местах.
ПК16. Обучать безопасным методам труда, правилам технической эксплуатации оборудования.
Рекомендуемое количество часов на освоение программы лабораторного практикума дисциплины:
Максимальная учебная нагрузка обучающегося 18 часов, в том числе обязательная нагрузка 14 часов, самостоятельная работа обучающегося 4 часов.
СТРУКТУРА И СОДЕРЖАНИЕ программы лабораторного практикума УЧЕБНОЙ ДИСЦИПЛИНЫ «Органическая химия»
Объем программы и виды учебной работы
| Вид учебной работы | Количество часов |
| Максимальная нагрузка | 18 |
| Обязательная нагрузка (всего) | 18 |
| Выполнение лабораторных работ | 14 |
| Самостоятельная работа студентов: | 4 |
| в том числе: |
|
| -оформление результатов эксперимента; | 2 |
| -подготовка к зачету лабораторных работ. | 2 |
| Итоговая аттестация в форме зачета |
|
Тематический план и содержание программы лабораторного практикума учебной дисциплины "Органическая химия"
| Наименование тем лабораторных работ. | Содержание лабораторных работ | Объем часов | Уровень усвоения |
| 1.Качественный анализ органических веществ. | Качественное определение углерода, водорода и хлора в органических соединениях. | 2 | 2 |
| 2.Предельные и непредельные углеводороды. | Получение этилена и исследование его свойств. Получение ацетилена и исследование его свойств. Бензол и его свойства. | 2 | 2 |
| 3.Спирты, фенол, глицерин. | Изучение свойств этанола: растворимость, отношение к индикаторам, горение, обнаружение воды в этаноле и его обезвоживание, окисление перманганатом калия, окисление в альдегид оксидом меди, получение диэтилового эфира и его свойства. Изучение свойств фенола: образование и разложение фенолятов, взаимодействие фенола с бромной водой. Изучение свойств глицерина: физические свойства глицерина, образование глицерата меди, дегидратация глицерина. | 2 | 2 |
| 4.Альдегиды. | Окисление альдегидов. Реакция «серебряного зеркала». Реакция «медного зеркала». Качественная реакция на ацетон. | 2 | 2 |
| 5.Карбоновые кислоты. | Взаимодействие уксусной кислоты с карбонатом натрия, с металлическим магнием, оксидом меди (2). Получение солей уксусной и муравьиной кислот. Разложение щавелевой кислоты. Свойства олеиновой кислоты. | 2 | 2 |
| 6.Синтез уксусно-этилового эфира. | Образование этилацетата. | 2 | 2 |
| 7.Свойства жиров. Мыла. | Сравнение растворимости подсолнечного масла в различных растворителях. Доказательство непредельности кислот, входящих в состав подсолнечного масла. Омыление жира водно-спиртовым раствором щелочи. Свойства мылов. Испытание моющих средств индикатором. Исследование свойств моющих средств в жесткой воде.
| 2 | 2 |
| 8.Углеводы. | Реакция глюкозы со щелочным раствором гидроксида меди. Реакция с раствором гидроксида кальция. Окисление глюкозы аммиачным раствором оксида серебра. Изучение свойств крахмала: физических. Взаимодействия с йодом. | 2 | 2 |
| 9.Белки. | Биуретовая реакция, ксантопротеиновая реакция, тепловая денатурация белков, осаждение минеральными кислотами, осаждение солями, осаждение спиртом. Открытие азота в белке. | 2 | 2 |
2.3 Приложение:
Методические указания для студентов по выполнению программы лабораторного практикума учебной дисциплины «Органическая химия».
2.3.1 Введение
Учебный химический эксперимент является важной формой повышения эффективности учебно-познавательной деятельности учащихся.
При изучении органической химии он обретает несколько иной характер, чем при изучении неорганической химии. Ему присущ исследовательский подход. Он более продолжителен, менее ярок. Первые ученические опыты должны представлять собой небольшие работы, требующие воспроизведения опытов, которые демонстрирует учитель.
Постепенно количество опытов для учащихся увеличивается, в их выполнении возникает вариантность, но при этом учащиеся продолжают точно следовать инструкции. В дальнейшем постепенно включаются элементы исследования.
В данной работе представлены разработки лабораторных работ по темам курса органической химии.
Методики лабораторных работ представлены в виде таблиц с конкретными заданиями и вопросами, что существенно облегчает работу студентов и преподавателя. В теоретической части каждой работы представлена главная информация по данной теме, которая потребуется студенту; даны задания для выполнения домашних работ, включающие решение расчетных задач; список вопросов для самостоятельной проверки знаний.
2.3.2 Порядок работы
Лабораторные работы по химии проводятся в специально оборудованном химическом кабинете. Выполнение работ связано с использованием оборудования, химической посуды и реактивов, способных нанести травмы при неумелом обращении.
Поэтому студенты должны с первых дней приучаться к аккуратной и внимательной работе, строгому соблюдению правил техники безопасности.
При работе в химическом кабинете необходимо придерживаться следующих правил:
Работы проводить индивидуально, соблюдать тишину.
Предварительно повторить теоретический материал соответствующей главы и ознакомиться с содержанием практической работы.
Проверить наличие необходимого оборудования и реактивов для данной работы.
Уяснить и точно соблюдать порядок и последовательность операций, указанных в руководстве.
Соблюдать все меры предосторожности, указанные в инструкции или сообщенные предварительно устно.
Внимательно следить за ходом опыта. В случае неудачной постановки опыта,
прежде чем его повторить, следует установить причину; в сомнительных случаях
обращаться к преподавателю.
Все записи наблюдений делать сразу же после окончания опыта в тетради для лабораторных работ.
После окончания работы вымыть использованную посуду и привести рабочее место в порядок.
Сдать реактивы преподавателю.
Отчет о работе должен содержать следующие сведения:
Номер работы.
Название работы.
Краткое описание хода работы с указанием условий проведения опыта.
Наблюдения.
Уравнения протекающих реакций.
Расчеты, таблицы, графики.
Выводы.
Отчет о проделанной работе проверяет преподаватель.
2.3.3 Меры предосторожности, которые необходимо соблюдать во время проведения практических работ
Работая в химической лаборатории, необходимо соблюдать большую осторожность. Помнить, что неаккуратность, невнимательность, недостаточное знакомство с приборами и свойствами химических веществ может повлечь за собой несчастный случай.
Приступать к выполнению задания только после указания преподавателя о начале работы.
Химические реакции выполнять с такими количествами и концентрациями веществ, в такой посуде и приборах, как это указано в соответствующем разделе руководства.
Производить опыты в чистой посуде.
Внимательно прочесть надпись на этикетке, прежде чем взять вещество для опыта.
Все опыты, сопровождающиеся выделением ядовитых, летучих и неприятно пахнущих веществ (например, выпаривание, кипячение растворов кислот, а также растворов, содержащих галогены, аммиак, сероводород и т. п.), проводить только в вытяжном шкафу.
Выполняя опыты с легковоспламеняющимися веществами или кислотами и щелочами, помимо соблюдения всех других мер предосторожности, работать стоя. Поджигать газы и пары можно только после предварительной проверки их на чистоту, так как смесь горючего газа с воздухом взрывается.
Наливая или нагревая реактивы, не наклоняться над сосудом, так как возможно разбрызгивание и даже выброс жидкости. Нагревая пробирки, колбы, стаканы, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
Реактивы не пробовать на вкус, так как большинство из них в той или иной мере ядовиты.
Держать дальше от огня легковоспламеняющиеся вещества: эфир, бензин, спирт, бензол и др. Если воспламенится бензин, спирт или эфир, надо немедленно накрыть пламя асбестом или засыпать песком.
Осторожно пользоваться спиртовками. Спиртовку не зажигать, наклоняя ее к другой горящей спиртовке: гасить спиртовку, накрывая ее сверху колпачком.
В случае возникновения пожара в лаборатории немедленно позвонить в пожарную охрану. До прибытия пожарных гасить огонь песком, огнетушителем и водой.
В случае ожога лица, рук кислотой или щелочью необходимо оказать пострадавшему первую помощь.
2.3.4 Простейшие правила первой помощи при несчастных случаях в лаборатории
При ранении стеклом убедиться в том, что в ранке не осталось стекла, быстро протереть ранку ваткой, смоченной спиртом, смазать йодом и забинтовать.
При горячих (термических) ожогах на обожженное место наложить компресс (без бумаги) из концентрированного раствора перманганата или смазать это место мазью от ожогов. Если под рукой нет перманганата и мази, рекомендуется присыпать обожженное место двууглекислой (питьевой) содой и приложить бинт, смоченный холодной водой.
3. В случае ожога лица, рук кислотой или щелочью немедленно обмыть пораженное место большим количеством воды (мыть под краном минут пять), а затем:
при ожоге кислотами обмыть 2% - раствором питьевой соды или слабым раствором нашатырного спирта;
при ожоге щелочами обмыть 1 % - раствором уксусной или лимонной кислоты. В обоих случаях после наложить компресс из бинта, смоченного спиртом.
При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды, а затем:
при попадании кислоты промыть разбавленным раствором питьевой соды;
при попадании щелочи промыть 1% раствором борной кислоты.
Если необходимо, то пострадавшего после оказания первой помощи немедленно доставить в медпункт или в поликлинику.
После ознакомления с правилами техники безопасности при работе в химической лаборатории каждый студент должен расписаться в специальной книге или журнале.
Перед проведением очередного занятия в лаборатории преподаватель должен повторить указания о мерах предосторожности, которые необходимо соблюдать при использовании в данных опытах тех или иных реактивов (концентрированных серной и азотной кислот, хлора, фенола, едких щелочей и др.).
2.4 Методики выполнения лабораторных работ:
2.4.1 Лабораторная работа № 1.
Тема: Качественный анализ органических соединений.
Качественное определение углерода, водорода и хлора в органических соединениях.
Теоретическая часть.
Для того чтобы понять сущность работы, надо знать, безводный сульфат меди СиS04 — вещество белого цвета, а при взаимодействии с водой приобретает голубую окраску
СиS04+5Н20 = СиS04*5Н20 белый голубой
Известковая вода Са(ОН)2 под действием оксида углерода (IV) (углекислого газа) С02 мутнеет вследствие образования нерастворимого карбоната кальция СаСОз
Са(ОН)2 + С02 = СаСОз↓S04 + Н20
Пары хлорида меди (II) СиС12 окрашивают пламя в зеленый цвет.
Запомни: Пользуясь прибором, не забывайте вынуть конец газоотводной трубки из раствора известковой воды, прежде чем прекратить нагревание!
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы
Назовите общую формулу алканов.
Какие углеводороды являются гомологами метана?
Напишите молекулярные формулы алканов: пропан, гексан, октан.
Составте структурные формулы изомеров пентана и назовите их.
Практическая часть
Цель: Научиться определять качественный состав углеводородов.
Оборудование и реактивы
Пробирки, вата, газоотводная трубка, резиновая пробка медная проволока, тигельные щипцы, горелка, спички штатив. Парафин, оксид меди (II) СиО, медный купорос СиS04, известковая вода, Са(ОН)2, хлороформ СС14
Опыт 1. Определение углерода и водород в органических веществах
Цель опыта: установить, содержатся ли в составе выданного вам образца органического вещества — парафина — углерод и водород. Соберите прибор, как показано на рисунке. Для опыта возьмите маленькие пробирки. Приготовьте смесь из хорошо растертого парафина и порошкообразного (или гранулированного) оксида меди (II), взятого в избытке. Поместите смесь в пробирку слоем 0,5 см. У отверстия пробирки поместите рыхлый комочек ваты с нанесенным на нее безводным сульфатом меди СиS04. Вставьте в пробирку пробку с газоотводной трубкой (2), конец пробирку (3) с известковой водой (0.5 мл), которой опустите в другую. Прибор укрепите в штативе, как показано на рисунке, и подогрейте смесь в пробирке 1. Когда вы придете к заключению, что реакция окончилась, выньте из известковой воды конец газоотводной трубки и после этого прекратите нагревание.
Рис. Определение углерода и водорода в органическом веществе
1 — пробирка;
2 — газоотводная трубка;
3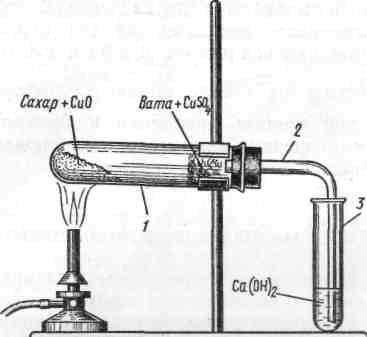 — пробирка с известковой водой
— пробирка с известковой водой
Дайте прибору остыть, после чего разберите его и рассмотрите результаты реакции, отметив, произошли ли изменения с сахаром, оксидом меди (II), с сульфатом меди (II) и с известковой водой? Опишите и объясните причину этих изменений. Составьте уравнения реакций.
Сделайте вывод, свидетельствуют ли прошедшие реакции о том, что в состав парафина входят углерод и водород и почему.
Опыт 2. Определение хлора в органическом веществе
Цель опыта — исследовать, содержится ли в выданном образце органического вещества ХЛОР. Прокалите в пламени горелки медную проволоку, держа ее тигельными щипцами, до тех пор, пока перестанет окрашиваться пламя. Дайте ей остыть. Поместите на стекло каплю хлороформа, прикоснитесь к ней концом проволоки и быстро внесите снова в пламя горелки, внимательно наблюдая за её окраской. Объясните свои наблюдения.
Результаты работы оформите в тетради
Оборудование и реактивы: Штатив с пробирками, прибор для определения элементов в веществе, спиртовка, спички, парафин, оксид меди (П), известковая вода, безводный сульфат меди, тетрахлорметан, медная проволока.
Ход работы:
| Название опыта | Исходные вещества | Условия реакции | Признаки реакции | Уравнение реакции | Вывод |
| Качественное определение углерода | Парафин, оксид меди, известковая вода | Парафин нагреваем и образующие газы пропускаем через известковую воду |
|
|
|
| Качественное определение водорода | Парафин, безводный сульфат меди | Нагреваем парафин, пары воды проходят над безводным сульфатом меди |
|
|
|
| Качественное определение хлора | Тетрахлорметан, медная проволока | Нагреваем смоченную в хлорметане медную проволоку пламенем спиртовки |
|
|
|
2.4.2 Лабораторная работа №2.
Тема: Предельные и непредельные углеводороды.
Получение этилена и опыты с ним
Теоретическая часть
Углеводороды ряда этилена химически активны, природа не дает нам их в готовом виде. Подумайте, что могло бы произойти с этими веществами, если бы они содержались, например, природном газе или нефти, залегающих в земных недрах под большим давлением.
промышленности эти углеводороды получают при переработке нефтепродуктов путем высокотемпературного разложения, дегидрирования предельных углеводородов.
лаборатории непредельные углеводороды получают различными способами. Например, этилен получают из этилового спирта, отнимая от него элементы воды при нагревании с серной кислотой (каталитическая дегидротация), т.е. осуществляя процесс, обратный промышленному получению спирта из этилена:
С2Н5ОН → С2Н4↑ + Н2О
Это интересно:
Впервые этилен был получен в 1669 г немецким химиком Иоганном Иохимом Бехером нагреванием этилового спирта с концентрированной серной кислотой. Бехер впервые применил химический катализатор в процессе реакции (до этого в научной практике применялись только биологические катализаторы – ферменты). Этилен более 100 лет после его открытия не имел собственного названия. В конце 18 века, что при взаимодействии с хлором «газ Бехера» превращается в маслянистую жидкость, и его назвали олефином, что значит рождающий масло. Затем это название распространилось на все углеводороды, имеющие строение, подобное этилену.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Дайте определения следующим понятиям:
Непредельные углеводороды
Алкены
σ-связь
π- связь
Назовите общую формулу алкенов, тип гибридизации атомов углерода в молекуле этилена, угол между гибридными орбиталями.
Какой тип реакций характерен для непредельных углеводородов?
Какие виды изомерии характерны для непредельных углеводородов?
Нахождение непредельных углеводородов в природе.
Применение непредельных углеводородов.
Сформулируйте правило Марковникова. Приведите пример реакции, идущей по данному правилу.
Сформулируйте правило Зайцева. Приведите пример реакции, идущей по данному правилу.
Практическая часть.
Цель: Изучить способы получения и химические свойства этилена, сформировать навыки проведения лабораторных опытов.
Оборудование и реактивы: Пробирки, колба, спиртовка, газоотводная трубка, спички, штатив; этиловый спирт, серная кислота, песок, бромная вода, раствор перманганата калия.
Проведите опыты, результаты внесите в таблицу, сделайте вывод о химических свойствах этилена.
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
| Опыт 1 Получение этилена | |||
| В пробирку наливают этиловый спирт и серную кислоту. Закрывают пробкой с газоотводной трубкой. Пробирку нагревают. | Что наблюдается? | Составьте уравнение реакции разложения этилового спирта | Какое вещество получили? Укажите тип реакции. Какую роль играет серная кислота в данном процессе? |
| Опыт 2 Взаимодействие этилена с бромной водой | |||
| Пропускают выделяющийся газ через бромную воду. | Что наблюдается? | Составьте уравнение реакции взаимодействия этилена с бромом | Назовите данную реакцию, укажите ее тип. |
| Опыт 3 Взаимодействие этилена с раствором перманганата калия | |||
| Пропускают выделяющийся газ через раствор перманганата калия. | Что наблюдается? | Составьте уравнение реакции взаимодействия этилена с перманганатом калия | Назовите данную реакцию, укажите ее тип. |
| Опыт 4 Горение этилена | |||
| Поджигают выделяющийся газ у конца газоотводной трубки. | Горит ли этилен? Укажите цвет пламени. | Составьте уравнение реакции горения этилена | На присутствие какого элемента, указывает характер горения этилена? Сравните содержание этого элемента в этилене и в метане. |

Вывод: Доказали с помощью проведенных опытов… Выполнить задания и сдать преподавателю на проверку.
Получение ацетилена и опыты с ним.
Теоретическая часть
Особенностью строения молекулы ацетилена состоит в том, что между атомами углерода имеется тройная связь. Ацетилен является родоначальником гомологического ряда алкинов. Ацетилен – это бесцветный газ без запаха, малорастворим в воде. Ацетилен на воздухе горит коптящим пламенем из-за высокого содержания углерода в его молекуле, поэтому для сжигания ацетилена используют кислород. Температура ацетилено-кислородного пламени достигает 32000С. Таким пламенем можно резать и сваривать металлы. Как и все непридельные соединения, ацетилен вступает в реакции присоединения: галогенов, водорода, галогеноводородов, воды .В результате реакции взаимодействия ацетилена с хлороводородом образуется хлорэтен (винилхлорид), который является исходным сырьём для получения полимера – поливинилхлорида.
Это интересно:
Э. Дави впервые получил ацетилен карбидным способом в 1836 г. При действии воды на карбид кальция.
В 1868 г. М. Бертло, пропуская через метан электрический разряд, обнаружил в смеси образующихся газов ацетилен.
2СН4 = С2Н2 + 3Н2 Пиролиз метана используют для промышленного получения ацетилена с 1936 г.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы
1.Назовите способы получения ацетилена.
Назовите две качественные реакции, с помощью которых можно обнаружить непредельные органические соединения.
Записать формулы изомеров 3-метилпентина-1. Дать названия всем соединениям.
Запишите уравнения реакций, с помощью которых можно осуществить превращения:
СН4--------С2Н2--------СН3-СНО
Практическая часть.
Цель: Изучить способы получения и химические свойства алкинов, сформировать навыки проведения лабораторных опытов.
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
|
| Опыт1 Получение ацетилена и его горение. | ||||
| В пробирку поместить кусочек карбида, прилить 1 мл воды и сразу закрыть пробкой с газоотводной трубкой. Выделяющийся ацетилен поджечь у конца трубки и наблюдать за характером пламени. Внести в пламя фарфоровую чашку. | Что наблюдается? | Написать уравнение реакции получения ацетилена из карбида кальция и реакцию горения ацетилена | Объяснить, почему образуется черное пятно сажи. |
|
| Опыт 2 Окисление ацетилена раствором перманганата калия | ||||
| В пробирку налить 5 капель 1% раствора перманганата калия, 5 капель 10% раствора карбоната натрия. Через полученный раствор пропустить ацетилен. | Что наблюдается? | Наблюдаемые изменения подтвердить уравнением реакции. | Назовите данную реакцию, укажите ее тип. |
|
| Опыт 3 Получение ацетиленида серебра | ||||
| В пробирку налить 5 капель 1% раствора нитрата серебра, а затем по каплям, 5% раствор аммиака до полного растворения образующегося вначале осадка оксида серебра. Через полученный бесцветный раствор пропустить ацетилен. | Какие изменения происходят с раствором? | Написать уравнения протекающих реакций | Назовите данную реакцию, укажите ее тип. |
|
Оборудование и реактивы: штатив с пробирками, держатель, спиртовка, газоотводная трубка, фарфоровая чашка, карбид кальция, карбонат натрия, раствор перманганата калия, раствор нитрата серебра, раствор аммиака.
Проведите опыты, результаты внесите в таблицу, сделайте вывод о химических свойствах ацетилена.
Вывод: Доказали с помощью проведенных опытов… Выполнить задания и сдать преподавателю на проверку.
2.4.3 Лабораторная работа №3.
Тема: Спирты, фенол. Глицерин.
Изучение свойств этилового спирта, глицерина, фенола.
Теоретическая часть.
Этиловый спирт С 2Н 5ОН-бесцветная жидкость со своеобразным запахом, легче воды ρ=0,8г/см3, кипит при t-78,30С, хорошо растворим в воде и сам является растворителем многих неорганических и органических веществ. Этанол – ядовитое наркотическое вещество. Спирт легко воспламеняется и горит синеватым почти не светящимся пламенем. Также спирт реагирует со щелочными металлами с образованием алкоголятов
2С2H5OH + 2Na = 2C2H5ONa +H2
Этанол вступает в реакцию дегидратации ( ВНУТРИМАЛЕКУЛЯРНАЯ):
С2Н5ОН→С2Н4↑ + Н2О Межмолекулярная дегидратация:
С2Н5ОН + НОС2Н5 = С2Н5-О-С2Н5 + Н2О Оксид меди (2) окисляет спирт в альдегид:
С2Н5ОН + СuО = СН3-СНО + Н2О + СuС карбоновыми кислотами спирт образует сложные эфиры:
СН3-СООН + С2Н5ОН = СН3-СОО-С2Н5
Это интересно:
Этиловый спирт относится к ксенобиотикам – веществам, не содержащимся в человеческом организме, но влияющим на его жизнедеятельность. Как будет влиять на организм спирт, зависит от дозы. Известно дезинфицирующее и антибактериальное действие этанола, его влияние на действие человека. Но чрезмерное его потребление вызывает нарушение психики, разрушение внутренних органов и даже смерть. Алкогольные напитки могут на время улучшить самочувствие человека. Они помогают на время справиться со стрессом и расслабиться, привести в радостное состояние, снять напряжение, волнение. Все эти эффекты связаны с тем, что спирт подавляет активность центральной и периферической нервной системы, что сопровождается кратковременными эффектами: снижается острота зрения, замедляется речь, уменьшается способность здраво рассуждать. Именно из-за этого существует запрет на употребление алкоголя водителями.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы
1.Какие вещества называют спиртами?
2.Какие свойства предельных одноатомных спиртов определяются наличием в их молекуле гидроксильной функциональной группы?
3. Какие свойства этанола лежат в основе его применения?
Практическая часть
Цель: Изучить свойства спирта, выявить качественные реакции на спирты, сформировать умение составлять уравнения реакций с участием спиртов.
Оборудование и реактивы: штатив с пробирками, спиртовка, газоотводная трубка, медная проволока, этанол, индикаторная бумага, безводный сульфат меди, раствор фенолфталеина, серная кислота (конц.), перманганат калия.
Проведите опыты, результаты внесите в таблицу, сделайте вывод о химических свойствах спирта.
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
| Опыт1 Свойства этилового спирта | |||
| В пробирку налей те 5 мл этилового спирта и рассмотрите цвет, осторожно понюхайте. В другую пробирку прилейте несколько капель выданного спирта и с помощью пипетки добавьте 2 мл дистиллированной воды, содержимое встряхните. На фильтровальную бумагу капните одну каплю воды, а чуть поодаль одну каплю этилового спирта | Что наблюдается? Что испарилось быстрее? | | Сделать вывод |
| Опыт 2 Растворимость спиртов, их отношение к индикаторам, горение. | |||
| В пробирку налейте 5 капель этанола. Определите запах. Добавьте 0,5 мл воды и Встряхните полученную смесь, визуально оцените растворимость спирта в воде. В одну пробирку налейте 2 мл дистиллированной воды, а во вторую 2 мл этилового спирта. В каждую пробирку добавили по 3 капли подсолнечного масла, содержимое каждой пробирки тщательно перемешайте. Из пробирки стеклянной палочкой нанесите 1 каплю на лакмусовую бумагу, а в пробирку добавьте раствор фенолфталеина. В фарфоровую чашку налить 0,5 мл спирта. Поджечь спирт лучинкой. | Что наблюдается? Изменяется ли цвет индикаторов? Определите процентное содержание углерода в эталоне | Напишите уравнение горения спирта и реакцию получения диэтилового эфира | Объясните увиденное явление |
| Опыт 3 Обнаружение воды в этиловом спирте и его обезвоживание | |||
| В сухую пробирку насыпать 0,1-2 г. безводного сульфата меди, добавить 10 капель спирта, взбалтывать и осторожно нагревать до кипения. | Какие изменения происходят с раствором? | Написать уравнения протекающих реакций | Почему нельзя удалить воду из этилового спирта перегонкой? |
| Опыт 4 Получение диэтилового эфира и его свойства. | |||
| В сухую пробирку налейте 0,5 мл смеси этилового спирта и концентрированной серной кислоты (1:1) и нагрейте до начала кипения (не кипятить!). К горячей смеси прилить по стенке пробирки 5-10 капель этилового спирта. Пробирку закрыть пробкой с прямой газоотводной трубкой, пробирку осторожно нагревают и поджигают выделяющийся из трубки эфир | Что наблюдается? Какое пламя вы наблюдаете? | Напишите уравнение реакции получения диэтилового эфира. | Как обнаруживается диэтиловый эфир? |
| Опыт 5 Получение уксусного альдегида. | |||
| На пламени спиртовки накалите свернутую в спираль медную проволоку до появления черного налета оксида меди (2) и внесите ее в пробирку с этиловым спиртом. Повторите 5 раз. Осторожно понюхайте, направляя поток воздуха к себе рукой. | Что наблюдаете? Что происходит с медной спиралью? | Запишите уравнение реакции С 2Н5ОН + CuO = С2Н5НО + Cu + Н О | |
| Опыт 6 Окисление этилового спирта перманганатом калия | |||
| В пробирку налейте 1-2 мл этилового спирта, добавьте 1 мл водного раствора перманганата калия и нагрейте на слабом пламени спиртовки. | Что наблюдаете? | Запишите уравнение реакции 3СН-СН-ОН + 2КМпО = 3СН-СНО + 2МпО + 2КОН + 2Н2О | |
Результаты работы оформить в тетради.
Изучение свойств многоатомных спиртов на примере глицерина.
Теоретическая часть
Глицерин - это представитель трехатомных спиртов. Он неограниченно растворим в воде, очень гигроскопичен, не ядовит. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счёт поглощения влаги из воздуха. Это свойство широко используется в парфюмерной промышленности. Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков, при производстве пластмасс, в кожевенном производстве и текстильной промышленности, а также для изготовления взрывчатых веществ. Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди(2), который растворяется с образованием ярко-синего раствора.
Это интересно:
Глицерин открыл шведский химик Карл Шееле в 1779 г. Нагревая оливковое масло с кислотой, он выделил маслянистую жидкость, сладкую на вкус. Новое вещество назвали глицерин (от греческого – сладкий). В 1846 г итальянский химик Асканьо Собреро нагрел глицерин со смесью серной и азотной кислот и получил вещество, которое взрывалось с огромной силой. Так был открыт сложный эфир глицерина и азотной кислоты – нитроглицерин (тринитрат глицерина). Вещество пробовали применять в военном деле, но оно взрывались раньше, чем это требовалось. Укротить нитроглицерин удалось шведскому инженеру-химику, изобретателю и промышленнику Альфреду Нобелю. В 1866 г ученый обнаружил, что пропитанная нитроглицерином инфузорная земля (кизельгур) безопасна при хранении и транспортировке, но сохраняет свои взрывчатые свойства. Так был изобретен динамит.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы
Какие свойства глицерина лежат в основе его применения?
В трех пробирках находятся бесцветные жидкости: вода, этанол и раствор глицерина. Как их распознать?
Запишите уравнения реакций. С помощью которых можно осуществить превращения: этилен--------этанол--------этаналь
Практическая часть
Цель: Изучить свойства многоатомных спиртов на примере глицерина. Выявить качественную реакцию на многоатомные спирты, сформировать умение составлять уравнения химических реакций.
Оборудование и реактивы: штатив с пробирками, спиртовка, глицерин, медный купорос, раствор гидроксида натрия, гидросульфат бария.
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
| Опыт1 Физические свойства глицерина. | |||
| Налейте в пробирку 2 мл глицерина. Рассмотрите, что из себя представляет это вещество. Добавьте столько же по объему воды и взболтайте. Добавьте еще 5 мл глицерина. | Какие изменения происходят с раствором? | | Что можно сказать о растворимости глицерина в воде. Опишите физические свойства глицерина. |
| Опыт 2 Образование глицерата меди. | |||
| В пробирку налить 3-4 капли 2% раствора сульфата меди и 2 мл 10% водного раствора гидроксида натрия. К образовавшемуся голубому осадку приливаем 2-3 капли глицерина и смесь встряхиваем. | Какие изменения происходят с раствором? | Напишите уравнение реакции образования глицерата меди. | Назовите данную реакцию. Укажите ее тип. |
| Опыт 3 Дегидратация глицерина. | |||
| В сухую пробирку насыпать гидросульфат калия на высоту 1 см, смочить его 2-3 каплями глицерина и смесь сильно нагреть. Нюхать осторожно! | Что наблюдается? | Напишите схему реакции дегидратации глицерина. | Назовите данную реакцию. Укажите ее тип. |

Изучение свойств фенола
Теоретическая часть
Фенол (карболовая кислота) – бесцветное, кристаллическое вещество с резким запахом. Темп. плав. = 42,3 С, темп. кип.= 182 С0, частично растворим в воде, обладает сильными антисептическими свойствами, ядовит, на коже образует ожоги.
По химическим свойствам фенол отличается от спиртов. Это различие вызвано взаимным влиянием – ОН группы и бензольного ядра (С6Н5 – фенил)
Фенол ядовит! Поэтому ни в коем случае не выливайте продукты реакции фенола в раковину. Содержимое пробирок вылейте в специальную банку с надписью: «Остатки фенола».
Это интересно:
При производстве и промышленном использовании фенола очень важной проблемой является охрана природы от промышленных отходов, содержащих фенол, представляющих большую опасность для животных и растительных организмов. Применить микробиологическую очистку, как при нефтепереработке, в этом случае нельзя, т.к. фенол, обладая бактерицидным действием, убивает микроорганизмы. Поэтому применяют другие методы: газы, содержащие фенол, подвергают каталитическому окислению, сточные воды обрабатывают озоном, извлекают фенол растворителями. Подумайте, может быть что-то предложите и вы?
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Что такое фенолы?
Почему по химическим свойствам фенолы отличаются от простых спиртов?
Какие реакции фенолов обусловлены – ОН группой?
Какие реакции фенолов обусловлены бензольным ядром?
Качественная реакция на фенол.
Практическая часть.
Цель: изучить способы получения и химические свойства фенола, выявить качественные реакции на фенол. Сформировать умение составлять уравнения реакций с участием фенола.
Оборудование и реактивы: Пробирки, пипетки; раствор фенола, раствор гидроксида натрия, фенолфталеин, серная кислота, бромная вода.
Проведите опыты, результаты занесите в таблицу, сделайте выводы о химических свойствах фенола.
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
|
| Опыт1Образование и разложение фенолятов |
| |
| В пробирку наливают | Что наблюдается? | Составьте уравнение | Какое вещество |
| раствор гидроксида |
| реакции взаимодействия | получили? Укажите тип |
| натрия, фенолфталеин. |
| между фенолом и | реакции. Какой вывод |
| Добавляют по каплям |
| гидроксидом натрия | можно сделать о |
| раствор фенола, |
| (назовите основной | свойствах фенола? |
| взбалтывая содержимое |
| продукт реакции). | Какое вещество |
| пробирки. |
| Составьте уравнение | получили? Укажите тип |
| К полученному раствору |
| реакции взаимодействия | реакции. |
| приливают по каплям |
| между фенолятом натрия |
|
| серную кислоту. |
| и серной кислотой |
|
|
|
| (назовите основной |
|
|
|
| продукт реакции). |
|
|
| Опыт 2 Взаимодействие фенола с бромной водой |
| |
| В пробирку наливают | Что наблюдается? | Составьте уравнение | Какое вещество |
| раствор фенола и по |
| реакции взаимодействия | получили? Назовите |
| каплям приливают |
| фенола с бромом | данную реакцию, укажите |
| бромную воду. |
| (назовите основной | ее тип. В какие положения |
|
|
| продукт реакции). | бензольного кольца идет |
|
|
|
| замещение атомов |
|
|
|
| водорода? |
2.4.4 Лабораторная работа №4
Тема: Альдегиды
Свойства альдегидов
Теоретическая часть
Альдегиды – органические соединения, молекулы которых содержат
карбонильную группу, связанную с атомом водорода и углеводородным радикалом. Родоначальник гомологического ряда – формальдегид, или метаналь, муравьиный альдегид.
Формальдегид – бесцветный газ с резким запахом, хорошо растворим в воде, очень ядовит. Его используют для производства фенолоформальдегидных пластмасс, лекарственных препаратов (уротропина). Спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Раствор формальдегида в воде называют формалином, его используют для хранения биопрепаратов, протравливания семян перед посевом, дубления кож.
Уксусный альдегид (этаналь) – летучая жидкость, хорошо растворимая в воде, с характерным запахом. Уксусный альдегид, можно получить из этанола или ацетилена. Основное количество получаемого в промышленности ацетальдегида используется для производства уксусной кислоты, а также различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Альдегиды — химически активные вещества. Их особая активность обусловлена наличием функциональной карбонильной группы. Они легко окисляются в соответствующие карбоновые кислоты, участвуют в реакциях присоединения и конденсации и поликонденсации.
Для изучения качественных реакций этой группы их нужно проделывать очень тщательно, чтобы наблюдать должный эффект.
Это интересно:
В 1782 году К. Шееле, окисляя этиловый спирт оксидом марганца(4) в серной кислоте, заметил, что помимо основного продукта – уксусной кислоты – образовалось еще какое-то резко пахнущее вещество, выделить которое не удалось. В 1835 году Ю.Либих выделил чистое вещество и установил его состав С2Н 4О и назвал его безводородный алкоголь или альдегид. В 1868 году немецкий химик Август Вильгельм Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество метаналь.
В 50-х гг. 19 века А.М. Бутлеров при действии на формальдегид аммиаком получил вещество – гексаметилентетрамин или уротропин. При нагревании в присутствии кислот уротропин разлагается на аммиак и формальдегид. Это свойство позволяет использовать его в медицине в качестве антисептического средства. В организме он медленно гидролизуется, выделяющийся формальдегид уничтожает болезнетворные микроорганизмы.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Какие вещества называются альдегидами?
Охарактеризуйте свойства формальдегида?
Запишите уравнения реакций, с помощью которых можно осуществить превращения:
А) уксусный альдегид→этанол→этилен→ацетилен→ уксусный альдегид Б) углерод→метан→ метанол→формальдегид→муравьиная кислота
Напишите структурную формулу альдегида и составьте для него по два изомера и гомолога.
1 вариант: 2, 3 диметилбутаналь.
2 вариант: 2 метил, пентаналь
Практическая часть Цель: Изучить способы получения и химические свойства альдегидов, выявить качественные реакции на альдегиды. Сформировать умения составлять уравнения реакции с участием альдегидов.
Приборы и реактивы: штатив с пробирками, держатель, спиртовка, медная проволока; аммиачный раствор оксида серебра; растворы сульфата меди, гидроксида натрия, формалин, этиловый спирт.
Опыт 1. Окисление спирта в альдегид.
Цель опыта: изучить лабораторный способ получения альдегидов окислением спиртов оксидом меди.
Поместите в пробирку 4 капли этилового спирта и погрузите в нее прокаленную медную спираль, покрытую черным налетом оксида меди. Черная поверхность спирали становится золотистой вследствие восстановления оксида меди и появляется запах альдегида. Опыт повторите несколько раз и запишите наблюдения. Напишите уравнения реакций, происходящих при прокаливании меди, окислении этилового спирта оксидом меди (в структурной форме). Назовите полученные вещества.
Опыт 2. Окисление альдегида. Реакция «серебряного зеркала.
Цель о п ы т а — провести восстановление серебра альдегидом, добиваясь образования устойчивого серебряного слоя на стенке пробирки.
Взболтайте и осторожно нагрейте смесь, вращая пробирку в пламени горелки (лучше нагревать смесь, держа пробирку в стакане с кипящей водой или в водяной бане). Отметьте образование блестящего зеркального налета на стенках пробирки. Наблюдайте образование на стенках пробирки блестящего слоя серебра.
Реакция «серебряного зеркала» — характерная реакция на альдегиды.
Объясните происходящие явления и составьте уравнение реакции восстановления формалином оксида серебра. Почему реакция называется реакцией «серебряного зеркала»?
Опыт 3. Окисление альдегида гидроксидом меди (II). Реакция «медного зеркала».
Цель опыта: восстановить гидроксид меди (II) формальдегидом и сравнить данный процесс с реакцией «серебряного зеркала».
Внесите в пробирку 4 капли раствора гидроксида натрия и 2 капли раствора сульфата меди (II).
К выпавшему осадку гидроксида меди (II) прибавьте 3-4 капли формалина, взболтайте и смесь нагрейте. Наблюдайте образование желтого осадка Сu(ОН) (I), переходящего в красный оксид меди(I) Сu20. Запишите наблюдения.
Напишите уравнения реакций взаимодействия муравьиного альдегида с оксидом серебра и гидроксидом меди (II) с использованием структурных формул органических веществ. Назовите полученные вещества.
Результаты работы оформите в тетради
Цель работы:
Ход работы:
| Название опыта | Исходные вещества | Условия реакции Признаки реакции | Уравнение реакции |
| Окисление спирта в альдегид | Этиловый спирт, медная проволока, спиртовка | Нагревание |
|
| Окисление альдегида. Реакция «серебряного зеркала» | Формальдегид, аммиачный раствор оксида серебра | Нагревание |
|
| Окисление альдегида гидроксидом меди (II). Реакция «медного зеркала». | Формальдегид, сульфат меди, гидроксид натрия. | Нагревание |
|

Вывод: Доказали с помощью проведенных опытов…
2.4.5 Лабораторная работа № 5.
Тема: Карбоновые кислоты.
Изучение свойств карбоновых кислот (уксусной кислоты)
Теоретическая часть
Карбоновые кислоты – это органические вещества, в состав которых входит карбоксильная группа – СООН, связанная с углеводородным радикалом.
Класс карбоновых кислот очень разнообразен. Начинает гомологический ряд муравьиная кислота или метановая (НСООН). Муравьиная кислота – это жидкость с резким запахом, хорошо растворимая в воде, ядовита, при попадании на кожу вызывает ожоги .Жалящая жидкость, выделяемая муравьями, крапивой, некоторыми видами медуз, содержит эту кислоту.
Второй представитель гомологического ряда - уксусная кислота, бесцветная жидкость с характерным запахом, смешивается с водой в любых соотношениях.
Уксусная кислота часто встречается в растениях, в выделениях животных, образуется при окислении органических веществ. Из всех карбоновых кислот она имеет самое широкое применение. Всем известно использование водного раствора уксусной кислоты – уксуса в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
Путем различных реакций солеобразования получают соли уксусной кислоты – ацетаты. Уксусная кислота используется для получения искусственных волокон, пластмасс на основе целлюлозы, производства красителей (индиго), медикаментов (аспирин), ядохимикатов, органического стекла. Сама кислота и её эфиры являются хорошими растворителями.
Уксусная кислота используется в производстве ацетатного волокна, при синтезе красителей (напр. Индиго), лекарственных веществ (например, Аспирина).
Домашнее задание: «Удаляем пятна ржавчины»
Ржавым гвоздем сделайте пятно на кусочке белой ткани и опустите ее в горячий раствор уксуса. Потом, промойте ткань 2-3 раза водой. Пятно исчезнет.
Это интересно:

В состав ржавчины входит гидроксид железа (3), который реагирует с кислотой. Ведь столовый уксус – разбавленная уксусная кислота.
Домашнее задание: «В лимоне, яблоке и щавеле тоже есть кислота»
Капните соком лимона, яблока, щавеля на лакмусовую бумагу. Она станет красной.
Это интересно:

Потому лимон такой кислый, что в нем есть кислота – лимонная. В яблоке содержится яблочная кислота. Кислота, которая содержится в щавеле, называется щавелевая, она содержится еще и в листьях клевера. В вине содержится винная кислота.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Что такое карбоновые кислоты?
Как называется функциональная группа карбоновых кислот?
Какие виды изомерии характерны для карбоновых кислот?
Как диссоциируют в водном растворе карбоновые кислоты? Какова их сила?
Почему муравьиная кислота вступает в реакцию «серебряного зеркала»?
Практическая часть
Цель: Изучить свойства уксусной кислоты. Сформировать умение составлять уравнения реакций с участием карбоновых кислот.
Оборудование и реактивы: пробирки, спиртовки, держатели, спички; уксусная кислота, раствор карбоната натрия, металлический магний, оксид меди (2), раствор ацетата натрия, раствор хлорида железа (3)
| Что делали | Признаки реакции |
| Реакция |
| Выводы |
|
|
|
|
|
|
|
|
| Опыт 1 Взаимодействие СН3СООН с Na2C03 |
| |||
| В пробирку насыпают 1- | Что наблюдается? |
| Составьте уравнение |
| Какое вещество |
| 2 г карбоната натрия и |
|
| реакции |
| получили? Какой газ |
| добавляют 1 мл |
|
| взаимодействия |
| выделился и почему? |
| уксусной кислоты. |
|
| уксусной кислоты и |
|
|
|
|
|
| карбоната натрия |
|
|
|
|
|
| (назовите основной |
|
|
|
|
|
| продукт реакции). |
|
|
| Опыт2 Взаимодействие СН3СООН с металлическим магнием | |||||
| К 1-2 мл уксусной | Что наблюдается? |
| Составьте уравнение |
| Какие соединения |
| кислоты добавляют 0,1- | Горит ли |
| реакции взаимодействия |
| образуются |
| 0.2 г металлического | выделяющийся |
| уксусной кислоты с |
| при взаимодействии |
| магния. Поджигают | газ? |
| магнием (назовите |
| карбоновых |
| выделяющийся газ. |
|
| основной продукт |
| кислот с металлами? |
|
|
|
| реакции). |
|
|
|
| Опыт 3 Взаимодействие СН3СООН с оксидом меди( II) |
| |||
| К 1-2 мл уксусной | Что наблюдается? |
| Составьте уравнение |
| Какие соединения |

| кислоты добавляют 0,1- |
| реакции | образуются при |
| 0.2 г оксида меди (II) и |
| взаимодействия | взаимодействии |
| нагревают. |
| уксусной кислоты с | карбоновых кислот с |
|
|
| оксидом меди | оксидами металлов? |
|
|
| (назовите основной |
|
|
|
| продукт реакции). |
|
|
| Опыт 4 Образование и гидролиз ацетата железа (Ш) |
| |
| К 1-2 мл ацетата натрия | Что | 3 CH3COONa+ FeCl3 → | Что образуется |
| добавляют хлорид | наблюдается до | (CH3COO)3Fe + 3NaCl | при взаимодействии |
| железа. (III). Раствор | и после | (CH3COO)3Fe +H2O | ацетата натрия и |
| кипятят. | кипячения? | = Fe(CН3COO)2OH↓ | хлорида железа? Какой |
|
|
|
| процесс |
|
|
| +CH3COOH | происходит с этой солью |
|
|
| Назовите | при кипячении? |
|
|
| образовавшиеся соли. |
|
Проделайте опыты результаты занесите в таблицу.
2.4.6 Лабораторная работа №6.
Тема: Синтез этилового эфира уксусной кислоты
Теоретическая часть
С ложными эфирами называются соединения, в которых присутствует сложно - эфирная группа. Их общая формула R-C=O , где R, R’-углеводородные радикалы. О- R’
ложными эфирами называются соединения, в которых присутствует сложно - эфирная группа. Их общая формула R-C=O , где R, R’-углеводородные радикалы. О- R’
Основным методом получения сложных эфиров является реакция спирта (одноатомного или многоатомного) с карбоновой кислотой – реакция этерификации.
Основным химическим свойством сложных эфиров является их гидролиз (омыление).
| Гидролиз может | катализироваться кислотой: |
|
|
| С | +Н2О → | С | + С2Н5ОН |
| О-С2Н5 | ОН |
| |
Сложные эфиры представляют собой бесцветные жидкости нерастворимые в воде и обладающие сравнительно небольшими температурами кипения, что обусловлено отсутствием межмолекулярных водородных связей.
Домашнее задание: «Приятные запахи»
Составьте уравнения реакций получения этилового эфира муравьиной кислоты. Этот эфир имеет запах рома.
Составьте уравнения реакций получения бутилового эфира масляной кислоты. Этот эфир имеет запах ананаса.
Это интересно:

Сложные эфиры обладают приятным запахом и поэтому применяются в парфюмерии и пищевой промышленности в качестве ароматизаторов.
Они также применяются в производстве пластмасс и искусственных волокон как растворители для различных красок и лаков, в производстве моющих веществ.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Что такое сложные эфиры?
Как называется реакция между карбоновой кислотой и спиртом?
Как переводится с латинского aether ?
Где в природе содержатся сложные эфиры?
Как используют сложные эфиры?
Практическая часть.
Цель: Получить сложный эфир уксусной кислоты и этилового спирта.
Оборудование и реактивы: Пробирки, спиртовки, держатели, спички; этиловый спирт, уксусная кислота, серная кислота (конц.), вода.
Проделать опыт результаты занести в таблицу.
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
|
| Опыт 1 Образование этилацетата |
| |
| В сухую пробирку | Что наблюдается? | Составьте уравнение | Какое вещество |
| наливают 2 мл этилового |
| реакции взаимодействия | получили? |
| спирта, 2 мл ледяной |
| между этиловым спиртом | Опишите физические |
| уксусной кислоты и 1 |
| и уксусной кислотой | свойства полученного |
| каплю |
| (назовите основной | эфира. |
| концентрированной |
| продукт реакции). | Назовите данную |
| серной кислоты. |
|
| реакцию. |
| Пробирку нагревают в |
|
| В чем заключается роль |
| пламени горелки 5-10 |
|
| серной кислоты? |
| минут. Раствор |
|
|
|
| охлаждают. |
|
|
|
| Для выделения |
|
|
|
| этилацетата содержимое |
|
|
|
| пробирки переливают в |
|
|
|
| пробирку с холодной |
|
|
|
| водой. |
|
|
|

2.4.7 Лабораторная работа №7.
Тема: Жиры.
Свойства жиров. Мыла.
Теоретическая часть
Жиры представляют собой сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот. Высшие кислоты содержат от 10 атомов углерода и более, хотя в составе жиров встречаются и более простые гомологи (масляная, капроновая). Молекулы жиров содержат остатки как придельных, так и непредельных кислот, имеющих четное число атомов углерода и неразветвленный углеродный скелет. Природные жиры являются смешанными сложными эфирами (молекулы образованы различными кислотами). Жиры, образованные предельными кислотами (масляная, пальмитиновая, стеариновая и др.), имеют, как правило, твердую консистенцию. Это жиры животного происхождения (исключение составляет животный жир). Если в составе жира содержатся остатки непредельных кислот (олеиновая и линолевая), они представляют собой вязкие жидкости, которые называются маслами. Масла – это жидкие жиры растительного происхождения (исключением является твердое пальмовое масло): льняное, конопляное, подсолнечное, оливковое, соевое, кукурузное и другие.
Состав жиров определяет их физические свойства.
Это интересно:

Начало систематических исследований жиров связано с именем французского химика Мишеля Эжена Шевраля. В 1811 г он показал, что при гидролизе жиров происходит образование глицерина и карбоновых кислот. Так были открыты восемь неизвестных ранее кислот: стеариновая, олеиновая, масляная, капроновая и другие. В 1854 г Марселем Бертло впервые был осуществлен синтез жиров из продуктов их омыления.
До 19 века для освещения улиц и домов использовали китовый жир или сало, что привело к массовому истреблению животных. М. Э. Шееле предложил использовать вместо сальных свечей стеариновые. Стеарин стали получать каталитическим окислением парафина.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Чем отличаются по строению жидкие жиры от твердых?
Как опытным путем различить машинное и растительное масло?
Что такое маргарин?
Как его получают?
Напишите структурную формулу молекулы жира, образованного глицерином и пальмитиновой, стеариновой и масляной кислотами. Сколько изомеров может иметь такое вещество?
Практическая часть
Цель: Изучить свойства жиров. Сформировать умения составлять уравнения реакций с участием жиров.
Оборудование и реактивы: Пробирки, спиртовки, держатели, спички; фильтровальная бумага, стеклянные палочки, фарфоровая чашка, подсолнечное масло, бензол, этанол, бензин, касторовое масло, гидроксид натрия, бромная вода, раствор перманганата калия, насыщенный раствор хлорида натрия.
Проделать опыт результаты занести в таблицу.
| Что делали | Признаки реакции | Уравнение реакции | Выводы |
| Опыт№1: Сравнение растворимости подсолнечного масла в различных растворителях | |||
| В три пробирки налейте | Что наблюдается? |
| В какой жидкости жиры |
| по 1 мл |
|
| растворяются лучше? |
| дистиллированной воды, |
|
|
|
| спирта и бензина и |
|
|
|
| добавьте в них по 2-3 |
|
|
|
| капли подсолнечного |
|
|
|
| масла. Встряхните |
|
|
|
| содержимое пробирок. |
|
|
|
| Несколько капель | Что наблюдаете после |
|
|
| раствора жира в этаноле и | испарения растворителя? |
|
|
| бензине нанесите на |
|
|
|
| фильтровальную бумагу. |
|
|
|
| Опыт№2Доказательсво непредельности кислот входящих в состав подсолнечного масла. | |||
|
|
|
| Практически докажите, |
|
|
|
| что в состав |
|
|
|
| подсолнечного масла |
|
|
|
| входят остатки |
|
|
|
| непредельных кислот. |
|
|
|
| Объясните свои действия. |
| Опыт№3: Омыление жира водно-спиртовым раствором щелочи. | |||
| В пробирку поместить 1 | Что вы наблюдаете? |
| Условно считая жир |
| мл касторового масла, 1 |
|
| тристеаратом глицерина, |
| мл этилового спирта, 1 мл |
|
| напишите уравнение |
| 35% раствора едкого |
|
| реакции его щелочного |
| натра. Содержимое |
|
| гидролиза. Как называется |
| пробирки перемешать и |
|
| вещество, которое вы |
| нагреть на спиртовке. |
|
| получили? |
| Омыление протекает при |
|
|
|
| слабом кипячении в |
|
|
|
| течение 3-5 минут. |
|
|
|
| Содержимое пробирки |
|
|
|
| вылить в фарфоровую |
|
|
|
| чашку и при |
|
|
|
| непрерывном |
|
|
|
| помешивании добавить |
|
|
|
| насыщенный раствор |
|
|
|
| хлорида натрия. На |
|
|
|
| поверхности всплывают |
|
|
|
| мыла, которые |
|
|
|
| отфильтровывают через |
|
|
|
| слой марли. |
|
|
|

Результаты работы оформить в тетради.
Мыла, синтетические моющие средства. Сравнение свойств.
Теоретическая часть
Изготовление мыла – один из древних химических синтезов(щелочной гидролиз жиров).Мыло, которое мы используем, представляет собой смесь солей, так как жир , из которого его получают, содержит остатки различных кислот. Натриевые соли имеют твердое агрегатное состояние, а калийные – жидкое. При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты. С химической точки зрения все мыла одинаковы и природа их действия во всех случаях одна и та же. Принцип действия синтетических моющих средств такой же, как у мыла, но с преимуществами. Их растворы имеют нейтральную среду и сохраняют свои действия в жесткой и даже морской воде.
Если моющее средство предназначено для стирки хлопчатобумажных тканей, то реакция бывает щелочной, а если для шелковых и шерстяных тканей – нейтральной. Поэтому окраска индикаторов в растворах синтетических моющих средств меняется по-разному.
| Фенолфталеин | среда | изменение окраски |
|
| нейтральная | бесцветный |
|
| слабощелочная | розовый |
|
| сильнощелочная | малиновый |
Домашнее задание: «Варим мыло»
Для этого нагрейте в чашке кусочек бельевой (стиральной) соды (Na2CO3) с водой и накапайте несколько капель стеарина с горящей свечи. Перемешайте. Вскоре жидкость вспенится, это образовалось мыло.
Это интересно:
Мыло делают из жира и щелочи. Сода в водном растворе дает щелочную среду, свеча состоит из стеариновой кислоты, а стеарин получают из жира. Вот мы и сварили мыло из жира и щелочи. Поэтому мыло химики называют стеариновый натрий или стеарат натрия.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Что такое жиры?
Что такое мыла?
Почему раствор мыла в воде имеет щелочную реакцию ?
Что такое жесткость воды?
Какие способы умягчения воды вам известны?
Практическая часть
Цель: Сравнить свойства растворов мыла и СМС.
Оборудование и реактивы: Пробирки, пипетки; растворы мыла, твердого СМС, жидкого СМС, фенолфталеин, жесткая вода.
Проделать опыты и результаты занести в таблицу.
| Что делали |
| Признаки реакции | Уравнение реакции | Выводы |
|
| Опыт 1 Испытание растворов моющих средств индикатором | |||
| В трех пробирках |
| Запишите окраску | Подтвердите | Запишите реакцию |
| готовят растворы: |
| растворов: | уравнением реакции, | среды: |
| А) мыла |
| А) … | почему раствор мыла | А) … |
| Б) твердого СМС |
| Б) … | имеет щелочную | Б) … |
| В) жидкого СМС |
| В) … | реакцию среды. | В) … |
| Добавляют по 2-3 капли |
|
|
| Какое из моющих |
| фенолфталеина. |
|
|
| средств следует |
|
|
|
|
| использовать для |
|
|
|
|
| стирки: - х/б тканей - шелковых и шерстяных тканей. Почему раствор мыла имеет щелочную реакцию? |

| Опыт 2 Исследование свойств моющих средств в жесткой воде
| |||
| В трех пробирках | Запишите вспенивание |
| Сделайте вывод о |
| готовят растворы в | растворов (слабое, |
| преимуществах |
| жесткой воде: | среднее, сильное): |
| использования различных |
| А) мыла | А) … |
| моющих средств в |
| Б) твердого СМС | Б) … |
| жесткой воде. |
| В) жидкого СМС | В) … |
|
|
| Энергично встряхивают |
|
|
|
| пробирки. |
|
|
|
2.4.8 Лабораторная работа №8.
Тема: Углеводы.
Изучение свойств глюкозы.
Теоретическая часть.
Углеводы представляют собой конечные продукты фотосинтеза и являются исходными веществами для биосинтеза других органических соединений. Глюкоза С6Н12О6 представляет собой наиболее распространенный и наиболее важный моносахарид – гексозу. Она содержится в соке винограда и других ягод и фруктов, является структурным звеном сахарозы, целлюлозы, крахмала. В крови человека (в норме) содержится около 0,1% глюкозы. Глюкоза – белое кристаллическое вещество сладкого вкуса, хорошо растворимое в воде. По химическому строению глюкоза многоатомный спирт и альдегид , содержит пять гидроксильных групп –ОН и одну карбонильную группу. Как альдегид она вступает в реакции гидрирования, дает реакцию «серебряного зеркала», как многоатомный спирт вступает в реакцию этерификации. Специфическим свойством глюкозы является процесс брожения. Существует несколько типов брожения: спиртовое, молочнокислое и маслянокислое. В живом организме глюкоза окисляется кислородом воздуха до углекислого газа и воды, с выделением большого количества энергии.
Это интересно:
Глюкоза – основной источник энергии в клетке. Именно она используется в лечебных целях (применяют внутрь или вводят внутривенно ослабленным больным). Кроме того глюкозу используют для получения различных соединений: этилового спирта, молочной кислоты и др. В пищевой промышленности ее применяют в качестве заменителя сахарозы. Для этого используют патоку – сиропообразную массу, получаемую при неполном гидролизе крахмала. При добавлении глюкозы к сахарозе она препятствует ее кристаллизации и поэтому используется в кондитерском деле для получения карамели, мармелада и т.д. Как заменитель сахара для людей, страдающих сахарным диабетом, используют продукт восстановления глюкозы – шестиатомный спирт сорбит.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Что такое моносахариды? На какие группы они делятся?
Почему глюкоза относится к веществам с двойственной функцией?
Какие свойства глюкозы находят практическое применение?
Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Углекислый газ-----глюкоза-----сорбит Глюкоза-----этиловый спирт-----этилен Глюкоза-----глюконовая кислота----глюконат натрия
Практическая часть.
Цель: Изучить химические свойства глюкозы, сформировать умения составлять уравнения реакций с участием моносахаридов.
Оборудование и реактивы: штатив с пробирками, держатель, спиртовка, раствор глюкозы, гидроксид натрия, сульфат меди, известковое молоко, аммиачный раствор оксида серебра.

| Что делали | Признаки реакции | Уравнение реакции | Выводы |
Опыт№1: Реакция глюкозы со щелочным раствором гидроксида меди.
| В пробирку налить 1-2 | Что наблюдается? | Напишите уравнение | Укажите тип реакции. |
| капли раствора глюкозы, 3- | Какого цвета был | реакции. |
|
| 5 капель 10% раствора | осадок? |
|
|
| гидроксида натрия и 1 |
|
|
|
| каплю 5% раствора |
|
|
|

| сульфата меди. |
|
|
|
| Образующийся осадок |
|
|
|
| при встряхивании |
|
|
|
| растворяется. |
|
|
|
| Пробирку нагрейте. | Что наблюдаете? | Запишите уравнение | Укажите тип реакции. |
|
|
| проведенной реакции. |
|
|
| Опыт№2: Реакция с раствором гидроксида кальция. |
| |
| К 2-3 каплям раствора | Что наблюдается? | Напишите уравнение | Почему выделился белый |
| глюкозы добавляем по |
| реакции. | осадок? Почему при |
| каплям известковое |
|
| длительном пропускании газа |
| молоко, при этом |
|
| осадок растворяется? |
| образуется раствор |
|
| Укажите тип реакции. |
| глюкозат кальция. |
|
|
|
| Известковое молоко |
|
|
|
| добавляем в избытке, |
|
|
|
| чтобы в пробирке был |
|
|
|
| осадок, не исчезающий |
|
|
|
| при встряхивании. Через |
|
|
|
| пять минут |
|
|
|
| отфильтровываем раствор |
|
|
|
| и через него пропускаем |
|
|
|
| углекислый газ. |
|
|
|
| Опыт№3. Окисление глюкозы аммиачным раствором оксида серебра. | |||
| К 2 мл аммиачного | Что наблюдаете? | Запишите уравнение | Укажите тип реакции. |
| раствора оксида серебра |
| проведенной реакции. |
|
| добавьте 1-3 мл раствора |
|
|
|
| глюкозы и нагрейте смесь |
|
|
|
| на пламени спиртовки |
|
|
|
| равномерно. |
|
|
|
Результаты оформите в тетради..
Изучение свойств полисахаридов (крахмала)
Теоретическая часть
Общая формула крахмала (С6Н10О5)n. Крахмал состоит из макромолекул линейного строения – амилозы – и разветвленного строения – амилопектина. Строение макромолекул влияет на растворимость крахмала: амилоза растворяется, а амилопектин набухает с образованием клейстера.
Характерной реакцией крахмала является его взаимодействие с йодом:
(C6H10O5)n + x I2 = (C6H10O5)n * xI2
Если разделить амилозу и амилопектин, то в реакции с йодом окрашивание дает только амилоза, которая имеет линейное строение. Ее молекулы закручены в спираль, виток которой включает шесть остатков глюкозы, в образовавшемся канале могут поместиться молекулы йода. При нагревании происходит десорбция и комплекс разрушается.
Домашнее задание: «Удаляем пятна йода с тканей»
Сделайте пятно йодной настойкой на белой ткани. Смочите ее холодной водой и несколько раз с обеих сторон протрите пятно свежим срезом клубня сырого картофеля. Пятно исчезнет.
Это интересно:
В состав картофеля входит крахмал, который взаимодействует с йодом.
состав картофеля входит крахмал, который взаимодействует с йодом.
Домашнее задание: «Солнечный свет в природе»
Выберите для опыта растение с широкими, не слишком толстыми и твердыми листьями. Выбранный лист должен хорошо освещаться солнцем в течение дня. Вечером прикрепите к листу булавкой два пробочных диска так, чтобы они находились друг напротив друга на верхней и нижней стороне листа. На следующий день сорвите лист, снимите пробки,
погрузите его на несколько секунд в кипящую воду. После этого положите лист в спирт (водку) на несколько часов до исчезновения всей зеленой окраски. Выньте лист и протрите его йодной настойкой. Вокруг кружка лист окрасится в черно-синий цвет – там есть крахмал. Кружок не темнеет. Крахмала там нет.
Это интересно:

Днем, под действием солнечного света, в листьях растений образуется крахмал, который ночью превращается в сахар. На затемненном месте листа крахмал не образовался, и характерного окрашивания не произошло.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Что такое углеводы?
В результате какого процесса и где образуются углеводы в природе. Что является катализатором этой реакции?
Классификация углеводов. Приведите примеры представителей каждого класса.
Дайте сравнительную характеристику крахмалу и целлюлозе.
Какая реакция является качественной на крахмал?
Практическая часть
Цель: Практически подтвердить свойства углеводов, сформировать умения составлять уравнения реакций с участием полисахаридов.
Оборудование и реактивы: Пробирки, спиртовки, держатели, спички, шпатели; крахмал, спиртовой раствор йода, вода.
Проделать опыты, результаты занести в таблицу.
| Что делали | Признаки реакции | Уравнение | Выводы |
|
|
| реакции |
|
|
| Опыт 1 Изучение физических свойств крахмала |
| |
| В пробирку наливают 3- | Что образуется? | Запишите формулу | Опишите физические |
| 4 мл воды и добавляют |
| крахмала. | свойства крахмала: |
| 2-3 г крахмала. |
|
| агрегатное состояние, |
| взбалтывают. |
|
| структуру, цвет, запах, |
|
|
|
| вкус. Сделайте вывод о |
|
|
|
| растворимости |
|
|
|
| крахмала в воде. |
|
| Опыт 2 Взаимодействие крахмала с | йодом | |
| Суспензию, | Что наблюдается до |
| Объясните наблюдаемые |
| образовавшуюся в первом | нагревания и после? | Составьте уравнение | явления. |
| опыте, понемногу |
| реакции между йодом и |
|
| вливают в пробирку с |
| крахмалом. |
|
| кипящей водой, |
|
|
|
| постоянно взбалтывая. |
|
|
|
| Полученный клейстер |
|
|
|
| разбавляют холодной |
|
|
|
| водой и добавляют 2-3 |
|
|
|
| капли йода. Нагревают, |
|
|
|
| охлаждают. |
|
|
|
.
2.4.9 Лабораторная работа №9.
Тема: Белки.
Теоретическая часть
Белки – это природные полимеры, мономером которых являются аминокислоты. Различают первичную, вторичную, третичную и четвертичную структуры белков. При нагревании, под действием сильных кислот или оснований, солей тяжелых металлов и некоторых других реагентов происходит необратимое осаждение (свертывание) белков, называемое денатурацией. При денатурации происходит изменения во вторичной и третичной структуре белка, а первичная сохраняется. При этом их биологическая функция полностью уничтожается. В некоторых случаях возможен и обратный процесс, он называется «пептизация белка». Белки дают две качественные реакции:
при биуретовой реакции появляется фиолетовая окраска. Такая же реакция происходит и с другими соединениями, которые содержат пептидные группы;
при ксантопротеиновой реакции белки окрашиваются в желтый цвет. Эта реакция доказывает, что в состав белков входят остатки ароматических аминокислот;
Если к раствору белков прилить ацетат свинца, а затем гидроксид натрия и нагреть, то выпадает черный осадок, что указывает на содержание серы.
Домашнее задание: «Исследуем перья, волосы, ногти»
Подержите на огне птичье перо, ваш волос или кусочек срезанного ногтя. Вы почувствуете запах жженого рога. Это говорит о том, что в них содержится белок.
Это интересно:
Ноготь состоит из рогового вещества, в котором содержится один из видов белка. Из этого же вещества состоит и копыто лошади.
При сдаче работы преподавателю, будьте готовы ответить на следующие вопросы:
Что такое белки?
Что такое аминокислоты?
Кто является основоположником полипептидной теории строения белка?
Дайте классификацию белков по химическому составу.
Какие структуры белка вам известны? Дайте определения.
Что такое денатурация белка? Под действием каких факторов она может происходить?
Какие функции выполняют белки в нашем организме. Приведите примеры.
Практическая часть
Цель: Практически подтвердить физические и химические свойства белков
Оборудование и реактивы: Пробирки, спиртовки, держатели, спички; раствор белка куриного яйца, раствор гидроксида натрия, раствор сульфата меди (11), азотная кислота (конц.).
Проделать опыты, результаты занести в таблицу.
| Что делали |
| Признаки реакции | Выводы |
|
| Опыт 1 Биуретовая реакция |
| |
| В пробирку наливают 2-3 мл раствора |
| Что наблюдается? |
|
| белка, добавляют 2-3 мл гидроксида |
|
|
|
| натрия и сульфата меди (2). |
|
|
|
| Опыт 2: Ксантопротеиновая реакция |
| ||
| В пробирку наливают 2-3 мл раствора |
| Что наблюдается? |
|
| белка, добавляют 2-3 мл |
|
|
|
| концентрированной азотной кислоты. |
|
|
|
| Пробирку нагревают. |
|
|
|
|
|
|
| |
| Опыт№3. Тепловая денатурация белков. |
| ||
| В пробирку налить 1-2 мл раствора белка. |
| Что наблюдается? |
|

Пробирку нагреть.
Опыт№4. Осаждение белков минеральными кислотами.
| В пробирки наливают по 1 мл |
| Что наблюдается? |
|
| концентрированных кислот, в первую |
|
| |
| серной, во вторую – азотной, в третью – |
|
| |
| соляной. В каждую пробирку, | осторожно, |
|
|
| по стенке наливаем раствор белка. |
|
| |
|
|
|
|
|
 Опыт№5Осаждение белков солями тяжелых металлов.
Опыт№5Осаждение белков солями тяжелых металлов.
| В четыре пробирки налить по 1-2 мл | Что наблюдается? |
|
| раствора белка и по каплям добавить |
|
|
| растворы солей: в первую – 5% |
|
|
| уксуснокислого свинца, во вторую – 5% |
|
|
| сульфата меди, в третью – 5%хлорного |
|
|
| железа, в четвертую – 2,5% азотнокислого |
|
|
| серебра (до выпадения осадка). Затем |
|
|
| прибавить избыток указанных реактивов |
|
|
|
|
|
|
2.5 Решение расчетных задач по химии
Теоретическая часть
Для решения задач по химическим уравнениям нужно записать уравнение реакции и расставить коэффициенты. Затем, в зависимости от способа решения записать:
способ (по числу моль): над формулами веществ данные условия задачи, под формулами – молярные массы и количества веществ;
способ (по массам веществ): над формулами веществ данные условия задачи, под формулами – молярные массы и массы веществ.
При решении задач на вычисление объемных отношений газов нужно помнить закон объемных отношений газообразных веществ: объемы реагирующих и образующихся газов пропорциональны количествам этих веществ: V1 : V2 =
Это соотношение характерно только для газообразных веществ.
Количества веществ – это коэффициенты, стоящие перед ними в уравнениях реакций. При вычислении массовой или объемной доли выхода продукта (в процентах) от теоретически возможного надо знать:
Выход продукта – это соотношение массы, количества или объема практически полученного вещества к теоретическому:
1. Решение задач на расчет по уравнению
составить уравнение, расставить коэффициенты.
подчеркнуть, что – дано и что – найти.
под формулами подписать число молей, участвующих в реакции по уравнению (совпадает с коэффициентами), над неизвестным веществом поставить x моль.
перевести массу (объем) вещества в моли: υ=m/М или υ=V/Vm
составить пропорцию и решить ее.
перевести моли в единицы массы: m=υМ или V=υVm
2. Решение задач на избыток
составить уравнение, расставить коэффициенты.
подчеркнуть, что дано и что – найти.
под формулами подписать число молей, участвующих в реакции по уравнению (совпадает с коэффициентами), над неизвестным веществом поставить х моль.
| . | перевести массу (объем) вещества в моли: υ=m/М или | υ=V /Vm |
| 4. | составить две дроби и сравнить их: |
|
υ1(по условию)/υ1(по уравнению) и υ2(по условию)/υ2(по уравнению)
! Расчет ведем по тому веществу, которого меньше, т.к. оно полностью вступит в реакцию.
составить пропорцию и решить ее. перевести моли в единицы:
массы: m=υМ
объема: V=υVm
Решение задач на расчет массовой доли выхода продукта реакции в % от теоретически возможного
выход по массе: ωвых.=mпр./mтеор.*100%
выход по объему: ωвых.=Vпр./Vтеор. *100% , где:
m (V)практ. указывается в условии задачи и показывает, сколько г (л) вещества реально
получено;
m (V)теорет. Рассчитывается по уравнению и показывает, сколько вещества могли бы получить если бы не было потерь;
Зная выход, можно рассчитать mпр. или Vпр.:
mпр.= mтеор.* ωвых./100% Vпр.= Vтеор. * ωвых./100%
Практическая часть
Тема: Решение расчетных задач по химии
Вычислите количество теплоты, которая выделится при сгорании 11,2 м3 метана, если термохимическое уравнение реакции его горения
СН4 + 2О2 = СО2 + 2Н2О + 900 кДж
Найдите объем этилена, полученного реакцией дегидратации 230 мл 95% -го этилового спирта (плотность 0,8 г\мл).
Вычислите объем кислорода, который потребуется для сжигания 56 м3 смеси этана и ацетилена, если объемная доля ацетилена составляет 75%.
Рассчитайте количество теплоты, которое выделится при сжигании 20 м3 ацетилена, если термохимическое уравнение реакции его горения
С2Н2 + 2,5О2 = 2СО2 + Н2О + 1300 кДж
Рассчитайте количество вещества ацетилена, которое потребуется для получения 400 мл бензола (плотность 0,8 г\мл).
При взаимодействии 3 г предельного одноатомного спирта с необходимым количеством натрия выделилось 0,56 л водорода. Выведите формулу спирта, запишите формулы возможных изомеров и дайте их названия.
При взаимодействии фенола с бромной водой образуется нерастворимый в воде 2,4,6-трибромфенол (качественная реакция на фенол). При взаимодействии избытка бромной воды на 240 г водного раствора фенола получено 8,45 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
Органическое вещество легко восстанавливается аммиачным раствором оксида серебра и содержит 62% углерода, 27,6% кислорода и 10,4% водорода. Определите структурную формулу вещества.
Какой объем формалина с массовой долей метаналя 40% (р = 1,1г\мл) можно получить при окислении 200 мл 60%-ного раствора метилового спирта (р = 0,8г\мл)?
Сколько миллилитров 40%-ной серной кислоты (р = 1,4г\мл) потребуется для получения стеариновой кислоты из 100 г технического мыла, содержащего 70% стеарата натрия?
Какой объем этилового спирта (плотность 0,8 г\мл) можно получить спиртовым брожением глюкозы , полученной гидролизом 324 г крахмала? Стадия гидролиза протекает с количественным выходом 100%, массовая доля выхода этанола в стадии брожения составляет 90%.
При гидролизе 500 кг древесных опилок, содержащих 50% целлюлозы, получили 70 кг глюкозы. Вычислите массовую долю выхода продукта реакции.
Блузка из триацетатного волокна весит 144 г. Какая масса целлюлозы потребуется для производства ткани, израсходованной на пошив блузки?
При сгорании органического вещества массой 6,90 г образовалось 13,2 г углекислого газа и 8,1 г воды. Плотность паров этого вещества по воздуху 1,59. Определите молекулярную формулу вещества. Напишите структурные формулы изомеров и назовите их.
Органическое вещество содержит 38.7% углерода, 45,15% азота 16,5% водорода. Относительная плотность его паров по водороду равна 15,5. Определите формулу вещества.
Какой объем кислорода расходуется на окисление глюкозы массой 3,6 г?
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию уксусной кислоты массой 18 г?
Какой объем кислорода расходуется на окисление метиламина объемом 5 л?
В лаборатории восстановлением нитробензола массой 61,5 г получили анилин массой 44 г. Определите массовую долю (в%) выхода анилина.
Смешали 10 л газообразного метиламина и 10 г хлороводорода. Какой газ останется
избытке и каков его объем при тех же условиях?
3.УСЛОВИЯ РЕАЛИЗАЦИИ ПРОГРАММЫ лабораторного практикума по дисциплине "ОРГАНИЧЕСКАЯ ХИМИЯ".
3.1Требования к материально-техническому обеспечению:
наличие лабораторного кабинета;
наличие методических пособий для выполнения лабораторных работ;
наличие необходимых химических реактивов, химической посуды, оборудования.
3.2.Информационное обеспечение обучения.
Перечень рекомендуемых источников основной и дополнительной литературы.
Основная литература:
Захарова Т.Н., Головлева Н.А. Органическая химия: учебник для студ. СПО. – М.: Академия, 2012
Дополнительная литература:
Берман Н.И. Решение задач по химии. М.: Слово, 2009.
Габриелян О.С. Химия 10 класс (базовый уровень) Дрофа. Москва, 2010.
Малышкина В. Занимательная химия. Санкт-Петербург, «Тригон», 2006.
Смирнов В.Ф., Чирва А.Н. Путешествие в страну тайн (Познавательные игры в семье). М.:Новая школа, 2005.
Хомченко Г.П. Пособие по химии для поступающих в вузы. – 3-е изд., испр. и доп. – М.: ООО «Издательство Новая Волна», 2011.
Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд., испр. и доп. – М.: ООО «Издательство Новая Волна», ЗАО «Издательство Дом ОНИКС», 2011
9
© 2024, Бусарова Ирина Алексеевна 118 0
Рекомендуем курсы ПК и ППК для учителей
Похожие файлы
Полезное для учителя




 Н3-С=О
Н3-С=О Н3-С=О
Н3-С=О

















