Тамбовское областное государственное бюджетное образовательное учреждение
среднего профессионального образования
"Котовский индустриальный техникум"
методическая разработка
на тему:

Открытое заседание химического кружка
"Химик"
Разработал: преподаватель спецдисциплин Т.Г.Цыганкова
Город Котовск
2012 год

ЦЕЛИ:
1. Закрепить знания по теме "Растворы".
2. Показать роль русских и зарубежных ученых в развитии теории растворов.
3. Показать связь изученного материала с практикой.
4. Развитие интереса к изучаемому предмету.
ОФОРМЛЕНИЕ КАБИНЕТА:
Стенд "В мире растворов".
Название портов и кораблей для участников викторины.
Плакат "Практике наука путь открывает, практика науке пищу дает!"
ДИДАКТИЧЕСКИЙ МАТЕРИАЛ:
Таблицы растворимости, ПСХЭ, калькуляторы, карточки с индивидуальными заданиями, реактивы, пробирки, катиониты и аниониты,
ТСО:
Мультимедийный проектор (слайды)
План занятия.
Вступительное слово руководителя кружка.
Ионный обмен и его применение.
Викторина "Путешествие в страну растворов".
Вступительное слово руководителя кружка (постановка цели, значение темы и т.д.).
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Человек, животные и растения усваивают питательные вещества в виде растворов. Сложные физико-химические процессы в организмах человека и животных протекают в растворах. Природная и минеральная вода являются растворами.
В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание ТЭД является основой для изучения свойств неорганических и органических соединений, для глубокого понимания химических реакций в растворах электролитов.
Выступления членов кружка.
Краткое содержание выступлений.
Ионный обмен
Впервые ионный обмен при очистке воды был использован в 1903 г. Для разделения и очистки веществ русским ботаником М.С.Цветом, создавшим новый вид химического анализа, названный хроматографическим, с помощью которого он выяснил состав хлорофилла. Историю ионитов можно начинать с работ этого ученого.
Очень большая заслуга в деле создания ионитов принадлежит выдающемуся советскому почвоведу К.К.Гедройцу, впервые объяснившему, как происходит ионный обмен в почвах. Созданная им и другими учеными теория позволила начать изготовление первых искусственных ионитов для промышленности вначале из торфа и каменного угля, а потом и из алюмосиликатов. Открытие способов получения синтетических смол позволило сделать следующий шаг—перейти к созданию ионообменных смол—ионитов.
Как видно из этой исторической справки, своими успехами в этой области наука и техника обязаны в первую очередь трудам русских ученых.
Иониты – что это такое?
Кто же создал эти чудесные смолы, которые дают возможность науке и технике успешно решать все новые и новые задачи?
Можно ли очищать воду от растворённых в ней солей фильтрованием без перегонки?
«Конечно, нет! — скажете вы.—Фильтрованием можно очищать жидкости только от нерастворимых примесей. Сколько ни фильтруй, например, солёную воду, дистиллированной от этого она не станет!»С давних пор в этом были убеждены все, пока не появились синтетические смолы, названные ионообменными, или ионитами.(демонстрация ионитов)
Иониты — твёрдый зернистый материал, в Зависимости от вида могут быть окрашены в тёмный или светлый цвет, обладают способностью набухать в воде. Если взять прибор из двух стеклянных трубок, наполненных такими зёрнами, и пропускать через них солёную воду, то в подставленный стакан будет стекать совершенно безвкусная и прозрачная жидкость.
Как же можно объяснить это превращение солёной воды в дистиллированную с помощью фильтрования?
Растворение — явление более сложное, чем представляется на первый взгляд. Молекулы многих веществ при растворении в воде распадаются (диссоциируют) на электрически заряженные частицы — ионы. Одни из них оказываются положительно заряженными и называются катионами, другие — отрицательно заряженными и называются анионами. Например, при растворении поваренной соли в воде образуются катионы натрия — положительно заряженные частицы натрия Na+ и анионы — отрицательно заряженные кислотные остатки соляной кислоты С1- . Процесс диссоциации поваренной соли, происходящий при этом, можно записать так:
NaCl ↔Na+ + Сl-
Иониты, попадая в воду, тоже подвергаются диссоциации. Одни из них образуют очень сложные анионы , кроме того, катионы водорода Н+ . Эти иониты называются катионитами. Другие, диссоциируя, образуют очень сложные катионы и, кроме того, анионы ОН- , т. е. отрицательно заряженные гидроксильные группы. Эти иониты называются анионитами.
Секрет действия ионитов на растворы солей и других веществ состоит в том, что они могут поглощать из растворов этих веществ образуемые ими ионы, а вместо них отдавать, например, ионы водорода Н+ и гидроксильных групп ОН- .
При прохождении солёной воды через первую трубку прибора в приведённом выше примере находящийся в ней катионит поглощает из воды ионы натрия Na+, а вместо них отдаёт ионы водорода Н+. Анионит же, помещённый во второй трубке, поглощает из солёной воды кислотные остатки соляной кислоты С1- и отдаёт ионы ОН- . Солёная вода в результате такого обмена нонами очищается от поваренной соли и становится такой же чистой, как дистиллированная.
Достоинство ионитов заключается в том, что их можно многократно использовать и активность при этом почти не изменяется. Это достигается тем, что насыщенный поглощёнными ионами катионит промывают слабыми растворами минеральных кислот (или солей), аниониты — растворами едких щелочей с последующей промывкой водой.
Викторина "Путешествие в страну растворов"
( по материалам презентации)
Мы отправляемся в страну растворов на 4-х кораблях (4 команды по 4 человека): Бригантина, Фрегат, Крейсер и Парусник. В каждом порту мы будем знакомиться с его достопримечательностями и в конце путешествия вернемся в наш родной порт "КИТ". Счастливого плавания!
Порт "История"
Сванте Аррениус
С ванте-Август Аррениус родился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики.
ванте-Август Аррениус родился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики.
В 1876 году юноша был принят в Упсальский университет. И уже через два года (на шесть месяцев раньше срока) он сдал экзамен на степень кандидата философии.
Однако впоследствии он жаловался, что обучение в университете велось по устаревшим схемам: например, "нельзя было услышать ни единого слова о менделеевской системе, а ведь ей было уже больше десяти лет"…
Хотя Сванте Аррениус по образованию - физик, он знаменит своими химическими исследованиями и стал одним из основателей новой науки - физической химии. Больше всего он занимался изучением поведения электролитов в растворах, а также исследованием скорости химических реакций.
Работы Аррениуса долгое время не признавали его соотечественники, и только когда его выводы получили высокую оценку в Германии и Франции, он был избран в Шведскую академию наук. За разработку теории электролитической диссоциации Аррениусу была присуждена Нобелевская премия1903года.
Веселый и добродушный великан Сванте Аррениус, настоящий "сын шведской сельской местности", всегда был душой общества, располагал к себе коллег и просто знакомых. Он был дважды женат; его двух сыновей звали Олаф и Свен. Он получил широкую известность не только как физикохимик, но и автор множества учебников, научно-популярных и просто популярных статей и книг по геофизике, астрономии, биологии и медицине.
Но путь к мировому признанию для Аррениуса-химика был совсем не прост. У теории электролитической диссоциации в ученом мире были очень серьезные противники. Так, Д. И. Менделеев резко критиковал не только саму идею Аррениуса о диссоциации, но и чисто "физический" подход к пониманию природы растворов, не учитывающий химических взаимодействий между растворенным веществом и растворителем. Сам он считал процесс растворения физико-химическим.
Впоследствии выяснилось, что и Аррениус, и Менделеев были каждый по-своему правы, и их взгляды, дополняя друг друга, составили основу новой - протонной - теории кислот и оснований.
2. Дмитрий Иванович Менделеев (1834-1907 г)

Работы Д.И.Менделеева относятся ко многим разделам химии. Это периодический закон и ПСХЭ, уравнение состояния идеального газа. Но большой вклад Д.И.Менделеев внес в развитие теории гидратации, впервые развивший в 1865-1887 гг. представления о взаимодействии растворенного вещества с растворителем.
Вильгельм-Фридрих Оствальд (1853-1932)
 Немецкий физикохимик Вильгельм-Фридрих Оствальд (1853-1932), сын немецкого бондаря, выходца из России, родился в Риге. Там же он учился в университете и начинал работать в должности профессора. В 1888 году он принял немецкое гражданство и переехал в Лейпциг, где тоже преподавал в университете и возглавлял Физико-химический институт.
Немецкий физикохимик Вильгельм-Фридрих Оствальд (1853-1932), сын немецкого бондаря, выходца из России, родился в Риге. Там же он учился в университете и начинал работать в должности профессора. В 1888 году он принял немецкое гражданство и переехал в Лейпциг, где тоже преподавал в университете и возглавлял Физико-химический институт.
Десятью годами раньше Оствальд женился на племяннице своего знакомого - доктора Райера. Вильгельм и и Элен прожили всю жизнь счастливо, у них родились три сына и две дочери. Одна из них, Грета, в 1953 году написала книгу о своем знаменитом отце, и описала там многие его чудачества.
В возрасте сорока лет Оствальд имел весьма эффектную внешность: совершенно седые волосы, высокий лоб, огненно-рыжие борода и усы, живые выразительные глаза… Оствальд испытывал отвращение к примерке одежды и обуви, стрижке волос, не терпел зубных врачей и никогда не лечил зубов, а с секретарем общался с помощью велосипедного звонка, который собственноручно установил на двери своего кабинета. Свои статьи, записки и письменные поручения он складывал в корзину, выставлял за дверь и звонил. Секретарь забирал корзину в свою комнату и выполнял работу, а потом возвращал корзину на место.
С 1906 года, оставив государственную службу, Оствальд поселился с семьей на даче в Гроссботене близ Лейпцига. Там он организовал свою лабораторию "Энергия", где и продолжил физико-химические исследования.
Вильгельм Оствальд изучил законы химического равновесия, в том числе в растворах, занимался электрическими свойствами растворов и открыл "закон разбавления", названный его именем. Оствальд основал первую в мире кафедру физической химии в Лейпцигском университете, много занимался историей химии, переводом и изданием редких книг выдающихся химиков мира. Ему была присуждена Нобелевская премия по химии за 1909 год.
Иван Алексеевич Каблуков (1857-1940 г.)
Т еория гидратации была разработана молодым тогда русским ученым Иваном Алексеевичем Каблуковым, впоследствии знаменитым химиком. В 1891 г. Он впервые высказал предположение, что в растворе происходит гидратация ионов растворенного вещества и образуются «непрочные соединения». Это дополняло представления Аррениуса, который считал, что никакого взаимодействия между растворителем и веществом не происходит и что молекулы распадаются на свободные ионы.
еория гидратации была разработана молодым тогда русским ученым Иваном Алексеевичем Каблуковым, впоследствии знаменитым химиком. В 1891 г. Он впервые высказал предположение, что в растворе происходит гидратация ионов растворенного вещества и образуются «непрочные соединения». Это дополняло представления Аррениуса, который считал, что никакого взаимодействия между растворителем и веществом не происходит и что молекулы распадаются на свободные ионы.
Итак, в водных растворах сначала гидратированные молекулы растворенного вещества распадаются на ионы, которые в свою очередь тоже гидратируются. Каждому иону соответствует определенное число молекул гидратной воды, причем катионы гидратируются в большей степени, чем анионы;к примеру: медный купорос содержит пять молекул воды—из них четыре связаны с катиокатионом меди и одна—с анионом SO42- (CuSO4 ·5H2O); железный купорос: шесть молекул воды из семи находятся у катиона железа, а одна у сульфат-аниона (FeSO4 ·7H2O).
Т.о. И.А.Каблуков объединил ТЭД Аррениуса с гидратной теорией растворов Д.И.Менделеева.
Порт "Всезнайка"
(конкурс капитанов)
Задание №1.
Прочитайте описание действий ученика и представьте эту информацию в виде уравнений реакций в молекулярном и ионном виде.
Выполняя практическую работу, ученик прилил к раствору карбоната калия раствор хлорида кальция, затем последовательно добавлял в эту пробирку соляную кислоту, растворы нитрата серебра, сульфата железа (III) и гидроксида натрия. Потом он попытался понять, что же у него в пробирке?
Какие вещества оказались в пробирке?
Напишите уравнения соответствующих реакций.
Задание №2.
В конце ХIХ века молодые ученые И.А.Каблуков и, независимо от него, В.А Кистяковский пришли к выводу, что ионы при движении увлекают с собой некоторое количество воды, и чем меньше радиус иона, тем большее количество воды он может удержать вокруг себя, следовательно его размеры увеличиваются. Как называется явление, которое описали Каблуков и Кистяковский?
Порт "Математическая экспертиза"
Задача №1.
Для соления огурцов применяют 5%-ный раствор поваренной соли. Определите массы соли и воды, которые надо взять для приготовления 50 кг этого раствора.
Задача № 2.
Для покрытия деталей слоем меди путем электролиза готовят раствор медного купороса: 60 г купороса растворяют в 1 л воды. Вычислите массовую долю вещества в растворе.
Задача №3.
Для подкормки комнатных растений применяют 0,2%-ный раствор натриевой селитры. Определите массу данного вещества, которую нужно взять для приготовления 5 кг раствора.
Порт "Незнайкины вопросы"
1.Лампочка прибора для определения электропроводности загорится, если электроды поместить
в воду
в гидроксид меди (II)
в азот
в расплав хлорида калия.
2.Вклад Аррениуса в науку заключается в том, что он
а) сформулировал основные положения теории электролитической диссоциации
б) выдвинул идею о гидратации ионов в растворе
в)экспериментально определил размер некоторых ионов в растворе.
3. Гидратация – это
а) процесс растворения вещества в воде
б) реакция обмена, в которой участвует вода
в) взаимодействие атомов или ионов с молекулами воды.
4. Вклад Д.И.Менделеева в науку о растворах заключается в том, что он
а) сформулировал основные положения теории электролитической диссоциации
б) открыл химическую сущность процесса растворения
в) выдвинул идею о гидратации ионов в растворе
г) объединил теорию растворов с представлениями об электролитической диссоциации.
5. Кристаллогидратами называют твердые вещества
а) в состав которых входит химически связанная вода
б) растворимые в воде
в)реагирующие с водой
6. Верно утверждение
а) анионы движутся в растворе хаотично
б) анионы заряжены отрицательно
в) анионы не имеют заряда
7. Не могут находиться в растворе одновременно ионы
а) Н+ и SO42-
б) Ва2+ и SO42-
в) Н+ и NO3-
г) Na+ и SO42-
8. Выражение "Степень диссоциации кислоты равна 25% " означает, что
а) 25% всех молекул кислоты не диссоцирует на ионы
б) 25% всех молекул диссоциирует на ионы
в) 25% всех частиц в растворе – молекулы
9.Больше всего ионов образуется при диссоциации вещества, формула которого
а) СаСl2
б) HCl
в) Al2 (SO4)3
г) H2SO4
10. Правильное уравнение диссоциации азотной кислоты записано в пункте
а) HNO3 = H+ + 3NO-
б) HNO3 = H- + NO3+
в) HNO3 = H+ + NO3-
г) HNO3 = H+ + NO3-
11. Хлорид-ион можно обнаружить в растворе после добавления к воде вещества, формула которого
а) BaCl2
б) AgNO3
в) H2S
г) HNO3
12. С образование осадка реагируют между собой растворы веществ
а) Fe(OH)3 и HCl
б) Na2SO4 и ВаCl2
в) FeCl3 и AgNO3
г) K2CO3 и HCl
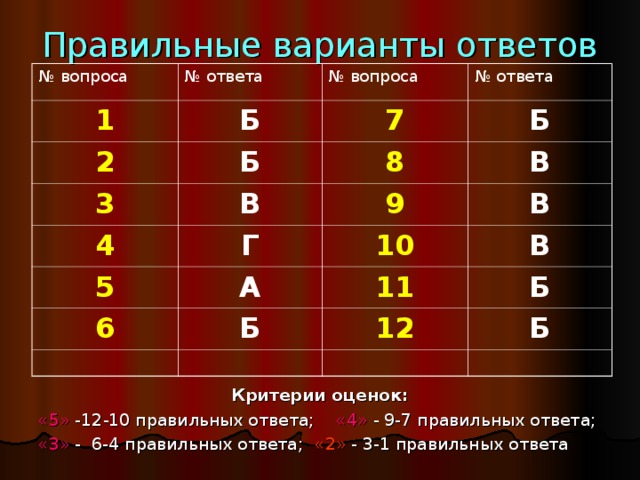
ОТВЕТЫ: 1.- Б; 4. - Г; 7. - Б; 10. - В;
-Б; 5. - А; 8. - В; 11.- Б;
-В; 6. - Б; 9. - В; 12.- Б.
Порт "Экспериментальный"
Задание №1.
Даны реактивы: растворы сульфата меди (II), гидроксида натрия, хлорида бария, серной кислоты, хлорида железа (III). Используя выданные вам вещества, получите:
а) три осадка – голубой, белый и бурый;
Напишите уравнения реакций в молекулярной и ионной форме.
Задание №2.
Даны реактивы: соляная кислота, растворы сульфата меди (II), гидроксида натрия, хлорида бария, серной кислоты, фенолфталеина. Используя выданные вам вещества, получите:
а) бесцветный раствор – раствор малинового цвета – бесцветный раствор – осадок белого цвета;
Напишите уравнения реакций в молекулярной и ионной форме.
Порт "Иониты"
Есть такое выражение: "Практике науке путь освещает, практика науке пищу дает". Ни одно изобретение, ни один закон не имели бы значения, если бы они не нашли свое применение в практике, в нашей жизни. Где же применяется ионный обмен? Выступления членов кружка.
Применение ионитов
1.
ДЕМИНЕРАЛИЗАЦИЯ ВОДЫ
Очищенная от растворённых солей (деминерализованная) вода необходима не только для лабораторий и аптек. Огромные количества её потребляются для получения различных веществ в химической промышленности. Она употребляется для зарядки аккумуляторов, для никелирования и хромирования металлических изделий, в фотографии и в кинопромышленности и для многих других целей. Получение её с помощью ионитов обходится значительно дешевле, чем в перегонных аппаратах.
По-иному будет решён вопрос о воде для паровых котлов. Современная крупная теплоэлектростанция расходует до 1 500 000 м3 воды в сутки. Если питать паровые котлы водой, в 1 m'3 которой содержится всего 10—15 г солей кальция и магния, в котлах образовывалось бы ежедневно 15—20 т накипи. В течение нескольких дней они бы вышли из строя.
В паровые котлы следовало бы заливать воду, вовсе не содержащую каких-либо примесей, особенно солей кальция и магния. А где её взять? Нельзя же получать её в таких огромных количествах для производства дешёвого пара при помощи дорогостоящей перегонки! Поэтому воду для паровых котлов обычно не перегоняют, а лишь «умягчают» содой и щёлочью, а в больших водоочистительных установках — при помощи пермутитов — искусственно приготовленных сплавов каолина, кварца и соды. При прохождении жёсткой воды через слой пермутита содержащиеся в ней соли кальция и магния поглощаются и заменяются солями натрия или калия, которые не образуют накипи на стенках котлов. Но и эти соли в воде для паровых котлов тоже нежелательны, так как они постепенно разъедают стенки котлов и этим сокращают сроки их службы.
С помощью ионитов можно получать неограниченные количества воды, полностью очищенной от солей и достаточно дешёвой и для паросиловых установок.
Интерес представляет использование ионитов и для опреснения морской воды. Например, спасаясь с тонущего корабля, экипаж его не всегда может захватить с собой в шлюпки необходимое количество пресной воды, тем более громоздкий перегонный куб и топливо для него. Небольшой по размеру и весу опреснитель с ионитами можно поместить в любую шлюпку. Коробочку с порошком ионитов может иметь при себе каждый матрос и пассажир. Если в кружку с морской водой высыпать немного этого порошка, она вскоре станет вполне пригодной для питья.
2.
ИОНИТЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Способность ионитов очищать растворы от солей без изменения качеств изучаемого продукта находит всё более широкое применение и в сахарной промышленности. В извлекаемом из сахарной свёклы соке, кроме сахара, содержатся и соли, ухудшающие качество получаемого сахара. Деминерализация этого сока с помощью ионитов значительно упрощает производство сахара и даёт возможность улучшить качество и сахара, и сахарной патоки.
Ещё не так давно необходимую для пищевой промышленности лимонную кислоту получали только из сока лимонов, ц она обходилась очень дорого. И сейчас получают её из сахара довольно дорогим способом. В то же время содержащаяся в отходах винной и консервной промышленности лимонная кислота не извлекалась и терялась безвозвратно. Извлекать же её известными уже способами обходилось бы слишком дорого. А опыты показали, что из этих отходов с помощью ионитов можно легко и выгодно получать не только лимонную, но и винную и аскорбиновую (витамин С) кислоты.
3.
СЕРЕБРО ИЗ СТОЧНЫХ ВОД
В фотолабораториях и на кинофабриках в промывные воды попадает много серебра. Улавливать его известными техническими способами невыгодно, поэтому оно обычно теряется безвозвратно. На других заводах и фабриках в сточные воды попадают и теряются медь, хром, никель и многие другие ценные вещества. В одну только Волгу ежегодно сбрасывается около 3 млн. м3 сточных вод. А сколько сбрасывается их во все водоёмы страны?!
Произведённые испытания показали, что с помощью ионитов можно не только хорошо очищать и обезвреживать сточные воды, но и извлекать из них и возвращать промышленности многие ценные вещества. Серебро, например, уже начали получать не только из серебряных руд, но и ... из сточных вод. В недалёком будущем мощные, экономически выгодные водоочистительные установки с ионитами не только положат конец загрязнению водоёмов, но и будут возвращать стране огромные количества разнообразных ценных веществ.
Подведение итогов. Награждение победителей
Заключительное слово учителя.







 ванте-Август Аррениус родился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики.
ванте-Август Аррениус родился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики. 
 Немецкий физикохимик Вильгельм-Фридрих Оствальд (1853-1932), сын немецкого бондаря, выходца из России, родился в Риге. Там же он учился в университете и начинал работать в должности профессора. В 1888 году он принял немецкое гражданство и переехал в Лейпциг, где тоже преподавал в университете и возглавлял Физико-химический институт.
Немецкий физикохимик Вильгельм-Фридрих Оствальд (1853-1932), сын немецкого бондаря, выходца из России, родился в Риге. Там же он учился в университете и начинал работать в должности профессора. В 1888 году он принял немецкое гражданство и переехал в Лейпциг, где тоже преподавал в университете и возглавлял Физико-химический институт.  еория гидратации была разработана молодым тогда русским ученым Иваном Алексеевичем Каблуковым, впоследствии знаменитым химиком. В 1891 г. Он впервые высказал предположение, что в растворе происходит гидратация ионов растворенного вещества и образуются «непрочные соединения». Это дополняло представления Аррениуса, который считал, что никакого взаимодействия между растворителем и веществом не происходит и что молекулы распадаются на свободные ионы.
еория гидратации была разработана молодым тогда русским ученым Иваном Алексеевичем Каблуковым, впоследствии знаменитым химиком. В 1891 г. Он впервые высказал предположение, что в растворе происходит гидратация ионов растворенного вещества и образуются «непрочные соединения». Это дополняло представления Аррениуса, который считал, что никакого взаимодействия между растворителем и веществом не происходит и что молекулы распадаются на свободные ионы.