Тема: Электролитическая диссоциация
Цели урока: Дать понятие об электролитах. Изучить процесс электролитической диссоциации. Уметь определять электролиты по формулам веществ. Продолжить формирование основных умений и навыков: наблюдать, анализировать, делать выводы, работать с веществами.
Оборудование и реактивы: Приборы для определения электропроводности растворов с лампочкой; растворы щелочей, кислот, солей; портреты ученых. Источники питания, амперметр, электролитические ванны, лампочки, учебник: Химия Г. Е. Рудзитис Ф.Г. Фельдман
План урока
План:
Проверка д/з
Повторение образования новых солей
Повторение названий кислот
Повторение понятий электролитов и неэлектролитов
Проведение опыта с участием двух команд с заданием
1. Оргмомент) (3 мин.)
2. Актуализация (5 мин.)
3. Усвоение нового материала (7 мин.)
4. Работа в группах, обмен информацией. (10 мин.)
5. Усвоение нового материала (5 мин.)
6. Работа в группах, экспериментальное задание (10 мин.)
7. Закрепление
8. Подведение итогов (5 мин.)
9. Домашнее задание
1. Орг. момент.
Проверка наличия принадлежностей, домашнего задания, технического и лабораторного оснащения. Учитель химии называет тему урока, который является вводным в тему “ Электролитическая диссоциация”. Объявляет основные цели и задачи урока.
2. Актуализация.
Повторение образования новых солей
Повторение названий кислот
Повторение понятий электролитов и неэлектролитов
3. Усвоение нового материала по химии.
Учитель химии. Ребята, скажите, пожалуйста, благодаря чему загорается лампока в помещении? – Электрическому току, который течёт по кабелю. Сегодня вы узнаете, что ток проводят не только кабель, а растворы некоторых классов веществ.
Эксперимент. Материалы и оборудование
Раствор NaOH
Сода – NaHCO3
Соль – NaCl
Медный купорос - CuSO4
Соляная кислота - HCl
Вода из-под крана
Вода дистиллированная
Этанол (спирт)
Таблица растворимости
Сахароза (сахар)
Проведение опыта с участием двух команд с заданием
определить растворы электролитов и неэлектролитов из данного перечня веществ.
Первая команда определяет электролиты (лампочка светится)
Вторая команда определяет неэлектролиты (лампочка не светится)
Итак, первая команда определила растворы, проводящие ток (лампочка светится) и это есть растворы электролитов
Вторая- растворы, не проводящие ток, и это неэлектролиты
Таким образом, эксперимент разделил растворы на две категории, а вы теперь имели возможность убедиться, что не все растворы проводят ток.
Автор теории ЭД шведский ученый Сванте Аррениус. (Портрет на слайде)
? Знакомо ли вам его имя? Физик – химик выяснил природу растворов электролитов и сделал логический вывод: чтобы лампочка загорелась, цепь должна замкнуться через раствор электролита. Это может произойти, если появится упорядоченное движение заряженных частиц.
? Что это за частицы в растворах солей и кислот? (Вы знакомились с такими частицами в 7 кл. при изучении ионной связи).
Ионы – “+” и “-”.
- Диссоциация – распад электролита на ионы.
- Являясь приверженцем физической теории растворов, Аррениус не ответил на вопросы.
1. Почему именно в водном растворе происходит диссоциация веществ?
2. Откуда берутся ионы в растворах кислот?
- Доработали теорию русские химики И. А. Каблуков и В. А. Кистяковский. (портреты ученых на слайде)
Суть дополнений:
1. Причиной диссоциации электролита в растворе является гидратация, т.е. взаимодействие с молекулами воды.
2.
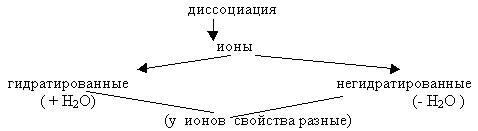
- Давайте вспомним строение воды.
- Тип связи?
- Какой из элементов имеет большую электроотрицательность?
- Разбираем образование диполя воды.
7. Закрепление. Раздача индивидуальных тестовых заданий по образцу ОГЭ химия-2017 г задания №7
8. Подведение итогов.
Что нового мы узнали на уроке?
Учащиеся отвечают, делают выводы.
Сегодня мы рассмотрели термины и понятия, касающиеся темы ТЭД. Напомните мне их, пожалуйста (диссоциация, электролит, неэлектролит )
Ученикам выставляются общие отметки, которые складываются из отметок за работу в группе и за индивидуальное тестовое задание.
9. Домашнее задание- §19 .



























