Открытый урок по химии в 9 классе на тему:
«Общая характеристика галогенов»
Цель урока: На основе положения галогенов в периодической системе элементов рассмотреть и сформировать знания о строении атомов галогенов, свойствах галогенах и их соединений, их применении
Задачи урока:
Образовательные: сформировать знания учащихся по теме «Неметаллы», дать понятие о галогенах их положении в ПСХЭ, строении атомов, свойствах, значении и применении. Развивающие: развитие познавательного интереса учащегося к предмету химия, формирование умения прослеживать причинно-следственные связи, развивать умения извлекать знания из различных источников, развивать умения обобщать и делать выводы6выделять главное, умения преодолевать трудности в учении, развитие навыков самоконтроля.
Воспитательные: воспитание ответственного отношения к учебе, воспитание решительности и смелости при выполнении заданий. Самостоятельности
Планируемые результаты:
1. Предметные:
- находить черты, свидетельствующие об общих признаках химических процессов и их различиях.
– объяснять значение веществ в жизни и хозяйстве человека.
- определять основные классы неорганических веществ;
- понимать смысл химических терминов.
2. Личностные:
- умение формировать высказывания, суждения, делать предложения;
- развитие умственной деятельности: умений обобщать, делать выводы.
3. Метапредметные:
- умение анализировать информацию, делать выводы на основании своих наблюдений;
- формирование устной речи: формулирование вопроса и ответа на вопрос;
- перенесение информации с учебной и справочной литературы в опорную схему;
- владение способами самоконтроля и самооценки;
- умение работать в группе.
Тип урока: комбинированный.
Методы: обьяснительно - иллюстративный, частично - поисковый.
Оборудование: компьютер, мультимедийный проектор, электронная презентация, дидактический материал
1 этап. Организационный момент – 1 мин
Учитель: Доброе утро. Садитесь. Готовьтесь к уроку (наличие учебных принадлежностей).
Работа с дежурным класса (отсутствующие).
2 этап. Актуализация знаний(4-5мин)
Учитель: Ребята, сегодня на уроке мы с вами продолжим знакомство с химическими элементами. Отгадывая загадки, вы определите тему нашего урока.
Фтор:
Я - светло-желтый газ
Во мне горит вода.
Всех, кто стоит мне на пути
Окислю я всегда.
Хлор:
Меня применяли даже в войну,
Я резкий, удушливый газ.
Мой запах и желто-зеленый цвет
Очень опасен для вас!
Бром:
В парах моих сгорает медь
Я бурый, прямо как медведь.
Открыт давно я был Баларом
И «бромосом» меня назвал он.
Йод:
Единственный похож я на металл,
Хотя металлом вовсе не являюсь.
В пробирку положите мой кристалл,
При нагревании легко я возгоняюсь.
Астат:
Я –самый редкий на Земле,
Ну что сказать вам обо мне,
Меня всего 16/100 (шестнадцать сотых) грамм,
За это в книгу Гинесса попал.
Учитель: Вы правильно угадали все химические элементы. Их называют галогены. Галогены герои нашего урока. Запишите в тетради тему урока «Общая характеристика галогенов».
3 этап. Изучение нового материала - 25 мин
Учитель: Элементы периодической системы – фтор, хлор, бром, йод и астат типичные неметаллы – называют галогенами - что в переводе с греческого означает «рождающие соли». Действительно, при взаимодействии галогенов с металлами возникает ионная химическая связь и образуются соли (вспомним из курса 8 класса образование ионной связи, с образованием соли).
План нашего урока:
Положение в ПСХЭ
Физические свойства
История открытия галогенов
Галогены в природе.
Химические свойства
Применение
Биологическая роль
Получение
Заключение
Слайд № 2
Учитель: Мы сейчас рассмотрим положение галогенов в ПСХЭ Менделеева и строение атома.
Перед вами Задание 1. (зашифрованное письмо) В 7-этажном доме на улице имени Д.И. Менделеева в 7 подъезде жили химические элементы – галогены. Расселились они по этажам, соблюдая строгую субординацию и в зависимости от своего богатства и прихотей. Те, которые очень любят полетать – повыше, которым это удается с трудом, расположились на нижних этажах. Но вместе их объединила очень важная особенность.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия. Дайте характеристику по положению в ПСХЭ.
Учащиеся: Галогены расположены в периодической системе Д.И.Менделеева в 7 группе главной подгруппе. Окислительные свойства галогенов возрастают в ряду от астата к фтору. Фтор самый сильный окислитель, астат самый слабый окислитель. Общее у них на внешнем энергетическом уровне по 7 электронов – они все могут проявлять степень окисления -1, т. е принимать один электрон.
Учитель: Давайте рассмотрим строения атома фтора, хлора, брома.
(работают с ПСХЭ, в тетради записывают строение атомов галогенов. У доски один ученик выполняет задание)
Учитель: Фтор проявляет только окислительные свойства, остальные галогены проявляют и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом. Поэтому их с. о. могут принимать значения +1,+3,+5,+7. Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с увеличением радиусов их атомов: атомы хлора примерно в полтора раза меньше, чем йода.
Слайд № 3
Физкультминутка
Учитель: Перед вами Задание 2. Физические свойства (работа с учебником).
Галогены не любят показывать свое лицо, обычно они прячутся за спинами других. Иногда, в экстремальных обстоятельствах, они появляются на свет и тогда все любуются их красивыми нарядами, но при этом страдают от крайне неприятного запаха.
Задание: Обсудите информацию, зашифрованную в этом тексте. Перескажите этот текст, используя химические термины и понятия.
Учащиеся: В этом задании речь идет о физических свойствах галогенов.
Учитель: Все верно, давайте рассмотрим физические свойства галогенов у доски и используя таблицу №7 на стр. 105 учебника.
(Один ученик работает у доски, ему помогает класс)
Учащиеся формулируют вывод: с увеличением молекулярной массы галогена повышается их температура плавления и кипения, возрастает плотность фтор и хлор – газы, бром-жидкость, йод - твердое вещество. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия между ними.
Слайды № 4
История открытия (сообщение ученика)
| Фтор | 1866 г. | “Фторос” - разрушающий. Анри Муассан был удостоен Нобелевской премии за открытие фтора. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз его был закрыт черной повязкой. В истории фтора немало трагических страниц. |
| Хлор | 1774 г. | “Хлорос” - желто-зеленый, открыл Шееле |
| Иод | 1811 г. | “Иодэс” - фиолетовый, открыл Куртуа. Любимый кот ученого прыгнул на бутылки, содержащие золу морских водорослей в спиртовом растворе и концентрированную серную кислоту. Бутылки разбились, жидкости смешались, с пола стали подниматься клубы сине-фиолетового пара, который и оказался иодом. |
| Бром | 1826 г. | “Бромос” - зловонный, открыл Балар. Получен при исследовании жидкости из растворенной в воде золы морских водорослей (при пропускании через нее хлора).
|
|
|
|
|
Слайды № 5- 9
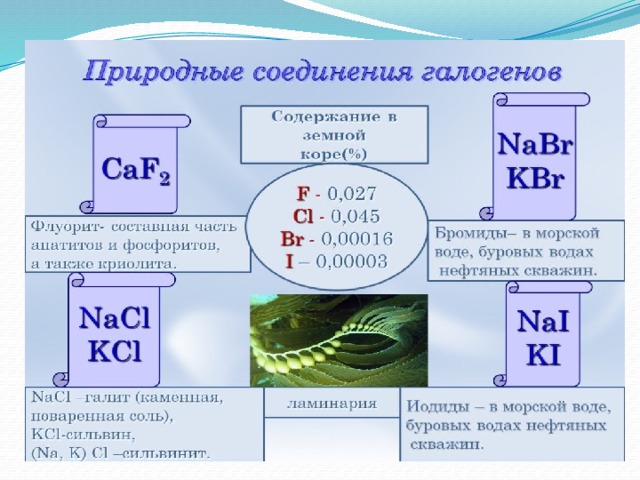
Учитель: Ребята, могут галогены в природе встречаться в свободном виде?
Учащиеся: Нет, т.к. у них ярко выражены окислительные свойства, химически очень активны.
Галогены в природе. Слайды №10-11
Учитель: Химическая активность галогенов от фтора к йоду ослабевает.
Переходим к химическим свойствам, более подробно рассмотрим свойства фтора и хлора.
Каждый галоген является самым сильным окислителем в своем периоде, Окислительные свойства отчетливо проявляются при взаимодействии с металлами, при этом, как вы уже знаете, образуются соли. Так, фтор при обычных условиях реагирует с большинством металлов, при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью.
Уравнения реакции приведены в презентации к уроку
Слайды № 12, 13
(Учитель демонстрирует видео-фрагменты: «Взаимодействие брома с алюминием», «Взаимодействие хлора с железа с бромом», «Взаимодействие хлора с калием», «Вытеснение бромом иода»)
Применение галогенов. Слайд №14-17
Биологическое значение. Слайд №18
Получение галогенов. Слайд № 19
4 этап. Закрепление – 10 мин
Отгадайте кроссворд
↓ - По вертикали Вводное слово: Роль галогенов в окислительно-восстановительных реакциях
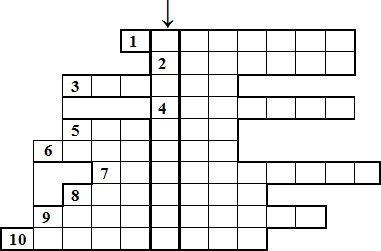
По горизонтали:
1.Явление перехода твердого вещества в газообразное, минуя жидкое, характерное для
кристаллического йода.
2.Органическое вещество, полисахарид, синеющее под действием свободного йода.
3.Заболевание зубов, часто вызываемое недостатком фтора.
4.Желудочная кислота, содержащая один из галогенов.
5.Огнеупорная пластмасса, содержащая фтор, применяемая для изготовления сковород и кастрюль.
6.Общее название соединений брома с металлами.
7.Важная железа эндокринной системы, содержащая йод.
8.Цвет газообразного хлора.
9.Вид ковалентной связи в молекулах галогенов.
10.Природный минерал состава KCl ∙ NaCl, применяемый как минеральное
Заключение. Слайд №20
5 этап. Рефлексия-3 мин
Учитель: Подведем итог урока.
Учитель задаёт вопросы:
Достигли ли мы цели урока?
Просит учащегося провести самооценку,
проанализировать ошибки и осуществить рефлексию урока смайликами.
6 этап. Домашнее задание – 2 мин
П.22,24, заполнить таблицу
| Галоген | Происхожде- ние названия | История открытия | Физические свойства | Примене-ние | Биологиче- ская роль: |