Урок по химии в 10-м классе по теме
«Ацетилен»
-
| ФИО | Аксенова Ирина Ивановна |
-
| Место работы | Муниципальное казенное общеобразовательное учреждение «Кожурлинская средняя школа» Убинского района Новосибирской области |
-
| Должность | Учитель |
-
| Предмет | Химия |
-
| Класс | 10 класс |
-
| Тема урока | Ацетилен |
-
| Базовый учебник | Габриелян О.С «Химия» учебник для учащихся 10 класса общеобразовательных учреждений Дрофа, 2011 – 271с. |
Тип урока: Урок совершенствования знаний и изучения нового материала (комбинированный)
Технология: На уроке используется технология проблемного обучения. Постановка проблем, проблемных вопросов, проблемных ситуаций стимулирует поиск недостающих знаний, активизирует мыслительную деятельность учащихся, способствует их развитию. Создавая проблемную ситуацию, учитель направляет учащихся на ее решение, организует поиск решения. Взаимоотношения с классом строит так, чтобы ученики могли проявлять инициативу, высказывать свои предположения, даже если они вызывают сомнения.
Форма учебной деятельности: индивидуальная, групповая.
Методы: проблемно – поисковый, исследовательский.
Оборудование: мультимедийный проектор, компьютер, интерактивная доска SMART BOARD, модели молекул Стюарта-Бриглеба (где атомы представлены в виде усеченных сфер с учетом атомных радиусов (в масштабе0,1 нм = 1,5 см).). Урок сопровождается презентациями в программах SMART Notebook 10 и Power Point,а также применением модулей с сайта Коллекция ФЦИОР
Цели урока: Изучить химические свойства ацетилена с опорой на его применение в народном хозяйстве, электронное и пространственное строение его молекулы.
Закрепить умение выводить формулу органического вещества по массе элементов. Познакомить учащихся с гомологическим рядом, изомерией и номенклатурой алкинов. (слайд №1 Power Point)
Задачи урока:
- образовательная – закрепление понятия непредельные углеводороды, изучение свойств и применения ацетилена.
- развивающая – формирование навыков работы с компьютером и мультимедийным проектором, в процессе урока акцент на работу критического мышления обучающихся.
- воспитательная – положительная мотивация к обучению через информационную среду Интернет пространства.
План урока:
| № п\п | Части-блоки урока (краткое содержание деятельности учителя и учащихся) | № слайда презентации | Время реализации (минут) |
| 1. | Организационный момент: приветствие, цели урока, постановки краткого плана урока.
| 1 Power Point | 3
|
| 2 | Опрос домашнего задания |
| 5 |
| 3 | Формулирование темы урока | 2-3 Power Point | 3 |
| 4 | Объяснение нового материала. | 4-10 Power Point | 10 |
| 5 | Составление шаростержневой модели ацетилена | 1 SMART Notebook 10 | 5 |
| 6 | Закрепление и обобщение нового материала. | 2 SMART Notebook 10 11 Power Point | 5 |
| 7 | Домашнее задание | 12 Power Point | 4 |
| 8 | Подведение итогов урока |
| 3 |
| 9 | Резерв времени |
| 2 |
Ход урока:
Опрос домашнего задания
1 .Учащийся представляет свою презентацию по теме «Натуральный и синтетический каучуки».
2. В это время другой учащийся решает у доски задачу на определение формулы вещества:
Задача: Относительная плотность паров углеводорода по азоту равна 4. При сжигании 11,2г этого соединения образовалось 35,2г оксида углерода (IV) и 14,4г воды. Установите молекулярную формулу этого соединения.
3. Учитель проверяет выполнение письменного домашнего задания в рабочих тетрадях трёх учащихся.
2.Основная часть
Загадка: Горит с образованием воды и углекислого газа, но не алкан; обесцвечивает бромную воду, но не алкен; подчиняется общей формуле С n Н 2n-2 , но не алкадиен. Подсказка – содержит два атома углерода.
Учащиеся отгадывают загадку.
- горит с образованием воды и углекислого газа – УГЛЕВОДОРОД
- обесцвечивает бромную воду -- НЕПРЕДЕЛЬНЫЙ
- подчиняется общей формуле CnH2n-2 и содержит два атома углерода
Ответ: СН ≡ СН или С2Н2 (слайд №2 Power Point)
Название этому веществу дал в 1860 году французский химик Марселен Бертло. Ацетилен. И это - тема нашего урока. (слайд №3 Power Point)
Напоминаю учащимся о том, что мы продолжаем изучать раздел органической химии «Углеводороды »
Применение ацетилена и его химические свойства
Методически оправданным приёмом при ознакомлении учащихся с химическими свойствами ацетилена может быть демонстрация его свойств в связи с применением в народном хозяйстве.
1.Ацетилен применяют для получения хлорвинила, который используют для получения полихлорвинила.
Поливинилхлорид (ПВХ, полихлорвинил — бесцветная, прозрачная пластмасса, термопластичный полимер винилхлорида.
Из поливинилхлорида получают пластмассу, искусственную кожу, клеёнку(слайд №4 Power Point).
2.Ацетилен является сырьём для производства ацетальдегида, из которого затем получают этиловый спирт, уксусную кислоту, пластмассы. 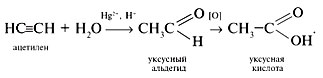 Катализаторы — обычно соли ртути (Hg2+). Реакция открыта русским химиком М. Г. Кучеровым в 1881 году (слайд №5 Power Point).
Катализаторы — обычно соли ртути (Hg2+). Реакция открыта русским химиком М. Г. Кучеровым в 1881 году (слайд №5 Power Point).
3.Полимеризация
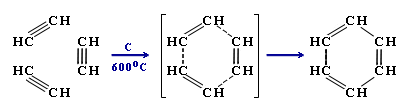 Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского) (слайд №6 Power Point):
Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского) (слайд №6 Power Point):
Димеризацией ацетилена в присутствии солей одновалентой меди и хлорида аммония в водной среде в промышленности получают винилацетилен: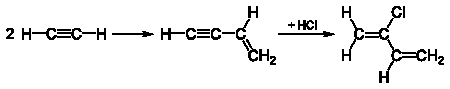 (слайд №7 Power Point)
(слайд №7 Power Point)
4. При горении ацетилена в токе кислорода развивается очень высокая температура (около3000 град.), поэтому кислородно - ацетиленовое пламя используют для автогенной сварки и резки металлов.
2СН ≡ СН + 5О2 → 4СО2 + 2Н2О
(слайд №8 Power Point)
5. Из ацетилена получают ацетиленид меди, который применяют в качестве катализаторов в органическом синтезе.
СН ≡ СН + 2CuCI → CuC ≡ CCu ↓ + 2HCI Ацетиленид меди(I) — красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. При детонации в отсутствие кислорода не образуется газообразных веществ. Применяется как катализатор в органическом синтезе (слайд №9 Power Point).
Получение ацетилена Итак, сама жизнь поставила перед химиками задачу получения в больших количествах дешевого и доступного ацетилена. Карбидный и метановый способы получения ацетилена - это усовершенствованные методы Дэви и Бертло. Карбидный способ
основан на взаимодействии карбида кальция с водой: (модуль N 131988)
СаС2 + 2 Н2О ¾® С2Н2 + Са(ОН)2
карбид кальция ацетилен
В промышленности карбид кальция получают сплавлением оксида кальция (негашеной извести) с коксом (углеродом):
to
СаО + 3 С ¾® СаС2 + СО
В промышленном масштабе ацетилен получают метановым методом: пропусканием газообразного метана в специальных реакторах через зону с высокой (1500оС) температурой:
to
2 СН4 ¾® С2Н2 + 3 Н2
Строение молекулы ацетилена
Методический приём. Строение молекулы вещества изучается после того, как учащиеся узнали о его химических свойствах. Тогда урок-лекция превращается в урок- диспут, урок-исследование. На основании химических свойств учащиеся делают предположения о причинах такого поведения вещества. Несомненно, учащиеся не могут ответить на все вопросы. В теме «Ацетилен» это вопрос о причинах вступлении ацетилена в реакции замещения.
Мы рассмотрели особенности химического поведения ацетилена. А чем эти особенности определяются? Конечно же, его строением.
Чтобы понять строение молекулы ацетилена, схематически покажем, как она образуется из двух молекул метана:
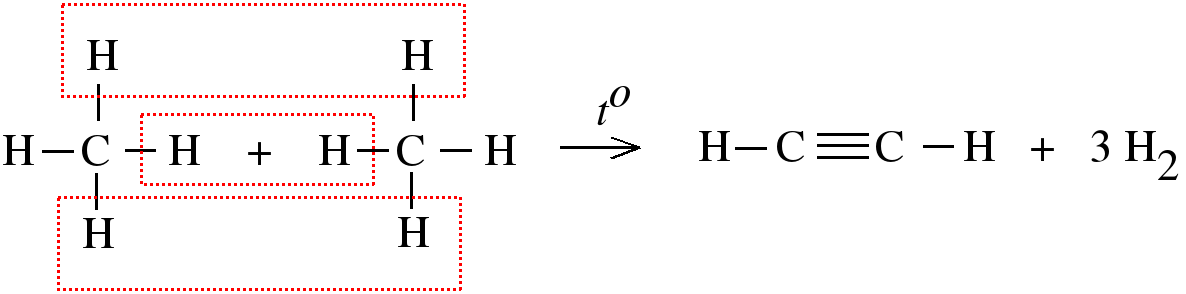
К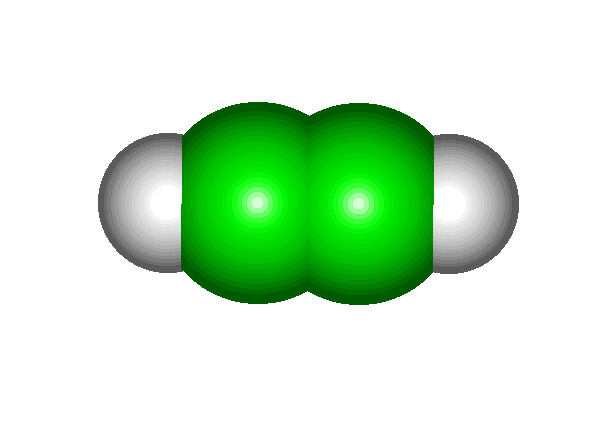 ак видите, два атома углерода в молекуле ацетилена связаны тремя химическими связями. Иначе говорят, что между атомами углерода имеется тройная связь.
ак видите, два атома углерода в молекуле ацетилена связаны тремя химическими связями. Иначе говорят, что между атомами углерода имеется тройная связь.
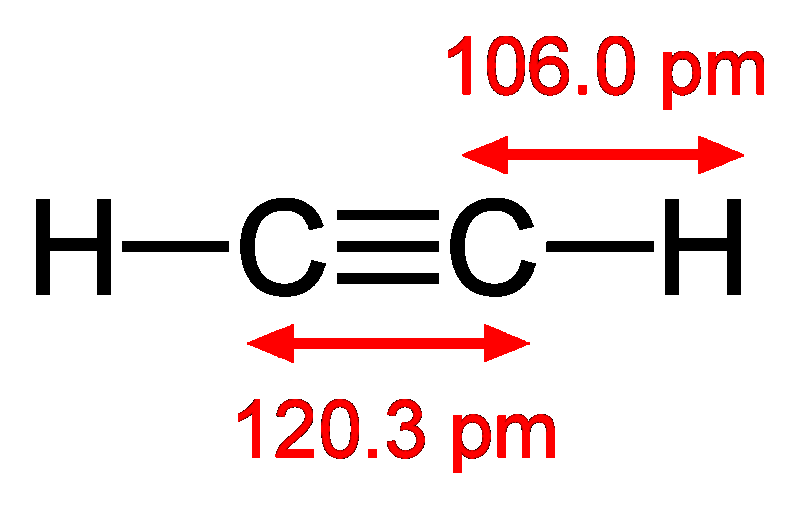 (слайд №10 Power Point)
(слайд №10 Power Point)
Чтобы закрепить знания о строении молекулы ацетилена, ученики поочередно у интерактивной доски составляют
Бертло первым высказал предположение о том, что ацетилен, подобно метану и этилену, является родоначальником гомологического ряда ацетиленовых углеводородов
3.Закрепление изученного материала
Методически оправданным приёмом при закреплении нового материала является вопрос к изученной теме. Например, заранее оговаривается, что учащиеся сначала озвучивают пять вопросов по новой теме, на которые они уже могут ответить сами, а затем задают учителю три вопроса, на которые ещё не получили ответа.
К каким углеводородам относятся алкины?
Какая особенность в строении алкинов?
Какая общая формула соединений алкинов?
Каковы их химические свойства?
Где применяют ацетилен?
(слайд №2 SMART Notebook 10)
Алкины – ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода, и соответствующие общей формуле Сn Н2n-2 (слайд №11 Power Point)
Урок заканчивается тем, что учащиеся, исходя из строения ацетилена, высказывают свои предположения о других химических свойствах, которые есть у этого вещества.
4.Домашнее задание: (слайд №12 Power Point)
1. Составить авторский опорный конспект по новому материалу (§ 6 )
2. По желанию подготовить дома презентацию с дополнительным материалом по изученной теме.
3. Если дома есть выход в Интернет, найти дополнительные сведения о применении ацетилена (адреса некоторых сайтов на экране)
Завершение урока: Учитель благодарит учащихся за урок, отмечает работу наиболее активных учащихся, выставляет им оценки.
Используемая литература
1. Беспалов П.И. Модульные программы при изучении органической химии. Ч. 1 – М.: Центрхимпресс, 2003.
2.Габриелян О.С., Остроумов И.Г., Карцова А.А. 10 класс: органическая химия. – М.:Просвещение, 2003.
3. Габриелян О.С. Химия. 10 класс: рабочая тетрадь к учебнику
4. Дмитров Е.Н. Познавательные задачи по органической химии и их решения: Пособие для учителей и учащихся.– Тула: Арктоус, 1996. 86 с.
5. Кузьменок Н.М., Стрельцова Е.А., Кумачев А.И. Экология на уроках химии. – Мн.:Изд. ООО “Красико-принт”, 1996.
Электронные учебные пособия:
6. Химия (8–11-й класс). Виртуальная лаборатория.
7. Лаборатория систем мультимедиа, МарГТУ, 2004.
8.Коллекция ФЦИОР
Пояснительная записка
Работа представлена по естественно - научному направлению.
Тема урока «Ацетилен». Урок проводится в 10 общеобразовательном классе. В классе обучаются 3 человека. Все ученики добросовестно относятся к учебе. .
Общий уровень развития учащихся – средний, интересы разнообразные. В классе ведется работа по формированию общественного мнения, где дети учатся высказывать свои суждения, отношения к поступкам некоторых учеников, оценивать работу товарищей.
Количество уроков химии в неделю-2, в год - 68 часов
Обучение ведётся по Программе О.С. Габриелян, химия 10 класс, базовый уровень знаний.
Учебник О.С. Габриелян, Органическая химия, 10 класс, базовый уровень. Данный учебник для общеобразовательных учебных заведений создан на основе стандарта среднего (полного) общего образования.
Изучаемый материал относится к разделу «Углеводороды».
Приложения
Приложение 1.Описание приёма обучения « Применение – свойства – строение»
Классическим способом распределения блоков учебного материала в темах, посвящённых конкретному веществу, является «Строение – свойства – применение».
Так излагается материал практически во всех учебниках химии, по которым занимаются учащиеся 8-11 классов общеобразовательных школ. Причём каждый блок излагается в учебнике, а, значит, и изучается без какой-либо связи друг с другом.
Опыт моей работы показывает, что блок «Химические свойства» большинству учащихся общеобразовательных классов даётся с трудом. Некоторые из них задают вопросы « Зачем нужно знать столько уравнений? » или « Как можно запомнить столько формул? ».
Учитель же считает этот блок одним из самых важных и требует от учащихся знаний основных химических свойств вещества.
В то же время блок «Применение» рассматривается в конце параграфа и представляет собой перечень областей применение изучаемого вещества. Иногда этот перечень сопровождается схемой.
Такой подход к изложению нового материала приводит к отрыву теоретических знаний от практической значимости данного вещества.
В жизни происходит всё иначе. Вначале перед химиками ставится задача получить новое вещество, потому, что оно кому-то нужно (применение), а затем его получают, используя химические свойства исходных веществ.
Изучать химические свойства вещества целесообразно после знакомства с его применением, отвечая на вопрос «Почему это возможно?» Пример изучения блока «Химические свойства углерода»:
|
| Тема урока | Применение | Химические свойства, на которых основано применение | Строение |
| 1 | Углерод | В качестве топлива | С + O2 = CO2 | В атоме углерода на внешнем энергетическом уровне 4 электрона, в реакциях он может выполнять роль окислителя или восстановителя |
|
|
| В металлургии для получения металлов | 2Fe2O3 + 3С = 4Fe + 3CO2 |
|
|
| Производство карбида кальция | CaO + 3C = CaC2 + СО |
|
|
| Получение растворителя сероуглерода | С + 2S = CS2 |
Приложение 2. Описание приёма объяснения блока «Особенности строения молекулы ацетилена»
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
Некоторые отличия в свойствах алкинов и алканов определяются следующими факторами:
1.p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
2.p-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения.
3.Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах.
Приложение 3. Описание организации творческой деятельности учащихся на уроке
Источник развития ученика – специально организованное обучение, в котором осуществляется его творческая деятельность, воплощающая в себе умственную активность, изобретательность, смекалку, стремление добывать знания.
Процесс развития личности ученика в обучении рассматривается как процесс созидания чего-то нового для него в познавательной и предметной деятельности. “Творчество – это всякая деятельность человека, который создает нечто новое, будет ли это созданием какой-либо вещи внешнего мира или построение ума или чувства, живущего в самом человеке”, - писал в свое время Л. С. Выготский.
Выражением творческого процесса в обучении выступает созданный учеником творческий продукт. Развиваясь как субъект творческой деятельности ученик становится все более свободен в выборе цели и способов их достижения. Наивысших ступеней он добивается, когда главной ценностью для него становится саморазвитие, когда он способен рефлексивно относится к своей деятельности. Источник развития – специально организованное обучение, в котором создаются условия для саморазвития личности.
Работа по развитию творчества учащихся начинается с домашнего задания: подготовить самостоятельно мультимедийную презентацию по изученной теме. Такой вид деятельности обучающихся стал системным. Учащиеся 10 класса хорошо владеют компьютерами и техникой создания презентаций. В то же время в общеобразовательном классе большинство учащихся углубленному изучению теоретических основ химии и решению задач предпочитают добывание из сети Интернет знаний, связанных с применением и свойствами веществ.
Развитие творческих способностей учащихся на уроке продолжается при закреплении нового материала. Учитель предлагает задавать вопросы, ответы на которые не были даны в ходе объяснения новой темы. Такая постановка задания предполагает не только осмысления нового материала, но и творческого подхода к самостоятельному добыванию информации через учителя.







 Катализаторы — обычно соли ртути (Hg2+). Реакция открыта русским химиком М. Г. Кучеровым в 1881 году (слайд №5 Power Point).
Катализаторы — обычно соли ртути (Hg2+). Реакция открыта русским химиком М. Г. Кучеровым в 1881 году (слайд №5 Power Point). Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского) (слайд №6 Power Point):
Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского) (слайд №6 Power Point): (слайд №7 Power Point)
(слайд №7 Power Point)
 ак видите, два атома углерода в молекуле ацетилена связаны тремя химическими связями. Иначе говорят, что между атомами углерода имеется тройная связь.
ак видите, два атома углерода в молекуле ацетилена связаны тремя химическими связями. Иначе говорят, что между атомами углерода имеется тройная связь. (слайд №10 Power Point)
(слайд №10 Power Point)









