Открытый урок по теме «Окислительные свойства концентрированной серной кислоты»
Дата: 24.04.2023г
Предмет: химия
Класс: 8
Учитель: Эмирбекова З.А.
Цель: изучение свойств концентрированной серной кислоты, действие ее на металлы, выявить отличительные свойства от разбавленной серной кислоты.
Задачи:
-
образовательная: расширить знания, учащихся о свойствах концентрированной серной кислоты, развить умения выделять существенные признаки, анализировать факты, делать выводы;
-
воспитательная: развивать познавательный интерес к химии, коммуникативные качества, умение работать в команде, воспитать у учащихся уверенность в себе, ввести прием оценивания как фактор реализации принципа психологической комфортности;
-
развивающая: формировать навыки самостоятельной работы с учебным материалом и инструкциями к лабораторным опытам.
Тип урока: Урок – исследование особых свойств концентрированной серной кислоты.
Межпредметные связи: экологические проблемы, связанные с производством и использованием серной кислоты.
Формы организации познавательной деятельности: фронтальная с элементами индивидуальной и групповой.
Методы: лабораторные опыты с элементами беседы, исследовательская работа, самостоятельная работа
Средства обучения: оборудование и реактивы для опытов, дидактический материал, мультимедийная презентация.
Эпиграф«Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опыта необходимо».
А.М.Бутлеров.
Ход урока
-
Организационно-мотивационный момент.
Сегодня объектом нашего внимания будет необыкновенная особа (показать в колбе раствор серной кислоты), которая появилась в поглотительной башне. Её папа Оксид серы(YI) был мужчиной злого нрава и носил прозвище Серный ангидрид. Её мама была простой, спокойной женщиной, звали её Вода. Союз оксида и воды привёл к появлению нашей незнакомки, которую назвали (ответ учащихся).
Вот с этой кислотой, которую во времена Петра I привозили в Россию из-за границы, называемую «купоросным маслом», мы и продолжим знакомство. Современное название этого вещества – серная кислота.
- Что вам известно о серной кислоте и что бы еще хотели узнать? (изучить свойства разбавленной и концентрированной кислот, и выяснить чем они отличаются). Чтобы закрепить уже изученные свойства серной кислоты, предлагаю вам дописать следующие уравнения реакций и составить для них ионные уравнения:
-
MgO + H2SO4 =
-
Ca(OH)2 + H2SO4 =
-
K2CO3 + H2SO4 =
-
Na2S + H2SO4 =
-
Ba(NO3)2 + H2SO4 =
Тема нашего урока «Окислительные свойства серной кислоты»
1. Постановка целей и задач.
-Итак, свойства разбавленной и концентрированной серной кислоты отличаются между собой. Почему? Это нам предстоит сегодня выяснить.
III.Инструктаж по технике безопасности и ходу работы.
-Так как мы работаем с кислотой, какие правила техники вы должны соблюдать? (При работе с серной кислотой следует соблюдать особую осторожность. Поэтому попавшую на кожу или одежду концентрированную серную кислоту следует немедленно смыть большим количеством воды).
-Сейчас мы с вами проведем реакции, подтверждающие окислительные свойства разбавленной и концентрированной серной кислоты.
Разбавленная серная ведет себя, как и остальные кислоты, окислительные свои возможности прячет:
Zn + H2SO4 → ZnSO4 + H2↑
И еще, что надо помнить про разбавленную серную кислоту: она не реагирует со свинцом. Кусок свинца, брошенный в разбавленную H2SO4 покрывается слоем нерастворимого (см. таблицу растворимости) сульфата свинца и реакция моментально прекращается.
Pb + H2SO4 ≠
Лабораторный опыт: (соблюдайте правила ТБ)
Свойства разбавленной серной кислоты
-
В две пробирки налейте по 1-2 мл разбавленного раствора серной кислоты.
-
В первую пробирку положите 1 гранулу цинка, во вторую -немного стружек меди .
-
Запишите уравнения химических реакций.
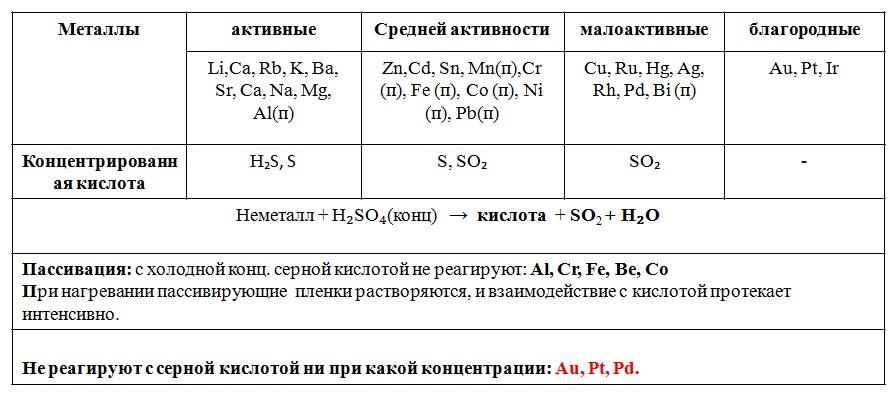
Взаимодействие концентрированной серной кислоты с металлами.
За счет серы в степени окисления +6 (высшей) серная кислота приобретает сильные окислительные свойства.
Эти реакции строго стандартизированны и идут по схеме:
H2SO4(конц.) + металл → сульфат металла + H2O + продукт восстановленной серы.
Есть два нюанса:
1) Алюминий, железо и хром с H2SO4 (конц) в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2) С платиной и золотом H2SO4 (конц) не реагирует вообще.
Сера в концентрированной серной кислоте – окислитель значит, сама будет восстанавливаться;
то, до какой степени окисления будет восстанавливаться сера, зависит от металла.
До -2 серу могут восстановить только очень активные металлы — в ряду напряжений до алюминия включительно.
Реакции будут идти вот так:
8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
8Al + 15H2SO4(конц.) (t)→ 4Al2(SO4)3 + 12H2O + 3H2S↑
при взаимодействии H2SO4 (конц) с металлами в ряду напряжений после алюминия, но до железа, то есть с металлами со средней активностью сера восстанавливается до 0:
3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
3Zn + 4H2SO4(конц.) → 3ZnSO4 + 4H2O + S↓
все остальные металлы, начиная с железа в ряду напряжений (включая те, что после водорода, кроме золота и платины, конечно), могут восстановить серу только до +4.
Так как это малоактивные металлы:
2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO2↑ (обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)
Cu + 2H2SO4(конц.) → CuSO4 + 2H2O + SO2↑
2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2↑
H2SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO2:
C + 2H2SO4(конц.) → CO2↑ + 2H2O + 2SO2↑
2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑
Свежеобразованный оксид фосфора (V) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
2P + 5H2SO4(конц) → 2H3PO4 + 2H2O + 5SO2↑
То же самое с бором, он превращается в ортоборную кислоту:
2B + 3H2SO4(конц) → 2H3BO3 + 3SO2↑
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). Сера 0 будет окисляться, а сера +6 будет восстанавливаться, то есть понижать степень окисления. Будет выделяться сернистый газ: 2H2SO4(конц.) + S → 3SO2↑ + 2H2O
Но в случае с сероводородом:
H2SO4(конц.) + H2S → S↓ + SO2↑ + 2H2O
Лабораторный опыт: (соблюдайте правила ТБ)
Окислительные свойства концентрированной кислоты серной кислоты.
-
В две пробирки налейте по 1-2 мл концентрированной серной кислоты. В первую пробирку добавьте гранулу цинка, во вторую –немного порошка меди.
-
Как концентрированная серная кислота относится к данным металлам?
-
Запишите уравнение реакции с медью, цинком (используя таблицу).
-
Расставьте коэффициенты методом электронного баланса.
V. Отношение концентрированной кислоты к органическим веществам. (Демонстрация опыта учителем).
Описание опыта «Обугливание сахара». Оборудование: стакан, стеклянная палочка.
Реактивы: концентрированная серная кислота, сахарная пудра, вода.
Ход работы:
Смешать 20 г сахарной пудры, 3 мл воды, 10 мл серной кислоты, оставить стеклянную палочку в стакане. Наблюдается обугливание массы и увеличение ее в объеме.
Н2SO4 (концентрированная) обугливает органические вещества.
Опустим лучину в концентрированную Н2SO4. Результат – мы видим обугливание древесины. Такое же воздействие происходит на другие органические вещества: сахар, кожу, ткани. Древесина состоит из множества органических веществ, среди которых – целлюлоза (C6H7O2(OH)3)n . Концентрированная серная кислота разрушает органические молекулы, отнимая водород и кислород – составляющие воды. Разрушение органических молекул сопровождается выделением свободного углерода. Поэтому лучинка при соприкосновении с концентрированной серной кислотой чернеет, обугливается.
Опыт «Дым без огня»
Реактивы: поваренная соль, концентрированная серная кислота, нашатырный спирт.
На дно стакана поместить поваренную соль, добавить концентрированную серную кислоту, после появления дыма хлороводорода внести, смоченную нашатырным спиртом, вату в стакан, появляется дымок – это хлорид аммония.
Очень часто применяют данный опыт фотографы, при съемках пейзажей, создавая эффект тумана.
VI. Закрепление в виде экспресс-опроса.
-
Какой по силе является серная кислота?Серная кислота является сильной кислотой.
-
Какие реакции 3-х типов характерны серной кислоте?В ступает в реакции трех типов: кислотно-основные, ионные, окислительно-восстановительные.
-
С какими веществами реагирует серная кислота?Реагирует с металлами, с основаниями и с основными оксидами.
-
Как можно обнаружить серную кислоту и ее соли?Для определения серной кислоты служат ионы бария. Выпадает белый осадок
-
Какой элемент является окислителем у разбавленной серной кислоты и у концентрированной серной кислоты?У концентрированной серной кислоты окислителем является элемент образующий кислотный остаток - SO42-, за счет атома серы в максимальной степени окисления. Окислительные свойства SO42- значительно выше, чем иона водорода Н+.
-
Каковы особые свойства концентрированной серной кислоты?Концентрированная серная кислота взаимодействует практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после водорода, кроме золото и платины, также с многими неметаллами. Концентрированная кислота очень гигроскопична: энергично поглощает влагу и отнимает воду от многих органическихвеществ. Кроме того, благодаря этой способности, концентрированная серная кислота обугливает органические вещества (сахар, древесину), вызывает сильные ожоги кожи.
На этапе обобщения и систематизации знаний, учащиеся проводят экспертизу полученных результатов и делают вывод: Серная кислота является сильной кислотой. В ступает в реакции трех типов: кислотно-основные, ионные, окислительно- восстановительные. Реагирует с металлами, с основаниями и с основными оксидами. Для определения серной кислоты служат ионы бария. Выпадает белый осадок. У концентрированной серной кислоты окислителем является элемент образующий кислотный остаток - SO42- , за счет атома серы в максимальной степени окисления. Окислительные свойства SO42- значительно выше, чем иона водорода Н+, поэтому концентрированная серная кислота взаимодействует практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после водорода, кроме золото и платины, также с многими неметаллами. Учащиеся записывают вывод в таблицу.
-
Почему склянку с концентрированной серной кислотой нельзя оставить открытой?
-
Почему не замерзнет стекло, если стакан с концентрированной серной кислотой поставить зимой между рамами?
-
Какую серную кислоту надо взять, чтобы растворить ртуть: концентрированную или разбавленную?
-
Какую первую помощь необходимо оказать при попадании кислоты на кожу рук?
-
Объясните образование «химического молока» при сливании сульфата натрия и хлорида бария?
VII. Домашнее задание
1. Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты:
1. AI + H2SO4 (конц.) →
2. Ag + HNO3 (конц.) →
3. KBr + KMnO4 + H2SO4 → … +Br2 +K2SO4 + H2O
2. Учебник: учить стр.128-135
VIII.Рефлексия.
1. Усвоил полностью
2.В основном усвоил, но требуется ещё разобрать дома
3. Не понял тему
4. Очень было интересно выполнять опыты.


























