Тема урока: Коррозия металлов и меры её предупреждения.
Задачи урока:
1.Образовательная: сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её значении, причинах, механизме и способах защиты; показать влияние на скорость коррозии таких факторов, как природа веществ, температура и присутствие катализатора (ингибитора).
2.Развивающая:
развить умение проведения химического эксперимента с соблюдением правил техники безопасности, строить логические цепочки и выводы из наблюдений, прогнозировать решение некоторых проблем.
3.Воспитательная: совершенствовать коммуникативные умения в ходе коллективного обсуждения, продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
Оборудование: компьютер, интерактивная доска , оборудование и реактивы для лабораторного эксперимента, презентация к уроку.
Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод и сопровождение лабораторного проблемного эксперимента.
Тип урока: изучение нового материала.
Ход урока:
I. Мобилизирующий момент.
II. Проверка ЗУН:
1.Какова доля железа в земной коре: 5%
2.Минералы, содержащие железо: красный железняк, магнитный железняк, пирит
3.Где в Казахстане имеется запасы железных руд: в Торгайском железорудном бассейне,
Центр. Казахстане
4.Сколько граммов железа в теле человека: 4-5г
5.Где содержится железо в организме человека; в клетках крови
6.Болезнь, связанная с недостатком железа в крови: анемия
7.В каких продуктах большое содержание железа: в печени, мясе (кролика, индейки), крупах, чернике, персиках, икре осетровых рыб.
Задание: Из предложенных формул соединений составьте генетический ряд Fe 2+ (для первого варианта) и генетический ряд Fe 3+(для второго варианта)
Fe(OH)2, Fe, Fe(OH)2, FeCl3, Fe2O3, FeCl2, FeO
Задание: Написать уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
Fe → FeCl3 →Fe(OH)3 →Fe2O3 →Fe →FeSO4 →Fe(OH)2 → FeO → Fe → Fe3O4
Задача 1. Железную пластинку массой 5 г поместили в раствор, содержащий 1,6 г сульфата меди. Найти массу пластинки после окончания реакции.
Задание: В уравнении химической реакции расставить коэффициенты методом электронного баланса: Fe2O3 + KOH + KNO3 → K2FeO4 + KNO2 + H2O
III. Объяснение материала:
31 января 1951 г. обрушился железнодорожный мост в Квебеке (Канада ), введенный в эксплуатацию в 1947 г. В 1964 г. рухнуло одно из самых высотных сооружений в мире – 400-метровая антенная мачта в Гренландии.
Из-за повреждений нефтепроводов в реки и на грунт выливается нефть.
Что же объединяет эти примеры? (разрушение металлических изделий)
Железо – элемент, всем хорошо известный. Железо используют как в чистом виде, так и в составе различных сплавов. О значении железа очень ярко сказал академик А.Е.Ферсман: «Я хочу поразить читателя и нарисовать картину того, что было бы с человеком, если бы он вдруг узнал, что все железо на поверхности земли исчезло и что его ниоткуда больше достать нельзя. Правда, он узнал бы это довольно решительным образом, ибо исчезли бы его кровать, распалась бы вся мебель, уничтожились все гвозди, обвалились потолки и уничтожилась крыша. На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, ни паровозов, ни автомобилей, ни экипажей, ни решеток не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без живительного металла. Разрушение ураганом прошло бы по всей Земле, и гибель человека сделалась бы неминуемой».
О коррозии упоминается даже в Ветхом Завете: «не сотвори себе кумира на земле, ибо ржавчина и моль его разрушат»
Хвастается новенький металл:
«Как силен я, смел и как удал! Неподвластен никакой угрозе Кроме рыжей крысы с именем «коррозия».
Итак, тема нашего урока: «Коррозия металлов». Слово коррозия происходит от латинского «corrodere», что означает разъедать.
Коррозия – самопроизвольное разрушение металлов вследствие химического или электрохимического взаимодействия их с окружающей средой. «Поедают» металл все вещества, которые могут с ним реагировать: кислород и вода, кислоты и щелочи, растворы солей (морская вода).
Аппетит у «металлоедов» чудовищный – ежегодно они уносят до 30% производимого металла; 2/3 этого количества в виде металлолома возвращаются в промышленность, а 1/3 теряется безвозвратно. Но убытки этим не ограничиваются. ? Какие еще расходы возникают в результате коррозии?
Стоимость деталей и конструкций, вышедших из строя вследствие коррозии, выше стоимости самого металла. По причине коррозии случаются аварии. Коррозия увеличивает расходы на ремонт машин, на бензин. Значительные средства требует профилактика коррозии. Таким образом, коррозия порождает своеобразную цепную реакцию расходов, которые растут как снежный ком, причем косвенные расходы во много раз превышают прямые.
В зависимости от вызываемых коррозией повреждений поверхности металлов различают следующие ее виды:
равномерную (сплошную),
язвенную,
точечную (питтинг).
Как вы думаете какой вид коррозии самый опасный?Почему? (Питтинг – большая глубина поражения и малая площадь)
По механизму протекания коррозия делиться на два вида: химическую и электро-химическую.
Коррозия - это окислительно-восстановительный процесс, при котором атомы металлов переходят в ионы (идет процесс окисления)
Химическая коррозия – разрушение металла при взаимодействии его с сухими газами или жидкостями, не проводящими электрический ток (например, нефть).
Ей подвергается арматура печей, детали двигателей внутреннего сгорания и аппаратура химической промышленности. При этом происходит окислительно-восстановительные реакции, в ходе которой металл окисляется, а присутствующий в среде окислитель восстанавливается, электроны переходят от металла к окислителю без возникновения в цепи электрического тока.
Демонстрация. Прокалим медную проволоку на воздухе. Что наблюдаете.
Уч-ся: изменение окраски – появление черного налета, значит произошла химическая реакция.
При взаимодействии меди с кислородом идет реакция:
2Cu + O2 → 2CuO (запись в тетради и на доске)
Cu0 – 2e → Cu2+ | 2| - восстановитель, процесс окисления
O20 + 4e → 2O2- | 1| - окислитель, процесс восстановления
Некоторые металлы на воздухе покрываются плотной оксидной пленкой, например алюминий, и металл не корродирует. Что не скажешь о железе – ржавчина не прилегает к металлу, рыхлая, и металл может разрушиться весь. Оксидная пленка оксида железа содержит: FeO, Fe2O3, Fe3O4.
Мы рассмотрели с вами химическую коррозию, а теперь рассмотрим электрохимическую.
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде другого электролита.
В данном случае наряду с химическим процессом идет электрический – перенос электрона, т.е. возникает электрический ток. Этот вид приносит большой вред.
Коррозия металлов в нейтральной и (или) щелочной среде
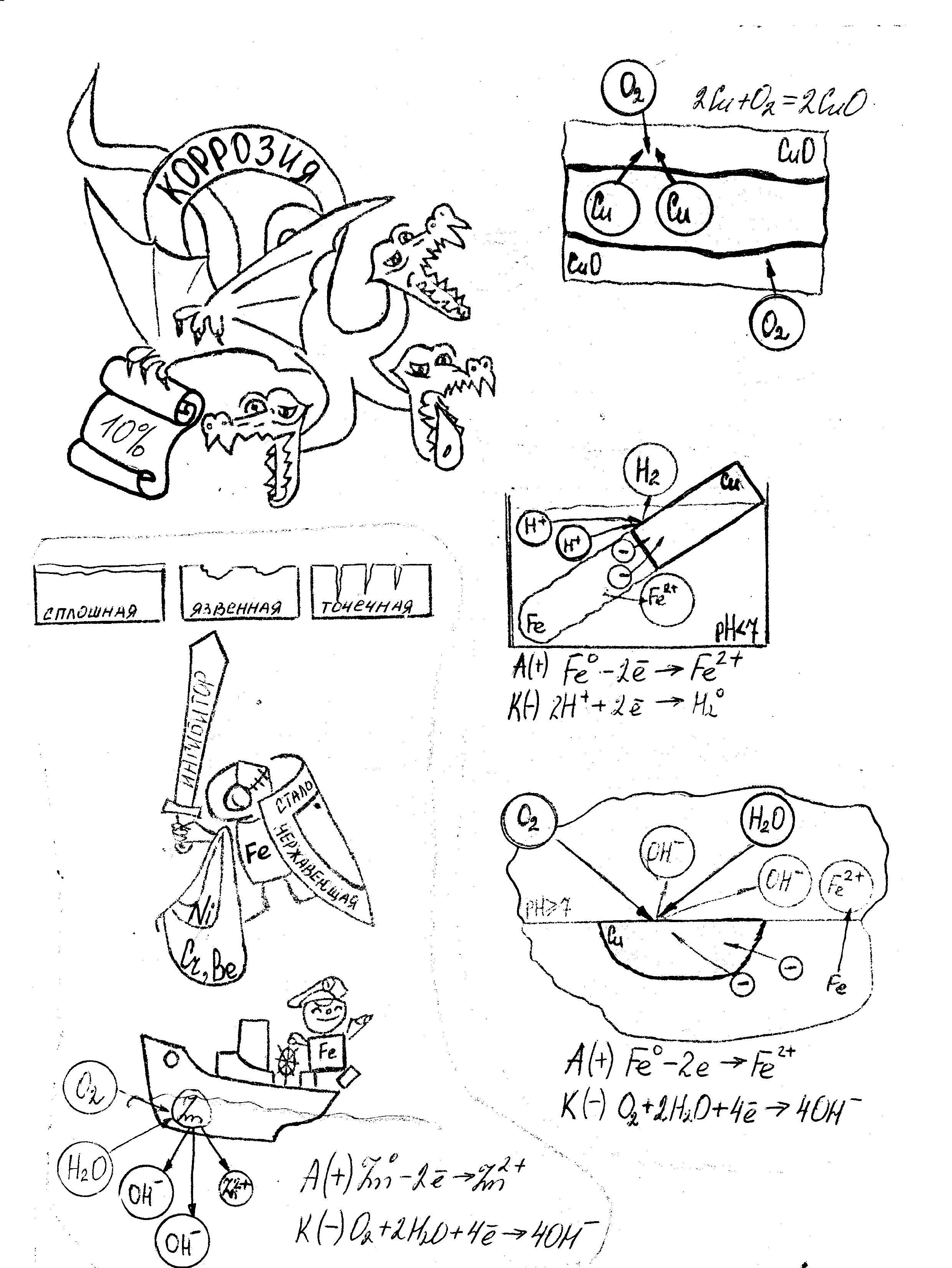
А(+) Fe0 – 2e → Fe2+
К(-) O2+2H2O+4e →4OH-
2Fe0 + O2 + 2H2O→ 2 Fe(OH)2 4Fe(OH)2 + O2 + 2H2O→ 4 Fe(OH)3
Вывод: Кислород – окислитель
Коррозия металлов в кислой среде
З апись в тетрадях:
апись в тетрадях:
А(+) Fe0 – 2e → Fe2+
К(-) 2H+ + 2e → H20
Fe0 + 2H+ → Fe2+ + H20
Вывод: Окислителем являются ионы водорода.
Скорость электрохимической коррозии зависит от природы примесей в металле, природы электролита .Электрохимическая коррозия происходит тем быстрее, чем больше расстояние между металлами в ряду напряжения металлов.
Очень важен вопрос об условиях, при которых коррозия протекает особенно интенсивно
Перед вами четыре пронумерованных стакана. Сейчас каждая группа получит стакан с заложенным опытом и, внимательно рассмотрев результаты, ответит на поставленные вопросы. После этого каждая группа даст пояснения своим наблюдениям и сделает соответствующий вывод.
Гвоздь в дистиллированной воде.
Гвоздь в растворе хлорида натрия.
Гвоздь в контакте с медью растворе соли.
Гвоздь в контакте с цинком в растворе соли.
Опыт №1. Железный гвоздь + чистая вода.
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Насколько сильно корродировал гвоздь в чистой воде?
Сделайте вывод о скорости коррозии в чистой воде.
Опыт №2. Железный гвоздь + раствор хлорида натрия NaCl.
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Насколько сильно корродировал гвоздь в растворе хлориде натрия?
Что из себя представляет по внешнему виду ржавчина?
Сделайте вывод о скорости коррозии в растворе соли.
Опыт №3. Железный гвоздь + медная проволока + раствор NaCl.
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Рассмотрите медную проволоку, произошли ли с ней какие либо изменения?
Насколько сильно корродировал гвоздь в контакте с медной проволокой?
Почему из двух металлов в первую очередь корродирует железо?
Сделайте вывод о скорости коррозии железа при контакте его с медью.
Опыт №4. Железный гвоздь + цинковая пластинка + раствор NaCl
Задания к опыту.
Внимательно рассмотрите железный гвоздь.
Какие изменения на поверхности гвоздя вы наблюдаете?
Какие изменения произошли с цинковой пластинкой?
Какой из металлов (железо или цинк) подвергся коррозии?
Почему железо осталось не измененным?
Сделайте вывод о скорости коррозии железа при контакте его с цинком.
Наблюдения:
1. Железо слабо корродировало, в чистой воде коррозия идет медленнее, т.к. вода слабый электролит.
2. Железо корродирует сильнее, т. к. хлорид натрия более сильный электролит и это увеличивает скорость коррозии.
3. Скорость коррозии велика. Образовалось много ржавчины. Железо сильно корродирует в контакте с менее активным металлом – медью.
В данном опыте образовалась активная гальваническая пара. Fe2+ переходит в раствор. Избыток электронов переходит от железа к меди в местах контакта и восстанавливает на ней атомы кислорода в виде О2 до ОН- (в плёнке электролита на металле).
Анод(Fe): Fe0 - 2ē → Fe2+
Катод(Cu): 4ē + O2 + 2H2O → 4OH-
OH- образует с ионами Fe2+ гидрат закиси железа
Fe2+ + 2ОН- → Fe(ОН)2↓, который окисляется до гидрата окиси железа (ІІІ):
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3↓
Последний можно наблюдать в виде ржавых отложений
4. Наблюдаем коррозию не железа, а цинка, т.к. железо в контакте с более активным металлом даже в сильно коррозионной среде – растворе хлорида натрия – не корродирует, остается защищенным до тех пор, пока не прокорродирует весь цинк. Возникает гальваническая пара, причём цинк переходит в раствор в виде ионов. На железе образуются гидроксильные группы. Цинк в данной гальванической паре, как более активный металл, будет являться анодом и в присутствии среды, проводящей электрический ток, будет разрушаться, железо же не ржавеет. Поэтому оцинкованные ведра сравнительно недороги и служат долго.
Анод(Zn): Zn0 - 2ē → Zn2+
Катод(Fe): 4ē + O2 + 2H2O → 4OH-
Гидроксильные ионы, взаимодействуя с ионами цинка, образуют гидрат окиси цинка в виде белого нерастворимого осадка:
Zn2+ + 2OH- → Zn(OH)2↓
Способы защиты от коррозии
1. легирование металлов, т.е. получение сплавов. Если хром добавить в сталь, когда она варится, получается очень твердый сплав, из которого можно делать и танки, и броню для боевых кораблей, и стволы пушек. А если побольше хрома прибавить, тогда получится сталь для подводных лодок. Она не ржавеет и называется нержавеющей сталью. Если в сталь добавить никель, то такую сталь ржавчина никогда не съест. Нержавеющая сталь, содержащая хром или никель, вероятно, есть у многих дома. Из такой стали делают ложки, вилки, ножи. Они довольно легкие, по цвету немного темнее серебра.
2. нанесение на поверхность металлов защитных пленок: лака, краски, эмали, других металлов.
Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а из второго изготавливают консервные банки. И то и другое получают главным образом протягиванием листа железа через расплав соответствующего металла.
Покрытия из цинка и олова (так же, как и других металлов) защищают железо от коррозии при сохранении сплошности. При нарушении покрывающего слоя (трещины, царапины) коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется «работой» гальванического элемента железо – цинк и железо – олово.
3. введение ингибиторов (замедлителей коррозии) Известно более 5 тыс. ингибиторов
Проведение эксперимента. В пробирку на 1/5 объема налили разбавленную серную кислоту, затем поместили в нее железные стружки. Довели до кипения. Наблюдали выделение пузырьков газа водорода.
Затем в эту же пробирку добавили ингибитор уротропин (1 измельченную таблетку). Уротропин можно заменить тиомочевиной или сухим горючим. Реакция с кислотой прекратилась.
4. протекторный метод защиты от коррозии. Протекторная защита – это электрохимический способ защиты металлов. Он заключается в том, что защищаемый металл, например железо, соединяют с протектором – более активным металлом (цинк, алюминий, магний). Чтобы спасти стальные конструкции, «приносят в жертву» магниевые блоки, расположенные во влажном грунте на некотором расстоянии друг от друга. Примерно также защищают цинковыми пластинами стальные корпуса морских судов. При контакте двух металлов протектор, сделанный из более активного металла будет разрушаться, защищая конструкцию. Протекторную защиту используют для металлических конструкций, соприкасающихся с морской и речной водой. В быту - пример электрохимической защиты - это оцинкованное ведро. Цинковый слой может иметь дефекты, царапины, он может даже не покрывать полностью все ведро – защитное действие все равно будет обеспечено.
Эйфелеву башню красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.
IV.Закрепление:
1.Отметьте верные высказывания:
1) Корродирует только железо.
2) Причиной коррозии является только вода.
3) Коррозия – окислительно-восстановительный процесс.
4) Чтобы защитить металл от коррозии, надо убрать одно из условий возникновения коррозии.
5) При повышении температуры скорость коррозии уменьшается.
2. По отдельности алюминий и титан устойчивы к действию морской воды. Почему, если они контактируют в одном изделии, например в боксе для подводной фототехники, алюминий очень быстро разрушается, и бокс протекает?
3. Более полутора тысяч лет назад в Индии была изготовлена железная колонна весом в 6,5 т, высотой 7,3 м, диаметром у основания 41,6 см, у верха 29,5 см, стоящая ныне на одной из площадей индийской столицы .Она стоит на тропическом солнце, под дождями 15 столетий, но не подверглась ни малейшей коррозии. Почему на нее не действует коррозия?
4. Иногда зубные коронки, изготовленные из различных металлов (золота и стали) и близко расположенные друг к другу, доставляют их носителям неприятнейшие болевые ощущения. С чем это связано?
5. Один из американских миллионеров, не жалея денег, решил построить самую шикарную яхту. Ее днище было обшито дорогим монель металлом (сплав 70% никеля и 30% меди), а киль, форштевень и раму руля изготовили из стали. Однако яхта еще до завершения отделочных работ вышла из строя, ни разу не побывав в море. Интересно, что яхте было дано имя «Зов моря». В чем причина недолговечности яхты?
Самостоятельная работа:
Вариант №1
Что такое коррозия? Какие факторы способствуют замедлению коррозии?
На стальной крышке поставлена медная заклепка. Что раньше разрушится - крышка или заклепка? Почему?
Вариант №2
Какие виды коррозии вам известны?
Почему луженный (покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
Вариант №3
Какие факторы способствуют усилению коррозии?
Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются медь или цинк; Алюминий или железо? Почему?
Вариант №4
Перечислите способы борьбы с коррозией металлов.
Почему на оцинкованном баке, на месте царапины, цинк разрушается, а железо не ржавеет?
V. Домашнее задание: § 6.6, упр.3,4,5.
VI. Подведение итогов.
Итак, на сегодняшнем уроке мы с вами изучили один из важнейших вопросов химической промышленности – коррозию металлов. Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить, на что и направлена современная химическая наука.
VII. Комментирование оценок.
Дополнительный материал по теме.




О том, сколь коварна и прожорлива коррозия, знают все автомобилисты. Двигатель порой готов еще служить верой и правдой, а кузов машины уже насквозь разъеден ржавчиной. Вот почему проблемам борьбы с коррозией ведущие автомобильные фирмы придают огромное значение. В январе 1986 г в Брюсселе проходил международный автосалон, на котором демонстрировалось более 1300 автомобилей из трех десятков стран. Всеобщее внимание привлекли машины шведской фирмы «Вольво», которая сумела существенно повысить антикоррозионную стойкость своей продукции и дает покупателям гарантию на 8 лет. Чтобы ни у кого на этот счет не возникало сомнений, фирма придумала оригинальную рекламу: на одном из ее стендов был установлен гигантский аквариум с водой, в котором, пока функционировал салон, все время находился автомобильный остов, прошедший перед этим специальную антикоррозионную обработку. «Не знаем, как насчет 8 лет, но за дни работы салона, - шутила одна из бельгийских газет, - металлическая рыбка «Вольво» не проржавела».





















