П ериодическая с истема х имических э лементов Дмитрия Ивановича Менделеева
Подготовила Сохибова Комила Иззатуллаевна
Учитель химии

К середине XIX века было открыто 63 химических элемента,
и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию.
Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
Таблица Менделеева, (или ПСХЭ)
- это таблица, которая квалифицирует химические элементы по различным свойствам,
зависящим от заряда атомного ядра.
Эта система выражает, в виде таблицы,
периодический закон химических элементов, который
в 1869 году открыл
Русский ученый химик Д.И. Менделеев.

История открытия ПСХЭ
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает.
Он был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог.
За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний.
Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Точно известно, что его диссертация на тему
«Рассуждение о соединении спирта с водой»
не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов.
При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.

История открытия ПСХЭ
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Ивановича Менделеева.
Свои системы элементов предлагали такие известные ученые, как:
Джон Александр Рейна
Ньюлендс
Юлиус Лотар Мейер
Иоганн Вольфганг Деберейнер
Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
Мифы и факты о создании периодической таблицы
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею.
Но, если бы все было так просто..
Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда.
На вопрос о том, как была открыта таблица, Дмитрий Иванович отвечал:
« Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
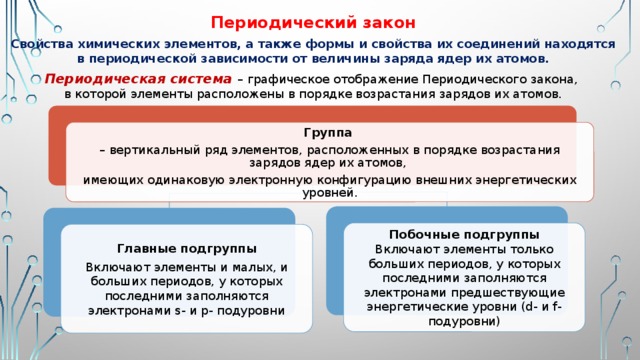
Периодический закон
Свойства химических элементов, а также формы и свойства их соединений находятся
в периодической зависимости от величины заряда ядер их атомов.
Периодическая система – графическое отображение Периодического закона,
в которой элементы расположены в порядке возрастания зарядов их атомов.
Группа
– вертикальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов,
имеющих одинаковую электронную конфигурацию внешних энергетических уровней.
Побочные подгруппы
Включают элементы только больших периодов, у которых последними заполняются электронами предшествующие энергетические уровни (d- и f- подуровни)
Главные подгруппы
Включают элементы и малых, и больших периодов, у которых последними заполняются электронами s- и p- подуровни



Закономерности изменения свойств химических
элементов и их соединений
по периодам и группам
Химические свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома .

Изменения свойств химических элементов и их соединений в группах:
В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
- Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются !
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны .
3) способность отдавать электроны=металлические свойства , т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
- сверху вниз возрастают металлические свойства элементов
- усиливаются основные свойства их соединений

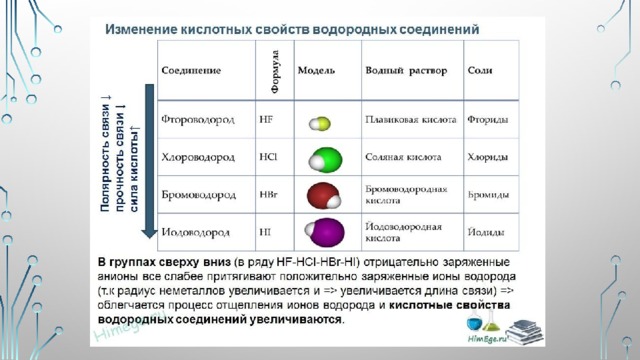
Изменения химических свойств элементов и их соединений в периодах
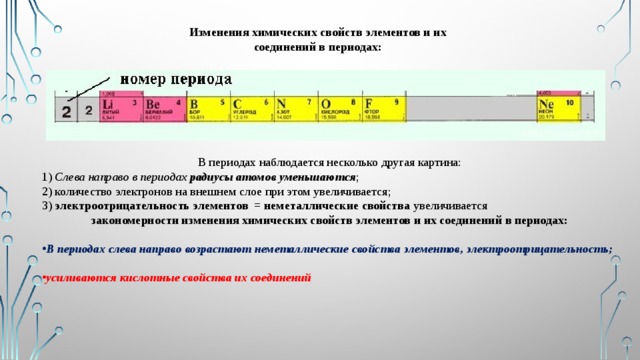
Изменения химических свойств элементов и их соединений в периодах:
В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются ;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
- В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
- усиливаются кислотные свойства их соединений
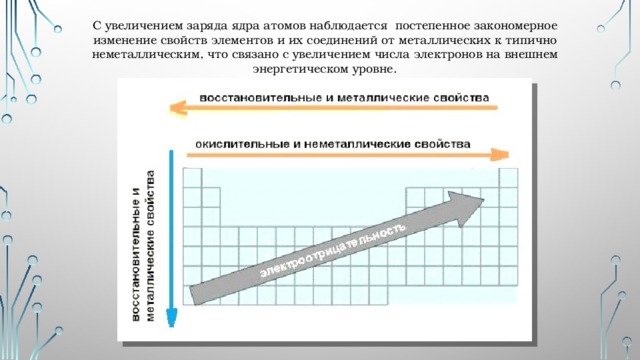
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.

Кислотно-основные свойства химических соединений, их изменение в группе и периоде
Кислотно — основные свойства гидроксидов зависят от того,
какая из двух связей в цепочке
Э −О − Н
является менее прочной.
Если менее прочна связь Э−О, то гидроксид проявляет основные свойства,
если О−Н − кислотные.
Чем менее прочны эти связи, тем больше сила соответствующего
основания или кислоты.
Прочность связей Э−О и О−Н в гидроксиде зависит от распределения электронной плотности в цепочке Э−О− H.
На последнюю наиболее сильно влияют степень окисления элемента
и ионный радиус.
Увеличение степени окисления элемента и уменьшение его ионного радиуса, вызывают смещение электронной плотности к атому элемента в цепочке Э ← О ←Н.
Это приводит к ослаблению связи О−Н и усилению связи Э−О.
Поэтому основные свойства гидроксида ослабевают, а кислотные − усиливаются.