Периодический закон Д. И. Менделеевым
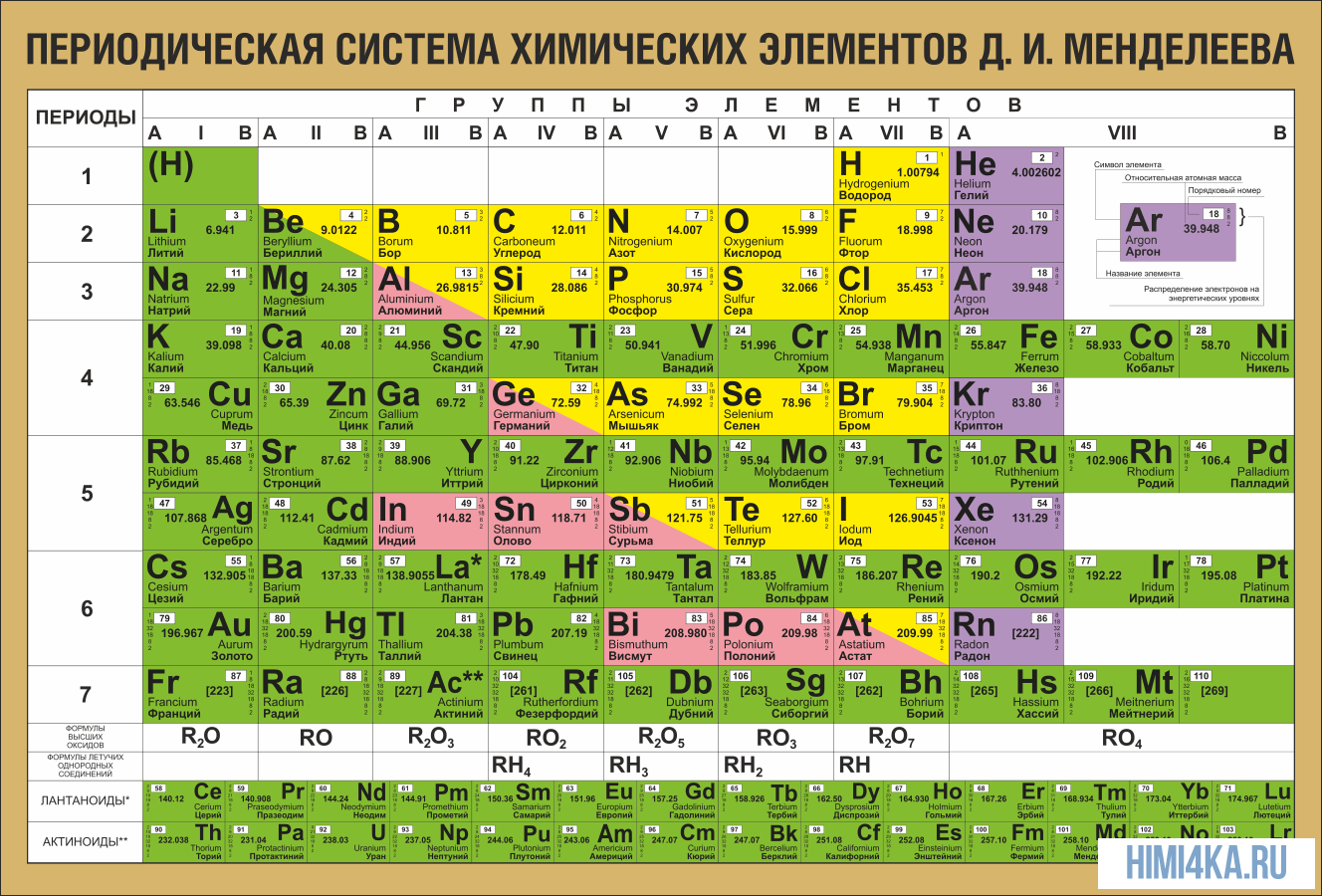
Периодический закон сформулирован Д. И. Менделеевым в 1869 году. К этому времени было известно 63 химических элемента. В качестве основного свойства элементов Менделеев выбрал относительную атомную массу. Учитывал также состав, физические и химические свойства образованных элементом простых и сложных веществ.
Расположив все известные химические элементы в порядке возрастания атомных масс, Менделеев обнаружил, что свойства повторяются через определённое число элементов.
Повторим действия Менделеева с учётом того факта, что благородные газы в его время ещё не были известны. Расположим элементы по возрастанию атомной массы (вторая строчка таблицы), укажем металлические и неметаллические свойства, формулы и свойства высших оксидов и гидроксидов, а также формулы газообразных водородных соединений.
Если внимательно проанализировать полученные последовательности, то можно увидеть повторяемость металлических и неметаллических свойств, состава и свойств соединений. Через семь элементов от щелочного металла лития в ряду располагается щелочной металл натрий, а через семь элементов от галогена фтора — галоген хлор. Через семь элементов появляются одинаковые формулы оксидов и водородных соединений, так как повторяются значения валентностей в соединениях с кислородом и водородом. Можем составить их общие формулы.
Формулы высших оксидов: R2O,RO,R2O3,RO2,R2O5,RO3,R2O7.
Летучие водородные соединения (для неметаллов): RH4,RH3,RH2,RH.
Таким образом Менделеев установил периодичность изменения свойств с возрастанием атомной массы. В статье «Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от атомного веса».
В переводе на современный научный язык это звучит так:
«Свойства простых веществ, а также состав и свойства соединений элементов находятся в периодической зависимости от относительных атомных масс».
Все элементы Менделеев разделил на периоды.
Период — ряд элементов, расположенных в порядке возрастания относительной атомной массы, начинающийся щелочным металлом и заканчивающийся галогеном и инертным газом.
В периоде:
-
постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
-
высшая валентность элементов по кислороду возрастает от I (у щелочных металлов) до VII (у галогенов);
-
валентность элементов неметаллов в летучих водородных соединениях уменьшается от IV до I (у галогенов);
-
свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
Периодический закон получил дальнейшее развитие после изучения физиками строения атома. Оказалось, что главной характеристикой химического элемента является не относительная атомная масса, а заряд ядра атома. Современная формулировка периодического закона несколько изменена:
«Свойства химических элементов и их соединений находятся в периодической зависимости от зарядов атомных ядер».





























