РАЗРАБОТКА УРОКА ПО ТЕМЕ
«Первоначальные понятия
о растворах.
Приготовление растворов с определенной массовой долей растворённого вещества.»
8 класс
Подготовила:
Учитель МАОУ СОШ №48: Карякина Наталья Олеговна
Урок. Первоначальное понятие о растворах.( слайд 1 )
Цель урока. Сформировать понятия о растворе, растворителе, растворимости, насыщенных и ненасыщенных растворах . Выработать умения применять знания о растворах, растворении, массовой доле растворённого вещества.(слайд 2 )
Задачи: ( слайд 3 )
1. Создать условия для понимания учащимися важности роли водных растворов в жизни человека, природы.
2. Уметь проводить вычисления массовой доли растворённого вещества в растворе , при решении стандартных и нестандартных задач.
3. Развитие языка предмета, логического мышления, умения работать по алгоритму, проводить вычисления по формулам; повышать коммуникативные способности.
Основные понятия. Раствор, растворитель, растворимое вещество, растворимость. Насыщенный и ненасыщенный, концентрированный и разбавленный растворы, массовая доля растворенного вещества.
Планируемые результаты обучения: предметные; метапредметные; личностные.
Знать определение массовой доли растворенного вещества. Уметь вычислять массовую долю и массу вещества в растворе.
Основные средства обучения: Демонстрация приготовления растворов. Компьютерная презентация, использование ЦОР, раздаточные дидактические материалы.
Демонстрации. Различные виды растворов. Приготовление раствора с определенной массовой долей растворенного вещества.
Тип урока: Усвоения, применения и совершенствования полученных знаний.
Ход урока.
1.Организационный момент.
Здравствуйте, ребята! Садитесь. Я рада вас видеть и хочу, чтобы наш урок прошёл успешно. Успешным он будет, если всем нам будет интересно, а интерес - это в первую очередь ваше положительное эмоциональное отношение к химии.
Вспомним прошлую тему , ответив на вопросы. ( слайд 4 )
…. единственное вещество в природе, которое в земных условиях существует в трех агрегатных состояниях
Вода – это ... , плотность равна ... , температура плавления равна ... , температура кипения равна ... , ... проводит электрический ток.
Физические свойства воды при комнатной температуре и атмосферном давлении:
Глубокие водоемы не промерзают до дна, поскольку:
Не является раствором:
а) лимонная кислота;
б) дистиллированная вода;
в) кровь;
г) глицерин.
Дробление растворяемого вещества до мелких частиц и их равномерное распределение между молекулами растворителя – ... .
2.Объяснение новой темы.
http://www.youtube.com/watch?v=Gy3guaOqtcI ( самое начало)
Какую же тему мы с вами будем изучать ? Верно РАСТВОРЫ. Попробуйте разобраться в следующих ситуациях ( слайд 5 )
А) При ожогах кожи фосфором ее обильно смачивают 5%-м раствором сульфата меди(II). Представьте, что вы старший фармацевт и должны дать неопытному лаборанту задание приготовить 500 мл такого раствора. Составьте карту-инструкцию приготовления раствора
Б) В больнице для промывания горла пациенту назначили 0,5%-й раствор перманганата калия, а в наличии оказался только 6%-й раствор этого вещества. Сколько воды и 6%-го раствора потребуется, чтобы приготовить 1 кг 0,5%-го раствора перманганата калия?
В) Представьте, что вы медработник хирургического отделения районной больницы и должны приготовить для обработки ран 5%-й спиртовой раствор йода. Какой объем раствора можно приготовить из 10 г кристаллического йода, если плотность раствора должна быть 0,950 г/мл. Людям в зависимости от рода их профессии приходится сталкиваться с растворами, имеющими строго заданное содержание в них растворенного вещества: приготовление лекарственных растворов, растворение проявителя для фотографий, раствор для аккумулятора с содержанием серной кислоты и т.д. Поэтому на уроках химии мы с вами с помощью задач научимся рассчитывать массовую долю растворенных веществ – отношение массы растворенного вещества к общей массе раствора.
Сейчас вы увидите различные виды растворов : истинные растворы и взвеси ( суспензии и эмульсии). Растворы бывают ( слайд 6 )
| Жидкие Вода, спирты, органические растворители | Твердые Сплавы | Газообразные Воздух (кислород в азоте), смеси газов |
Скажите, пожалуйста, составляющие любого раствора. Абсолютно верно, любой раствор характеризуется наличием в нем растворенного вещества, растворителя и определенной концентрацией. Тот компонент, который количественно преобладает и находится в том же агрегатном состоянии, что и раствор, называют растворителем. Растворы отличаются от других смесей тем, что частицы растворенного вещества распределяются в растворителе равномерно. Рассматривать мы будем только водные растворы, т.к. они наиболее распространены.
Итак, запишем, что же такое растворы.
Растворы – это однородные смеси, состоящие из двух или более однородных частей и продуктов их взаимодействия.
Как вы считаете процесс растворения это физический , химический или физико – химический? Давайте посмотрим и послушаем.
http://files.school-collection.edu.ru/dlrstore/617fb4d9-8cff-11db-b606-0800200c9a66/ch08_34_03.swf В соответствии с современными взглядами, растворение – это физико-химический процесс, а растворы – это гомогенная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
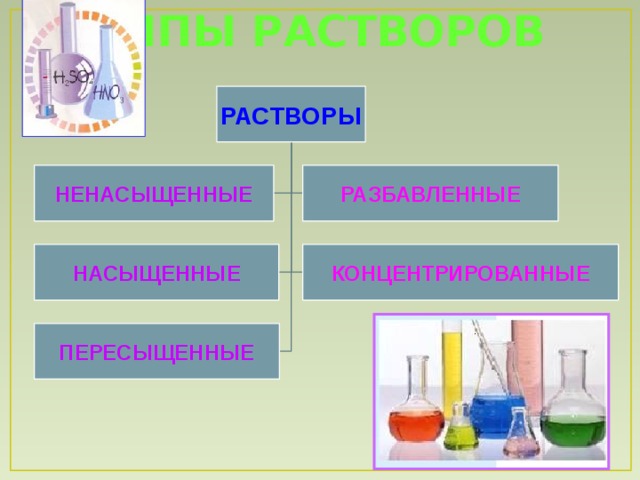
Растворы делятся на: ( слайд 7 )
Насыщенные - если он находится в равновесии с растворяемым веществом;
Ненасыщенные – содержат вещества меньше, чем это определяется его растворимостью;
Пересыщенные - содержит вещества больше, чем это определяется его растворимостью.
Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
А так же концентрированные и разбавленные. Как вы думаете понятия «насыщенный – концентрированный», « разбавленный – ненасыщенный» одно и то же или разные ? ( слайд 8)
Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Очевидно, что концентрированные растворы могут образовывать только хорошо растворимые вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщеные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
3. Закрепление.
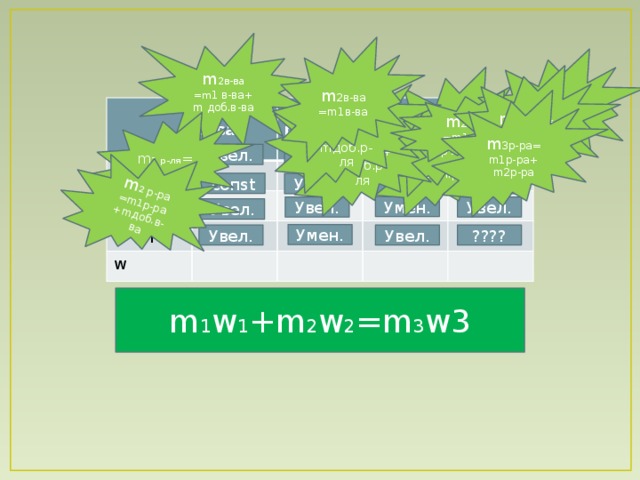
Ну, а теперь разделим класс на 3 группы, по рядам соответственно, и попробуем посмотреть, как изменяются основные показатели растворов; m-растворов, m - растворенного вещества, m - растворителя и концентрация ( w ) , если мы добавим в наш раствор вещество, растворитель или выпарим его. Проверим то, что у вас получилось ( слайд 9 ). А теперь все вместе давайте пронаблюдаем как изменятся эти параметры если мы смешаем растворы поваренной соли , но с разной концентрацией. Проверим( слайд 9 ).
Если ,массовая доля растворенного вещества — это отношение массы растворенного вещества к общей массе раствора, а масса раствора это сумма масс растворенного вещества и растворителя, то попробуйте теперь вывести формулы для расчёта масс раствора, вещества, растворителя при изменении ваших параметров. При решении задач по приведенным уравнениям массовую долю растворенного вещества можно выражать в долях единицы или в процентах. Проверим ( слайд 9 ). Ну а теперь сделаем то же самое для раствора , полученного при смешивании растворов соли ( слайд 9 ).
Вот теперь вернемся к нашим исходным ситуационным задачам и решим их ( по рядам слайд 10). С каждого ряда первые 3 человека получают отметку. Записываем верное решение на доске.
4.Рефлексия.
У вас на партах лежат анкеты, ( слайд 11) попрошу их заполнить.
| 1. На уроке я работал | активно / пассивно |
| 2. Своей работой на уроке я | доволен / не доволен |
| 3. Урок для меня показался | коротким / длинным |
| 4. За урок я | не устал / устал |
| 5. Мое настроение | стало лучше / стало хуже |
| 6. Материал урока мне был | понятен / не понятен полезен / бесполезен интересен / скучен |
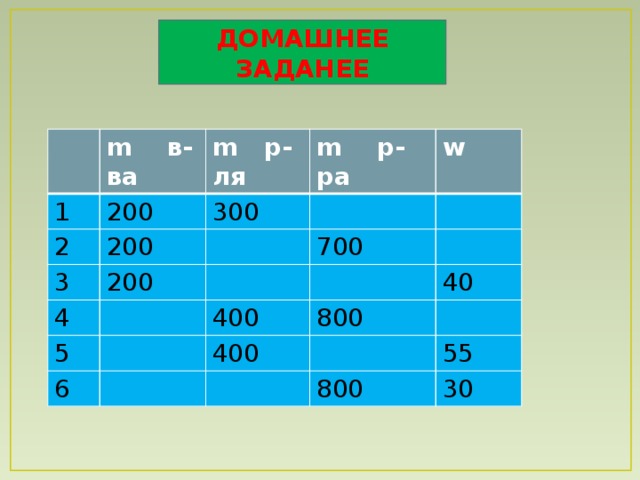
5.Домашнее задание. Выбрать и решить по 5 ситуационных задач, которые получите по интернету или в приложении 1, Учитывая , что концентрацию веществ в растворах можно выразить разными способами ( приложение 2 )..
На средний балл заполнить таблицу ( слайд 12 ), решение указать в тетради. Подготовиться к теоретическому диктанту по пройденной теме. Спасибо за урок ( слайд 13 ).