
Знание — столь драгоценная вещь, что его не зазорно добывать из любого источника Фома Аквинский
Подготовка к ГИА. ОГЭ – химия 9 класс
Филиал МАОУ Каскаринской СОШ «Янтыковская СОШ»
Учитель биологии и химии Миникаева Р.Ш.

ОГЭ – это форма государственной итоговой аттестации по образовательным программам основного общего образования. При проведении ОГЭ используются контрольные измерительные материалы стандартизированной формы.
Демонстрационный вариант № 1 контрольных измерительных материалов для проведения в 2018 году основного государственного экзамена по ХИМИИ
Задания, включённые в демонстрационный вариант, не отражают всех элементов содержания, которые будут проверяться с помощью вариантов КИМ в 2018 г.
Полный перечень элементов содержания, которые могут контролироваться на экзамене 2018 г., приведён в Кодификаторе элементов содержания и требований к уровню подготовки обучающихся для проведения ОГЭ по химии
Демонстрационный вариант предназначен для того, чтобы дать возможность любому участнику экзамена и широкой общественности составить представление о структуре экзаменационной работы, количестве и форме заданий, а также об их уровне сложности.

Кодификатор - систематизированный перечень требований к уровню подготовки выпускников и проверяемых элементов содержания.
- Кодификатор составлен на базе Федерального компонента государственного стандарта основного общего образования образования (приказ Министерства образования РФ от 05.03.2004 № 1089)
- Кодификатор состоит из двух разделов:
– Раздел 1. «Перечень элементов содержания, проверяемых на основном государственном экзамене по ХИМИИ»;
– Раздел 2. «Перечень требований к уровню подготовки обучающихся, освоивших общеобразовательные программы основного общего образования по ХИМИИ»

Спецификация контрольных измерительных материалов для проведения в 2018 году основного государственного экзамена по ХИМИИ
Назначение КИМ для ОГЭ – оценить уровень общеобразовательной подготовки по химии выпускников IX классов общеобразовательных организаций в целях государственной итоговой аттестации выпускников.
- Содержание экзаменационной работы определяет Федеральный компонент государственного стандарта основного общего образования по химии (приказ Минобразования России от 05.03.2004 № 1089)
Результаты экзамена могут быть использованы при приеме обучающихся в профильные классы средней школы

Система оценивания выполнения отдельных заданий и экзаменационной работы в целом
Верное выполнение каждого из заданий 1–15 оценивается 1 баллом.
Верное выполненное каждого из заданий 16–19 максимально оценивается 2 баллами.
Задания 16 и 17 считаются выполненными верно, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются 0 баллов.
Задания 18 и 19 считаются выполненными верно, если правильно установлены три соответствия. Частично верным считается ответ, в котором установлены два соответствия из трех; он оценивается 1 баллом. Остальные варианты считаются неверным ответом и оцениваются 0 баллов.
Максимальная оценка за верно выполненное задание: за задания 20 и 21 – по 3 балла; в модели 1 за задание 22 – 5 баллов.

Элементы содержания, проверяемые заданиями экзаменационной работы
ВЕЩЕСТВО
1.1. Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
1.2 Периодический закон и Периодическая система химических элементов Д.И. Менделеева
1.2.1 Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
1.2.2 Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
1.3 Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
1.4 Валентность химических элементов. Степень окисления химических элементов.
1.5 Чистые вещества и смеси
1.6 Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических веществ.
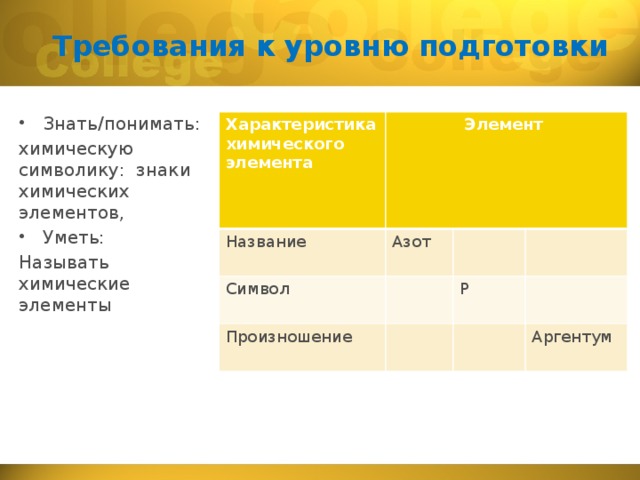
Требования к уровню подготовки
химическую символику: знаки химических элементов,
Называть химические элементы
Характеристика химического элемента
Элемент
Название
Азот
Символ
Произношение
Р
Аргентум

Требования к уровню подготовки
1. В молекуле фтора химическая связь
классифицировать
1) ионная
- вид химической связи в соединениях;
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
2. Формулы соединений с ковалентной полярной и ионной связью соответственно:
1) NH 3 и CaO
2) KCl и N 2
3) BaS и H 2 S
4) H 2 и SO 2

ХИМИЧЕСКИЕ РЕАКЦИИ
2.1. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
2.2 Классификация химических реакций по различным
признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
2.3 Электролиты и неэлектролиты
2.4 Катионы и анионы. Электролитическая диссоциация
кислот, щелочей и солей(средних)
2.5 Реакции ионного обмена и условия их осуществления.
2.6 Окислительно-восстановительные реакции. Окислитель и восстановитель.

2.6 Окислительно-восстановительные реакции. Окислитель и восстановитель.
1. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Определите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Определите окислитель и восстановитель

Пояснение.
- Составлен электронный баланс:
2) Расставлены коэффициенты в уравнении реакции:
3) Указано, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.

Элементарные основы неорганической химии.
Представления об органических веществах
3.1 .Химические свойства простых веществ
3.1.1 Химические свойства простых веществ-металлов:
щелочных и щелочноземельных металлов, алюминия, железа
3.1.2 Химические свойства простых веществ-неметаллов:
водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
3.2 Химические свойства сложных веществ
3.2.1 Химические свойства оксидов: оснόвных, амфотерных, кислотных
3.2.2 Химические свойства оснований
3.2.3 Химические свойства кислот
3.2.4 Химические свойства солей(средних)
3.3 Взаимосвязь различных классов неорганических веществ
3.4 Первоначальные сведения об органических веществах
3.4.1 Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен
3.4.2 Кислородсодержащие вещества: спирты(метанол, этанол, глицерин), карбоновые кислоты(уксусная и стеариновая)
3.4.3 Биологически важные вещества: белки, жиры, углеводы.

Химические свойства простых веществ-металлов:
щелочных и щелочноземельных металлов, алюминия, железа
Пример 1. Составьте уравнения реакций, подтверждающих общие химические свойства металлов.
Ме- только восстановители: Ме - ne = Ме
1.Взаимодействие с неметаллами:
а) металл + кислород =оксид металла(или пероксид металла для очень активных металлов)
б) металл + неметалл= соль

2.Взаимодействие с кислотами:
Металл+ кислота= соль + водород
(металлы-левее водорода в ряду активности, кислоты- кроме азотной кислоты).
3.С соединениями менее активных металлов:
а)Ме+ МеО = Ме + МО
б)Ме + МеАn=Ме An +Me

РЕШУ ОГЭ
1. Железо реагирует с
1) хлоридом кальция
2) бромом
3) оксидом натрия
4) гидроксидом натрия
Пояснение. В зависимости от условий реакции, железо окисляется бромом до бромида железа(II) или бромида железа(III).
2. С медью не реагирует
1) хлорид железа(II) (р-р)
2) серная кислота (конц.)
3) кислород
4) хлор
Пояснение. Медь не будет вытеснять из солей
железо, находящееся левее её в ряду напряжения металлов

Методы познания веществ и химических явлений.
Экспериментальные основы химии.
4.1. Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Разделение смесей и очистка веществ. Приготовление растворов
4.2 Определение характера среды раствора кислот и
щелочей с помощью индикаторов. Качественные реакции на ионы в растворе(хлорид-, сульфат-, карбонат-ионы, ион аммония)
4.3 Получение газообразных веществ. Качественные реакции на газообразные вещества(кислород, водород, углекислый газ, аммиак)
4.4 Получение и изучение свойств изученных классов
неорганических веществ.
4.5 Проведение расчетов на основе формул и уравнений реакций
4.5.1 Вычисления массовой доли химического элемента в веществе.
вычисления массовой доли растворенного вещества в растворе
4.5.3 Вычисление количества вещества, массы или объема
вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции.

Химия и жизнь
5.1 Проблемы безопасного использования веществ и
химических реакций в повседневной жизни
5.2 Химическое загрязнение окружающей среды и его
последствия
5.3 Человек в мире веществ, материалов и химических
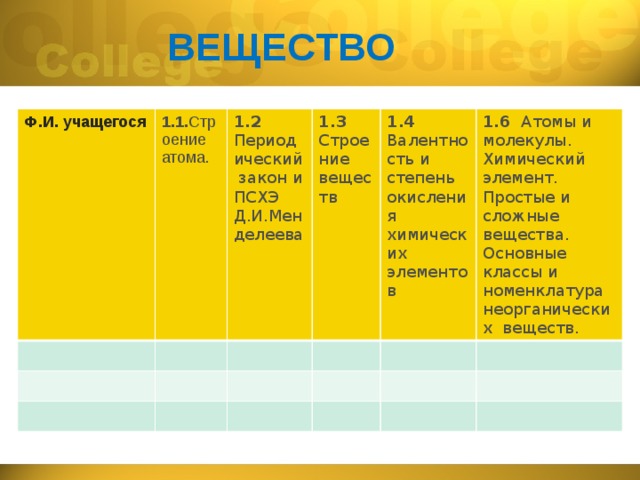
ВЕЩЕСТВО
Ф.И. учащегося
1.1. Строение атома.
1.2 Периодический закон и ПСХЭ Д.И.Менделеева
1.3 Строение веществ
1.4 Валентность и степень окисления химических элементов
1.6 Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы и номенклатура неорганических веществ.












































