ПРАКТИЧЕСКАЯ РАБОТА №11
ИССЛЕДОВАНИЕ МИКРООРГАНИЗМОВ В ОКРАШЕННОМ СОСТОЯНИИ. ОКРАСКА ПО ЦИЛЬ-НИЛЬСЕНУ.
Цель занятия. Проведение окрашивания кислотоустойчивых бактерий сложным способом.
Студент должен знать
1.Простые и сложные методы окраски бактерий.
Студент должен уметь
1. Приготовить мазок-препарат, окрашенный сложным способом по Цилю -Нильсену.
2. Провести микроскопию в светлом поле.
3. Провести дезинфекцию и утилизацию.
Материалы и оборудование. Микроскоп с конденсорами светлого поля. Предметные стекла, спиртовка, спички, красители (карболовый фуксин Циля, метиленовый синий), 5 % раствор серной кислоты (или 3 % раствор солянокислого спирта), штатив, бактериальная петля, пинцет, промывалка с водой или колба с водой и пипеткой, фильтровальная бумага.
Окраска по Циль-Нильсену
Среди микроорганизмов есть такие, которые обладают выраженной устойчивостью к неорганическим кислотам, спиртам, щелочам. Их называют кислотоустойчивыми микроорганизмами. Эта особенность связана с наличием в клеточной стенке и цитоплазме сравнительно большого количества липидов, воска, миколовой кислоты. Из патогенных микроорганизмов кислотоустойчивостью обладают возбудители туберкулеза, лепры, некоторые виды актиномицет. Основным способом выявления кислотоустойчивых микроорганизмов является окраска по методу Циль-Нильсена. Именно этот способ применяют для обнаружения микобактерий туберкулеза в мокроте больных людей, жидкого диагностического материала (бронхоальвеолярные смывы, промывные воды бронхов или желудка, моча, пунктаты из закрытых полостей, экссудаты).
Для окрашивания кислотоустойчивых бактерий вместо обычных красителей применяют концентрированные растворы красителей с подогревом, например, карболовый фуксин Циля, который окрашивает все микроорганизмы в рубиново-красный цвет. При последующей кратковременной обработке кислотой одни микробные клетки прочно удерживают краситель и не обесцвечиваются в растворе кислот, другие - теряют цвет. Это позволяет кислотоустойчивые микроорганизмы отличить от не обладающих этим свойством. Затем при дальнейшем докрашивании красителем другого цвета (например, метиленовой синью), некислотоустойчивые микроорганизмы приобретают цвет дополнительного красителя. А кислотоустойчивые микроорганизмы сохраняют цвет основного красителя (фуксина Циля).
Вид: в препарате, окрашенном по методу Циль-Нильсена, кислотоустойчивые микроорганизмы имеют рубиново-красный цвет, некислотоустойчивые микроорганизмы, лейкоциты, элементы ткани – голубой цвет (рисунок 1).
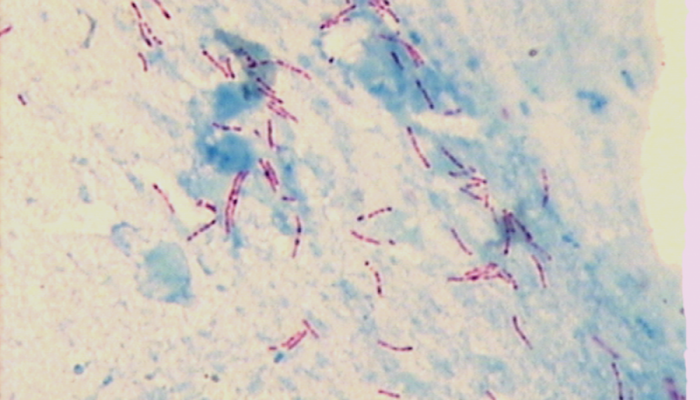
Рисунок 1 – Микобактерии туберкулеза окраска по Циль-Нильсену
Приготовление препаратов для микроскопии
Основным видом диагностического материала для проведения прямого микроскопического исследования методом Циля-Нильсена является мокрота. Качественным материалом можно считать свежевыделенную мокроту, имеющую слизистый или слизисто-гнойный характер, а также содержащую плотные белесоватые включения. Достаточный объем образца мокроты для исследования составляет 3–5 мл, хотя и меньшее количество может оказаться достаточным при удовлетворительном качестве. Наибольшая вероятность найти КУМ в неконцентрированном диагностическом материале представляется при исследовании плотных и твердых комочков в мокроте, и результат прямого микроскопического исследования в большой степени зависит от выбора именно этих комочков. В связи с этим, необходимо, чтобы материал поступал в лабораторию в одноразовых пластиковых прозрачных контейнерах объемом 20–50 мл. Использование таких контейнеров позволяет легко оценить качество и объем собранного материала, а при приготовлении мазков для микроскопии – проводить выбор гнойных комочков непосредственно из контейнера, избегая чрезвычайно эпидемически опасного этапа выливания мокроты в чашку Петри. Приготовление препаратов для микроскопического исследования является одной из наиболее эпидемически опасных процедур, поскольку в процессе подготовки материала для исследования создается высокий риск образования аэрозолей с диаметром частиц от 1 до 5 мкм, которые способны проникать в легочные альвеолы и оседать в них, формируя очаг инфекции. Поэтому приготовление препаратов рекомендуется проводить в вытяжном шкафу или (предпочтительно) в боксе биологической безопасности.
Задание 1
Промикроскопировать готовый мазок, окрашенный по методу Циль-Нильсена. Зарисовать. Подписать.
Задание 2
Заполните таблицу 1
Таблица 1 – Методика окраски мазков по методу Циль-Нильсена
| Этап | Время | Условия | Рисунок |
| 1.Нанесение карболового красителя | 5 мин | нагреть препарат над пламенем горелки до появления легкого облачка паров |
|
| 2. |
|
|
|
Последовательность окраски мазка по методу Циль-Нильсена:
1.На мазок положить фильтровальную бумагу. Нанести несколько капель карболового фуксина (препарат должен быть обильно смочен) и нагревают препарат над пламенем горелки до появления легкого облачка паров, не допуская закипания краски и высыхания бумаги. Объем красящего раствора должен быть достаточным для того, чтобы его повторно не наносить на уже разогретый мазок. В случае высыхания мазка и повторного нанесения красителя, нагрейте мазок до появления паров повторно.
Мазок оставляют на 5 минут с красителем, чтобы он проник в клеточную стенку бактерий и окрасил ее.
2. Пинцетом осторожно снимают фильтровальную бумагу и помещают ее в емкость с дезинфицирующим раствором.
3. Осторожно (!) смывают остатки краски слабой струей проточной воды или водой из резервуара. Вода должна быть комнатной температуры или холодной.
После каждой процедуры промывки, во избежание разбавления реактивов, каждое стекло аккуратно ставят пинцетом на ребро, чтобы стекли остатки воды.
4. Мазок обесцвечивают 5% раствором серной кислоты или 3% солянокислым спиртом, добиваясь визуального эффекта полного обесцвечивания. Продолжительность процедуры обесцвечивания – 2-4 с.
5. Мазок промывают проточной водой, как описано ранее.
6. Мазок докрашивают 0,3% раствором метиленового синего в течение 1 мин. Или леффлеровской синькой (3-5 мин).
7. Мазок промывают проточной водой, как описано ранее.
8. Мазок высушивают при комнатной температуре в вертикальном положении. Не следует промокать препарат!
Препарат микроскопируют в световом микроскопе с масляной иммерсией. При проведении процедуры обесцвечивания мазков рекомендуется визуально оценивать степень обесцвечивания мазка, добиваясь исчезновения красного цвета. При неполном обесцвечивании мазка процедуру следует повторить. Препарат считается недостаточно обесцвеченным в том случае, если в окрашенном мазке мокроты сохраняется пигмент карболового фуксина. Считается, что сапрофитные виды микобактерий значительно менее устойчивы к обесцвечиванию, чем патогенные штаммы. В связи с этим наилучшим вариантом является проведение процедуры обесцвечивания мазка с помощью 25% серной кислоты в течение 3 минут, после чего может быть рекомендовано проведение дополнительной обработки мазка 96% этиловым спиртом в течение 5 минут для удаления с мазка кристаллов и остатков краски. Указанный режим обесцвечивания позволяет избежать ложноположительного выявления кислотоустойчивых микроорганизмов (КУМ).


















