4
Тема 1 «Основные понятия химии»
Практическое занятие № 1.
Определение массовой доли химических элементов в сложных веществах
Учебная цель: уметь определять массовую долю веществ в сложных соединениях.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- основные понятия и законы химии.
Обучающийся должен уметь:
- различать простые и сложные вещества, знать формулы простых и сложных веществ, определять качественный и количественный состав веществ, массовую долю элемента в сложном веществе.
Задачи практического занятия:
Закрепить теоретические знания по основным понятиям химии.
Ответить на вопросы для закрепления теоретического материала.
Закрепить расчет массовой доли элемента в сложном веществе.
Закрепить нахождение простейшей формулы вещества, зная массовые доли элементов.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Справочная литература:
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
1. Относительная молекулярная масса равна сумме всех относительных атомных масс элементов с учетом индекса элемента. Относительная молекулярная масса соединения величина безразмерная. Она показывает во сколько раз относительная молекулярная масса соединения больше 1/12 массы изотопа углерода-12.
2. Для вычисления относительной молекулярной массы необходимо суммировать относительные атомные массы элементов образующих соединение.
Мr = n1 *Аr1 + n2* Ar2 + n3* Ar3 (1)
3. Зная относительные атомные массы элементов и число атомов, входящих в состав химического соединения, можно определить массовые соотношения этих элементов.
4. Массовая доля элемента в данном веществе () – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества:
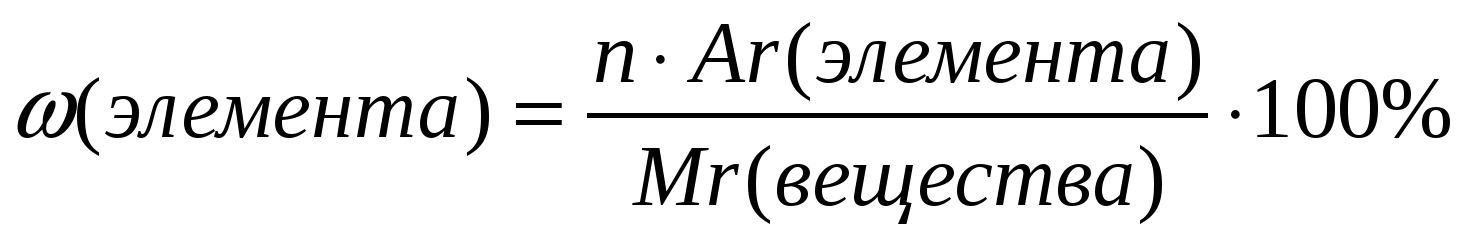 (2)
(2)
где – массовая доля элемента в веществе;
Ar– относительная атомная масса;
n– индекс в химической формуле;
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
(элемента) = 20% или 0,2.
5. Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
 (3)
(3)
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
 (4)
(4)
или найти массу вещества по числу молей и молярной массе:
m = ν • M (5)
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
6. Задачи на вывод формулы вещества по данным химического анализа относится к группе задач, которые решаются по формулам.
Для решения задач данного типа необходимо знать массовые доли элементов, которые входят в состав соединения.
Также необходимо знать, что общее содержание веществ в соединении равно 100%. Поэтому иногда в условии задачи указывается содержание не всех элементов, с учетом того, что неизвестное содержание второго или третьего элемента всегда можно определить.
Вопросы для закрепления теоретического материала к практическому занятию
Сформулируйте закон постоянства состава и закон сохранения массы вещества.
Кем и когда был сформулирован закон сохранения массы вещества?
Кем и когда был сформулирован закон постоянства состава?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
| Определить массовую долю в процентах азота в соединениях
(с точностью до сотых): |
| Вариант 1 | Вариант 2 |
| HNO3, N2O | N2O5, NH4OH |
Образец решения задания № 1
Вычислите массовую долю кислорода в ортофосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
Алгоритм решения
Дано: Ортофосфорная кислота H3PO4
Найти: (О) ?
Решение
1. Из Периодической таблицы Д.И. Менделеева выписываем значения относительных масс атомов элементов, входящих в состав ортофосфорной кислоты:
Ar(H) = 1 а.е.м., Ar(P) = 31 а.е.м., Ar(O) = 16 а.е.м
2. Записываем формулу расчета в общем виде Mr(H3PO4):
Mr(H3PO4) = n1*Ar(H) + n2*Ar(P) + n3*Ar(O)
3. Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем:
Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 а.е.м
4. Вычисляем массовую долю элементов по формуле (2):
(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31%.
Ответ: (O) = 65,31%.
Задание 2
| Вариант 1 | Вариант 2 |
| Выведите простейшую формулу вещества, содержащего
Na (массовая доля 43,2%),
С (11,3%), О (45,5%). | Найдите простейшую формулу гипосульфита натрия, если состав этого соединения следующий: Na (массовая доля 29,1%), S (40,5%), O (30,4%). |
Образец решения задания № 2
Установите формулу вещества, которое состоит из углерода
( = 25%) и алюминия ( = 75%).
Алгоритм решения
Дано: (С) = 25% (0,25)
(Аl) = 75% (0,75).
Найти: AlхCу.
Решение
1. Из Периодической таблицы Д.И. Менделеева выписываем значения относительных масс атомов элементов Al, С:
Аr(Al) = 27, Аr(С) = 12
Значит, молярные массы веществ равны соответственно:
M(Al) = 27 г/моль, М(С) = 12 г/моль
2. Из условия задачи нам известно, что (С) = 25% (0,25) и (Аl) = 75% (0,75), значит в 100 г вещества содержится:
m(AI) = 75 г и m(C) = 25 г
3. Определим, сколько количества вещества содержится в 75 г алюминия: (Al) для этого воспользуемся формулой нахождения количества вещества:
(Al) = m(AI) / M(Al)
подставляем значения в формулу и рассчитываем:
(Al) = 75 г / 27 г/моль = 2,78 моль
4. Определим, сколько количества вещества содержится в 25 г углерода для этого воспользуемся формулой нахождения количества вещества:
(C) = m(C) / M(C)
подставляем значения в формулу и рассчитываем:
(C) = 25 г / 12 г/моль = 2,08 моль (C)
(AI) : (C) = 2,78 : 2,08
Получившийся результат выражается десятичными числами, поэтому необходимо привести результат к целым.
а) принимаем меньшее число условно за 1 и производим операцию деления большего числа на меньшее и получаем:
2,78 : 2,08 = 1,34 : 1
б) в результате деления снова получили десятичное число, следовательно, нужно искать получившийся результат последовательным делением меньшего числа на натуральные числа: 2, 3, 4, 5 и т.д., до тех пор, пока полученная при делении величина не будет укладываться в большем числе целое количество раз.
2,08 : 2 = 1,04 2,78 : 1,04 = 2,67 : 1
2,08 : 3 = 0,69 2,78 : 0,69 = 4 : 3
Следовательно, индексы x и y в формуле вещества AlxCy равны 4 и 3, соответственно.
Ответ: Al4C3 (карбид алюминия).
Вопросы для контроля
Как практически используются законы постоянства состава и сохранения массы вещества?
Что выражает химическая формула?
Что выражает простейшая химическая формула?
Что выражает молекулярная (истинная) химическая формула?
Что выражает химическое уравнение?
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Химия».





















