
April 26, 2019
Санкт-Петербургский университет ГПС МЧС России
ЛЕКЦИИ ПО ФИЗИКЕ
Кафедра физики и теплотехники
« Основы молекулярной физики и термодинамики »
Профессор Звонов Валерий Степанович
[email protected]
2012

Молекулярно-кинетическая теория идеального газа
Основные вопросы:
- Тепловое движение.
- Основное уравнение молекулярно-кинетической теории идеального газа.
- Молекулярно-кинетический смысл температуры и давления.
- Распределение Максвелла для идеального газа.
- Распределение Больцмана.
- Барометрическая формула.
- Среднее число столкновений и длина свободного пробега.

Термодинамический и статистический подходы
1. Термодинамика или термодинамический подход - феноменологическое исследование явлений и свойств материальных тел, характеризуемых макроскопическими параметрами: P (давление) , V (объем), T (температура) и другими.
Основа подхода – 3 начала , или принципа , которые являются обобщением опыта. В этом подходе не выявляются микроскопические механизмы изучаемых явлений. Теплота, скажем, рассматривается как какое-то внутреннее движение, но при этом не конкретизируется какое.
2. Статистический подход - исходит из микроскопического описания. Для этого вводится представление об атомно-молекулярном строении вещества. В этом случае теплота рассматривается как проявление беспорядочного движения атомов и молекул. Законы поведения систем с большим числом частиц выводятся из статистических закономерностей.
Атомы и молекулы
Первые предположения о дискретном строении вещества выдвинули древнегреческие философы. Ученик Левкиппа Демокрит назвал мельчайшие частицы “неделимые”, что по-гречески значит ἄτομος “атом”. Это название мы используем и сегодня.
Демокрит, развил новое учение — “атомистику”, приписал атомам такие “современные” свойства, как размер и форму, способность к движению . Согласно Демокриту, даже душа человека состоит из атомов
Левкипп (500-440 до н.э.) учитель Демокрита
Демокрит (460-370 до н.э)
Эпикур придал древнегреческой атомистике завершенность, предположив, что у атомов существует внутренний источник движения и они сами способны взаимодействовать друг с другом.
К свойствам атома, обрисованным Демокритом, Эпикур прибавил вес атома . Он подчеркнул, что атомы имеют не только величину, фигуру, размеры, но и, будучи "тельцами", имеют определенную тяжесть.
«Нельзя жить разумно, нравственно и справедливо, не живя приятно»,- писал Эпикур
Эпикур (342-270 до н.э.)
Об учении атомистов не вспоминали 20 веков до Пьера Гассенди , который по крупицам восстановил учение древнегреческих атомистов в своих работах «О жизни, нравах и учении Эпикура» и «Свод философии Эпикура»
Тела состоят не из первичных атомов, а из их соединений , которые Гассенди называл «молекулами» (от слова moles – «масса»). Группируясь, атомы образуют все тела вселенной и являются, следовательно, причиной не только качеств тел, но и их движения; ими обусловливаются все силы природы. Он ввел понятие молекулы – массочки .
Пьер Гассенди
(1592-1655)
Историческая справка

Закон постоянного состава вещества
Закон постоянства состава , вывел французский химик Жозеф Луи Пруст на основании анализа химических соединений.
Его современная формулировка такова:
каким бы способом ни было получено вещество,
его химический состав остается постоянным
Жозеф Луи Пруст
(1754-1826)
Историческая справка

Закон кратных отношений
В 1807 г. Дальтон высказал атомную гипотезу (основу атомно-молекулярного учения о строении вещества):
любое вещество составлено из мельчайших химических частиц - атомов; простое вещество состоит из атомов одного элемента, сложное вещество - из атомов различных элементов
Из атомной гипотезы вытекает, что закон постоянства состава отражает именно атомный состав вещества:
в молекулу вещества объединяется определенное число именно атомов одного или различных элементов.
Закон кратных отношений , открытый Дальтоном, гласит:
если два элемента образуют между собой несколько соединений, то массы атомов одного элемента, приходящиеся на одну и ту же массу атомов другого элемента, соотносятся между собой как небольшие целые числа
Дж.Дальтон
(1766-1844)
1 атом NaCl состоит из 1 атома Na и 1 атома Cl. Вес одного атома Na составляет 23 /35 веса атома С l. Были установлены относительные веса атомов: H – 1, He – 4, C – 12, Na – 23, Cl – 35 …
U - 238
Историческая справка

Молекулы и атомы
В дальнейшем молекулярные представления приобретают более отчетливые очертания. Д.Бернулли в 1738 г. получил давление газа исходя из молекулярно - кинетической теории.
Д. Бернулли
(1700-1782)
М.В.Ломоносов также внес существенный вклад в молекулярно - кинетические представления. Он выступал против идеи “теплорода”, предсказал существование абсолютного нуля, считал, что причина тепла - вращение молекул.
М. В. Ломоносов утверждал, что все вещества состоят из корпускул — молекул , которые являются «собраниями» элементов — атомов . В своей диссертации «Элементы математической химии» (1741; незакончена) учёный дает такое определения: «Элемент есть часть тела, не состоящая из каких-либо других меньших и отличающихся от него тел… Корпускула есть собрание элементов, образующее одну малую массу».
М.В.Ломоносов
(1711-1765)
Историческая справка

Существует физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого вещества, которую называют количеством вещества ( ) .

В системе СИ единицей количества вещества ( ) является
МОЛЬ – количество вещества,
содержащее столько же частиц (атомов, молекул, ионов),
сколько содержится атомов
в 12 г углерода.
Молярная масса μ = m/n - масса 1 моля вещества
![Молярная масса масса одного моля вещества. М= [ г/моль ] молярная масса численно равна молекулярной массе , отсюда и](https://fsd.multiurok.ru/html/2019/04/26/s_5cc36b03e73df/img9.jpg)
Молярная масса
масса одного моля вещества.
М= [ г/моль ]
молярная масса численно равна молекулярной массе
, отсюда и

Закон Авогадро
В 1811 году Авогадро установил закон, который утверждал, что в одинаковых объемах газов содержится равное число молекул при одинаковых температурах и давлении.
Каким образом учёный пришёл к такому заключению?
Амедео Авогадро
(1776-1856)
Известно, что при протекании химической реакции между газами
соотношение объемов этих газов такое же, как и их молекулярное
соотношение.
Получается, что можно, измеряя плотность разных газов,
определять относительные массы молекул, из которых эти газы
состоят, и атомов.
То есть, если в 1 литре кислорода содержится столько
молекул, сколько и в 1 литре водорода,
то отношение плотностей этих газов
равно отношение масс молекул.

Закон Авогадро
Установлено
12 г изотопа углерода-12 содержит
6,02·10 23 атомов
Следовательно:
1 моль – порция вещества, содержащая число частиц, равное числу Авогадро:
N A = 6,022045(31) · 10 23 моль -1
Амедео Авогадро
(1776-1856)

Закон Авогадро
Из закона Авогадро вытекает важное следствие:
если в равных объемах всех газов содержится
одинаковое число молекул, то молекулярный вес
(m) любого газа должен быть пропорционален
его плотности: m = k·d (где d – плотность,
k - некий коэффициент пропорциональности).
Амедео Авогадро
(1776-1856)
Действительно, плотность (d) газа, как и любого физического тела, измеряется в граммах на литр. Если в литре какого-то газа с "тяжелыми" молекулами, и в литре другого газа – с "легкими" молекулами – этих молекул одинаковое число, то 1 л первого газа должен весить больше – иными словами, для него значение плотности в г/л будет выше.
Чтобы определить коэффициент пропорциональности k, можно воспользоваться измерениями плотности разных газов - например, водорода и кислорода.
Газ
Плотность d (г/л)
H 2
Молекулярн. вес
O 2
0,0894
Коэффициент k
2
1,427
22,37
32
22,42
Среднее значение: 22,4
1 МОЛЬ любого газа при
нормальных условиях (н.у.)
занимает объем 22,4 л.
Нормальными условиями (н.у.)
считают температуру 0 о С (273 K)
и давление 1 атм
(760 мм ртутного столба или 101 325 Па).

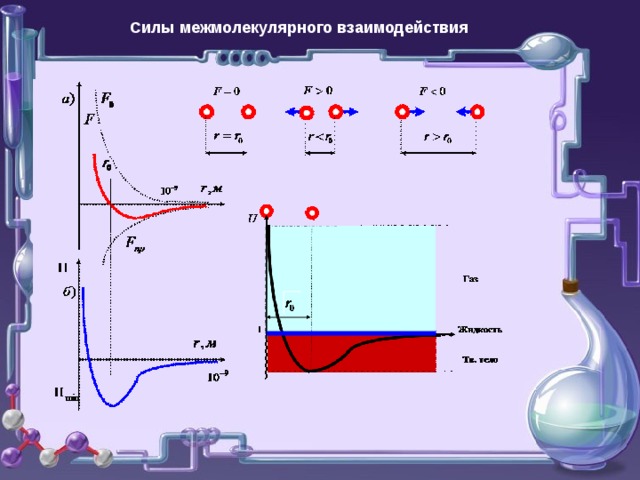
Силы межмолекулярного взаимодействия
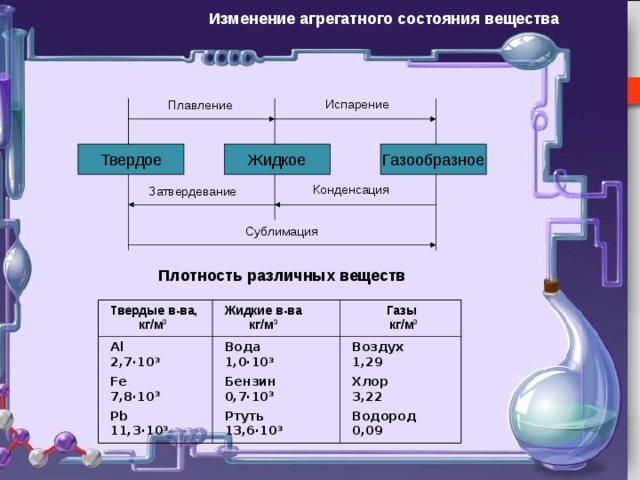
Изменение агрегатного состояния вещества
Испарение
Плавление
Жидкое
Газообразное
Твердое
Конденсация
Затвердевание
Сублимация
Плотность различных веществ
Твердые в-ва, кг / м 3
Al 2,7·10 3
Fe 7,8·10 3
Pb 11,3·10 3
Жидкие в-ва кг / м 3
Газы кг / м 3
Вода 1,0·10 3
Бензин 0,7·10 3
Ртуть 13,6·10 3
Воздух 1,29
Хлор 3,22
Водород 0,09

Молекулярно-кинетическая теория
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения :
1. Все вещества (тела) состоят из микрочастиц - молекул, атомов или ионов.
2. Микрочастицы находятся в непрерывном движении.
3. Микрочастицы взаимодействуют друг с другом. Между частицами существуют силы притяжения и отталкивания.

Модель идеального газа.
Для объяснения свойств вещества в газообразном состоянии в молекулярно-кинетической теории рассматривается модель идеального газа.
Под моделью идеального газа понимают газ, удовлетворяющий следующим условиям:
- молекулы газа обладают пренебрежимо малым объемом по сравнению с объемом сосуда, в котором находится газ;
- между молекулами отсутствуют силы притяжения и молекулы взаимодействуют только при соударении как абсолютно упругие тела;
- тепловое равновесие по всему объему достигается мгновенно.
Реальный газ приближается по своим свойствам к модели идеального газа при значительном разрежении.
Молекулярно-кинетическая теория
Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен
F x · t = 2m 0 · υ x
- Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен F x · t = 2m 0 · υ x
- Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен F x · t = 2m 0 · υ x
- Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен F x · t = 2m 0 · υ x
- Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен F x · t = 2m 0 · υ x
Пусть за время t о стенку ударяется N частиц, тогда они передадут стенке импульс
N · F x · t = 2m 0 · υ x · N
Число ударяющих о стенку молекул можно
определить через концентрацию частиц
и объем сосуда:
Тогда для проекции импульса силы получаем выражение:

Молекулярно-кинетическая теория
По определению давления :
Так как все направления движения частиц равновероятны, то для проекции скорости справедливо равенство:
Основное уравнение молекулярно-кинетической теории:
Это уравнение устанавливает связь между микро- и макропараметрами.

Молекулярно-кинетическая теория
Здесь p – давление газа,
v 2 – средняя скорость хаотического
движения молекул в сосуде, объем которого V.
n = N / V – концентрация молекул в сосуде;
m o – масса одной молекулы.
- средняя кинетическая энергия одной молекулы
Таким образом, давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа.

Молекулярно-кинетическая теория
Здесь ρ - плотность
С течением времени наступит тепловое равновесие.
Е 1 будет равняться Е 2
Е 2
Е 1

Молекулярно-кинетическая теория
R – универсальная газовая постоянная

Уравнение состояния идеального газа
Температура
Возникают вопросы: каким образом можно на опыте изменять среднюю кинетическую энергию движения молекул в сосуде неизменного объема? Какую физическую величину нужно изменить, чтобы изменилась средняя кинетическая энергия Опыт показывает, что такой величиной является температура.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо физического параметра.
Термометры должны быть откалиброваны.
Из того, что температура - это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Пересчёт температуры между основными шкалами
Кельвин (K)
Кельвин
Цельсий (°C)
= K
Цельсий
Фаренгейт (°F)
= С + 273,15
= K − 273,15
Фаренгейт
= (F + 459,67) / 1,8
= C
= K · 1,8 − 459,67
= (F − 32) / 1,8
= C · 1,8 + 32
= F

Скорости газовых молекул. Опыт Штерна
В средине XIX века была сформулирована молекулярно-кинетическая теория, но тогда не было никаких доказательств существования самих молекул. Вся теория базировалась на предположении о движении молекул, но как измерить скорость их движения, если они невидимы.

Теоретики первыми нашли выход. Из уравнения молекулярно-кинетической теории газов известно, что . Отсюда среднеквадратичная скорость равна:

Получена хорошая формула для расчета среднеквадратичной скорости, но масса молекулы неизвестна. Запишем по другому значение υ кв : А мы знаем, что , тогда где Р – давление; ρ плотность. Это уже измеряемые величины.

Например, при плотности азота, равной 1,25 кг/м 3 , при t = 0 С и , скорости молекул азота . Для водорода: При этом интересно отметить, что скорость звука в газе близка к скорости молекул в этом газе. Это объясняется тем, что звуковые волны переносятся молекулами газа.

O. STERN
Проверка того факта, что атомы и молекулы идеальных газов в термически равновесном пучке имеют различные скорости , была осуществлена немецким ученым Отто Штерном (1888 1969) в 1920 г.
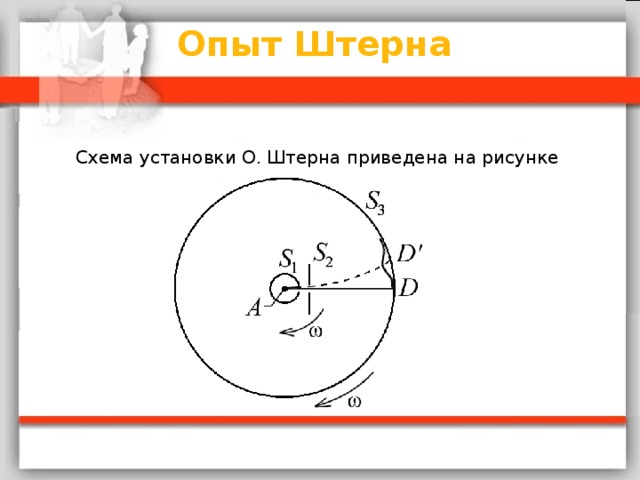
Опыт Штерна Схема установки О. Штерна приведена на рисунке


Температура нити в опытах Штерна равнялась 1200 С, что соответствует среднеквадратичной скорости молекул серебра В эксперименте получился разброс значений скорости от 560 до 640 м/с. Кроме того, изображение щели D всегда оказывалось размытым, что указывало на то, что атомы Ag движутся с различными скоростями .

Ещё в XIX веке Дж. Максвелл утверждал, что молекулы, беспорядочно сталкиваясь друг с другом, как-то «распределяются» по скоростям, причём вполне определённым образом.
Таким образом, в этом опыте были не только измерены скорости газовых молекул, но и показано, что они имеют большой разброс по скоростям . Причина – в хаотичности теплового движения молекул.
Что значит «распределяются по скоростям?
То есть существует наиболее вероятная скорость движения молекул.
Мало молекул с маленькими скоростями, мало молекул с большими скоростями

Математическое определение вероятности: вероятность какого-либо события – это предел, к которому стремится отношение числа случаев, приводящих к осуществлению события, к общему числу случаев, при бесконечном увеличении последних : Здесь n число раз, когда событие произошло, а n общее число опытов. Отсюда следует, что Р может принимать значения от нуля до единицы.

Определить распределение молекул по скоростям вовсе не значит, что нужно определить число молекул, Вопрос должен быть поставлен так: «Сколько молекул обладает скоростями, лежащими в интервале, включающем заданную скорость». Итак, молекулы движутся хаотически. Среди них есть и очень быстрые, и очень медленные. Благодаря беспорядочному движению и случайному характеру их взаимных столкновений, молекулы определённым образом распределяются по скоростям.

Мы будем искать число частиц ( n ) скорости которых лежат в определённом интервале значения скорости υ ( т.е. от υ до υ + Δ υ ).
Здесь n – число благоприятных молекул , попавших в этот интервал. Очевидно, что в единице объёма число таких благоприятных молекул тем больше, чем больше υ .

В данном случае f ( υ ) называют плотностью вероятности .

Распределение молекул идеального газа по скоростям впервые было получено знаменитым английским ученым Дж. Максвеллом в 1860 году с помощью методов теории вероятностей .

Скорость – векторная величина. Для проекции скорости на ось х ( x - ой составляющей скорости), имеем тогда или
Распределение Максвелла


Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям:
x – компонента скорости лежит в интервале от υ х до υ х + dυ х ;
y – компонента, в интервале от υ y до υ y + d υ y ;
z – компонента, в интервале от υ z до υ z + d υ z
будет равна произведению вероятностей каждого из условий ( событий ) в отдельности :
где

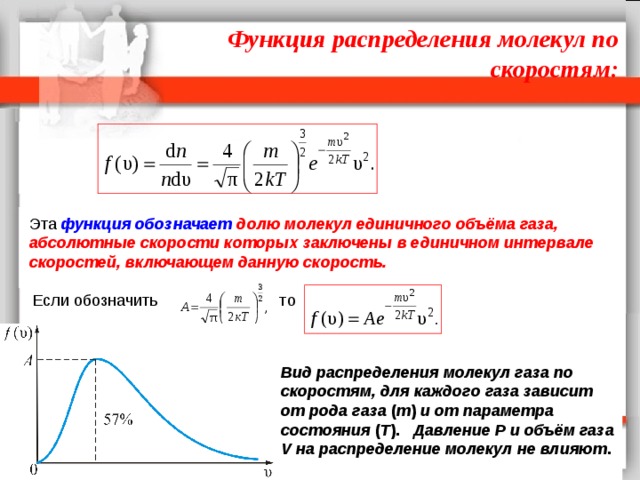
Функция распределения молекул по скоростям:
Эта функция обозначает долю молекул единичного объёма газа, абсолютные скорости которых заключены в единичном интервале скоростей, включающем данную скорость.
Если обозначить
то
Вид распределения молекул газа по скоростям, для каждого газа зависит от рода газа ( m ) и от параметра состояния ( Т ). Давление P и объём газа V на распределение молекул не влияют .
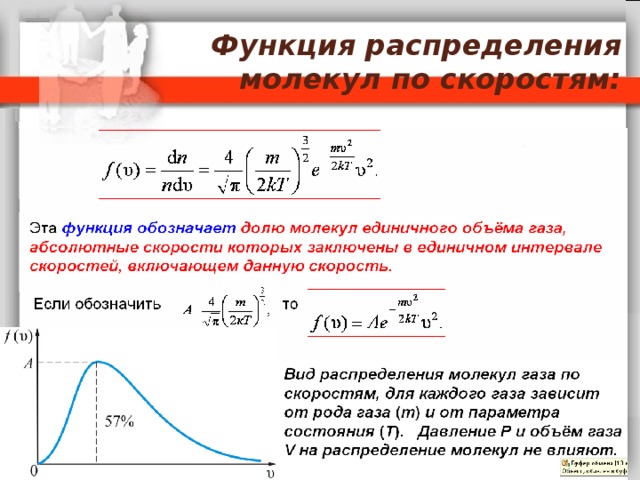
Функция распределения молекул по скоростям:

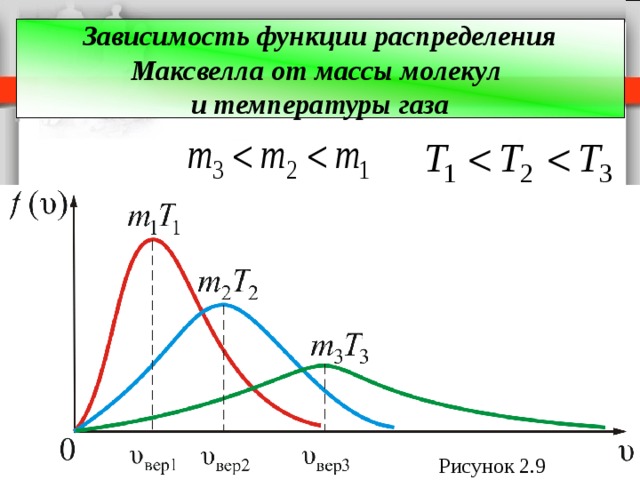
Зависимость функции распределения Максвелла от массы молекул и температуры газа
Рисунок 2.9

Барометрическая формула
Рассмотрим ещё один, очень важный закон.
Атмосферное давление на какой-либо высоте h обусловлено весом выше лежащих слоёв газа .
Пусть P – давление на высоте h , а – на высоте
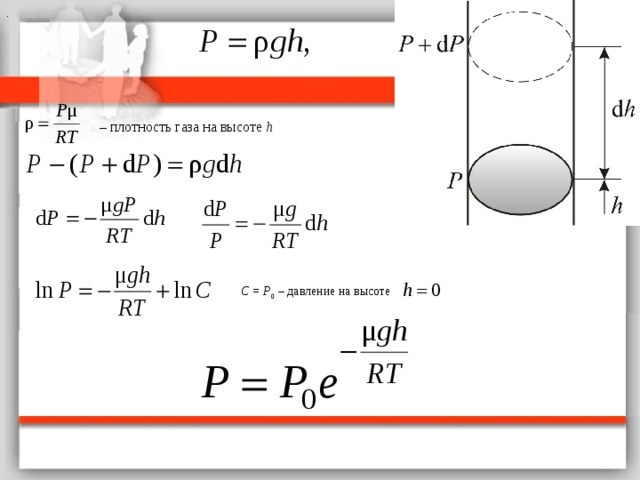
.
– плотность газа на высоте h
С = Р 0 – давление на высоте
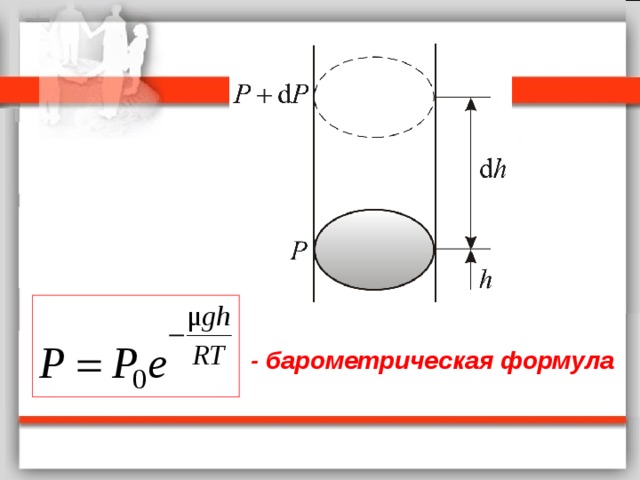
- барометрическая формула
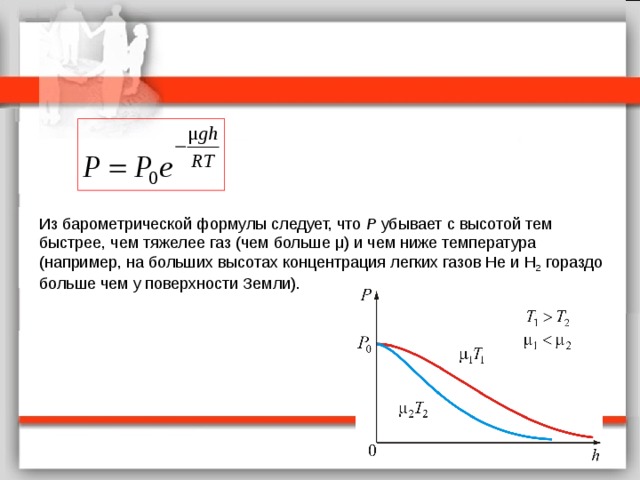
Из барометрической формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше μ) и чем ниже температура (например, на больших высотах концентрация легких газов Не и Н 2 гораздо больше чем у поверхности Земли).

Распределение Больцмана
Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия.
Людвиг Больцман
(1844-1906)

Исходя из основного уравнения молекулярно-кинетической теории: , заменим P и P 0 в барометрической формуле на n и n 0 и получим распределение Больцмана для молярной массы газа: где n 0 и n число молекул в единичном объёме на высоте h = 0 и h , соответственно.
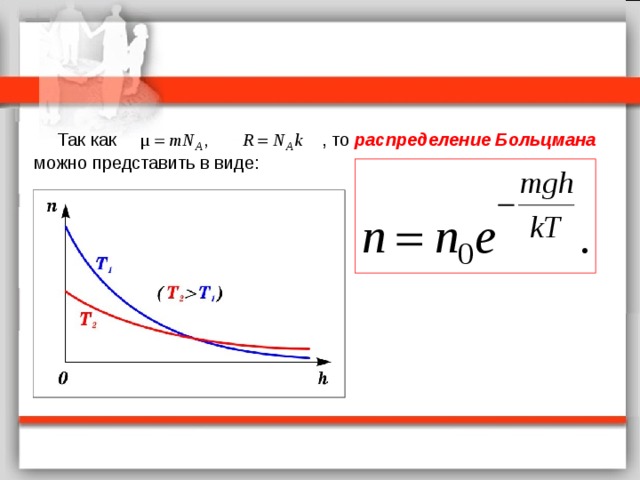
Так как , то распределение Больцмана можно представить в виде:

Так как –потенциальная энергия, следовательно, распределение Больцмана характеризует распределение частиц по значениям потенциальной энергии: – это закон распределения частиц по потенциальным энергиям – распределение Больцмана . Здесь n 0 – число молекул в единице объёма в там, где .

2.6. Закон распределения Максвелла-Больцмана
Мы получили выражение для распределения молекул по скоростям (распределение Максвелла):

Из этого выражения легко найти распределение молекул газа по значениям кинетической энергии K . Для этого перейдём от переменной υ к переменной : где d n( K ) – число молекул, имеющих кинетическую энергию поступательного движения, заключённую в интервале от K до

Отсюда получим функцию распределения молекул по энергиям теплового движения : Средняя кинетическая энергия молекулы идеального газа:

Итак, закон Максвелла даёт распределение частиц по значениям кинетической энергии а закон Больцмана – распределение частиц по значениям потенциальной энергии . Оба распределения можно объединить в единый закон Максвелла-Больцмана ,
Здесь n 0 – число молекул в единице объёма
в той точке, где U o
Это и есть закон распределения Максвелла-Больцмана.

БЛАГОДАРЮ ЗА ВНИМАНИЕ
Профессор Звонов Валерий Степанович Санкт-Петербургский университет государственной противопожарной службы МЧС России кафедра Физики и теплотехники
[email protected]

« Основы молекулярной физики и термодинамики »
Профессор Звонов Валерий Степанович Санкт-Петербургский университет государственной противопожарной службы МЧС России кафедра Физики и теплотехники

ВОПРОСЫ ?
Профессор Звонов Валерий Степанович Санкт-Петербургский университет государственной противопожарной службы МЧС России кафедра Физики и теплотехники

Основы термодинамики
- Закон равномерного распределения молекул по степеням свободы.
- Первое начало термодинамики.
- Работа газа при изменении его объема. Теплоемкость.
- Применение первого начала термодинамики к изопроцессам.
- Адиабатный и политропический процесс.
- Второе начало термодинамики.
- Цикл Карно и его КПД для идеального газа.
- Термодинамические функции состояния.















![Молярная масса масса одного моля вещества. М= [ г/моль ] молярная масса численно равна молекулярной массе , отсюда и](https://fsd.multiurok.ru/html/2019/04/26/s_5cc36b03e73df/img9.jpg)





























































