
«Кремний и его соединения»
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Кремниевая (силиконовая) долина
- Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
- Кремний является природным полупроводником, используется как основной материал для производства микросхем.
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

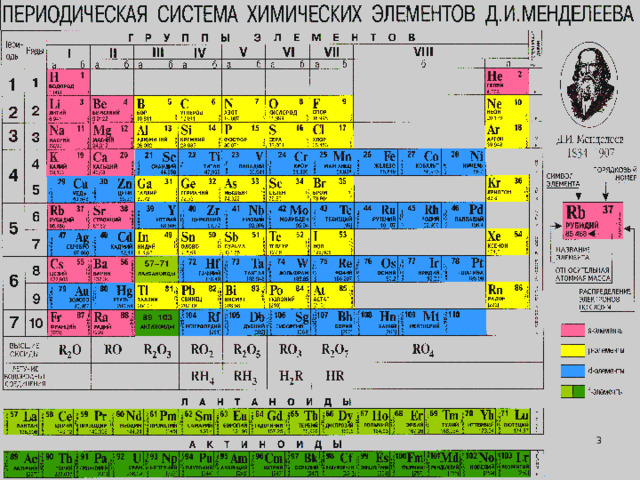
Строение атома кремния
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Строение атома
Положение в ПС: период III; группа IV, главная;
Заряд ядра: +14 Si;
Относительная атомная масса: Ar (Si)=28
Строение атома: p=14, e=14, n=28 - 14 =14
Электронная формула: +14 Si 2e;8e;4e;
+14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
Неметалл;
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан
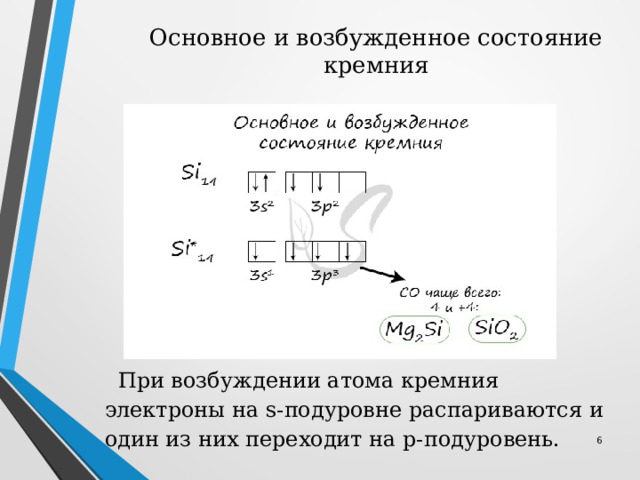
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
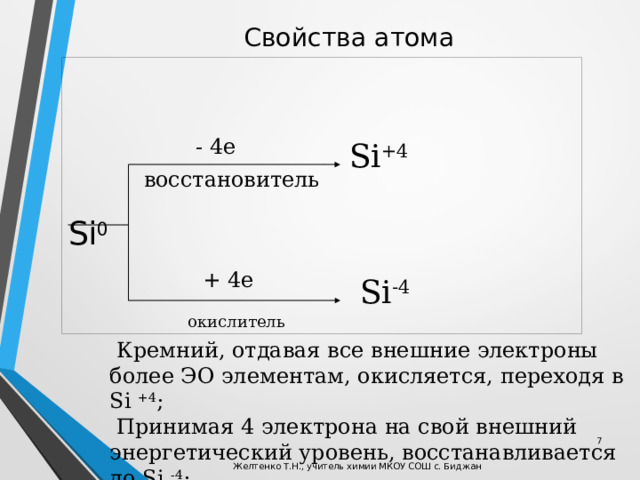
Свойства атома
Si 0
- 4е
Si +4
восстановитель
+ 4е
Si -4
окислитель
Кремний, отдавая все внешние электроны более ЭО элементам, окисляется, переходя в Si +4 ;
Принимая 4 электрона на свой внешний энергетический уровень, восстанавливается до Si -4 ;
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Физические свойства кремния
Кремний – неметалл, существует в кристаллическом и аморфном состоянии.
Кристаллический кремний – вещество серовато – стального цвета с металлическим блеском, весьма твердое, но хрупкое. Аморфный кремний – бурый порошок.
р = 2,33 г/см 3 ; t пл. = 1415 0 С; t кип. = 3500 0 С;
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Кристаллическая структура кремния
Кристаллическая решетка
кремния кубическая
гранецентрированная типа алмаза.
Но из-за большей длины связи
между Si – Si, твердость кремния значительно меньше, чем алмаза.
Кремний хрупок, только при нагревании выше 800 0 С.
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Электрофизические свойства
Элементарный кремний — типичный полупроводник.
На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси.
Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы.
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Кремний в природе
Кремний в свободном виде в природе не встречается.
Кремний – второй по распространенности элемент ПСХЭ.
В природе встречается в
виде кремнезема (SiO 2 ), силикатов и алюмосиликатов.
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Кремень
Кремень, именно этот невзрачный и очень прочный камень, положил начало каменному веку – веку кремневых орудий труда.
Причин две:
- распространенность и доступность кремния;
- способность образовывать при сколе острые режущие края
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Разновидности минералов на основе оксида кремния
Кварц
Опал
Агат
Горный
Цитрин
хрусталь
Сердолик
Яшма
Кошачий
Аметист
глаз
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Химические свойства кремния
Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II - несолеобразующий оксид.
- Si + Cl 2 → (t) SiCl 4
- Si + C → (t) SiC
- Si + O 2 → (t) SiO 2
- Si + O 2 → (t = 1200 °C) SiO
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Химические свойства кремния
Реакции с металлами
В подобных реакциях кремния проявляет свои окислительные способности.
- Ca + Si → Ca 2 Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
- KOH + Si → K 2 SiO 3 + H 2 ↑
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Оксид кремния IV - SiO 2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O 2 → SiO 2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO 2 , который выпадает в осадок, и воду.
Na 2 SiO 3 + CH 3 COOH → CH 3 COONa + H 2 SiO 3 ↓
H 2 SiO 3 → SiO 2 + H 2 O
Оксид кремния IV - SiO 2
Оксид кремния IV - SiO 2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O 2 → SiO 2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO 2 , который выпадает в осадок, и воду.
Na 2 SiO 3 + CH 3 COOH → CH 3 COONa + H 2 SiO 3 ↓
H 2 SiO 3 → SiO 2 + H 2 O
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Химические свойства SiO2
Реакции с кислотами
Химически SiO 2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
- SiO 2 + HF → SiF 4 + H 2 O
Реакции с основными оксидами и щелочами
SiO 2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты - силикаты.
- MgO + SiO 2 → MgSiO 3
- NaOH + SiO 2 → Na 2 SiO 3 + H 2 O
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Реакции c карбонатами
Чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
- K 2 CO 3 + SiO 2 → K 2 SiO 3 + CO 2 ↑
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Кремниевая кислота H2SiO3
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO 2 с водой ее не получить. Эту задачу решают в две стадии через ее соли - силикаты.
- LiOH + SiO 2 → Li 2 SiO 3 + H 2 O
- Li 2 SiO 3 + HCl → LiCl + H 2 SiO 3 ↓
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Химические свойства H2SiO3
Кремниевая кислота слабая, неустойчивая, легко распадается на воду и оксид кремния IV.
- H 2 SiO 3 → H 2 O + SiO 2
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Получение кремния
В промышленности кремний получают восстанавливая расплав SiO 2 коксом при
t = 1800 0 C в дуговых печах. Чистота полученного таким образом кремния составляет 99,9 %.
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Получение кремния
Лабораторный способ получения:
SiO 2 + 2 Mg 2MgO + Si
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан
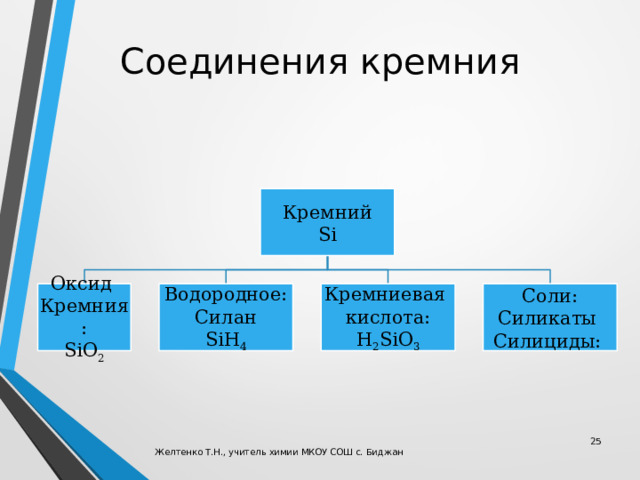
Соединения кремния
Кремний
Si
Кремниевая
Оксид
Соли:
Водородное:
Силикаты
кислота:
Кремния:
Силан
SiH 4
SiO 2
H 2 SiO 3
Силициды:
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Применение кремния и его соединений
Фарфор
Керамика
Кирпич
Цемент
Стекло
Фаянс
Клей
Асбест
Гранит
Силикон
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан
25

Применение кремния в технике
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан
25

Применение кремния в медицине
25
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Биологическая роль
Важнейшее соединение кремния – SiO 2 необходим для жизни растений и животных.
Благодаря ему тростники, камыши
и хвощи стоят крепко, как штыки.
Острые листья осоки режут, как
ножи, стерня на скошенном поле
колет, как иголки, а стебли злаков
настолько крепки, что не позволяют
ниве на полях ложиться от дождя и ветра
25
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Биологическая роль
Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем.
25
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан
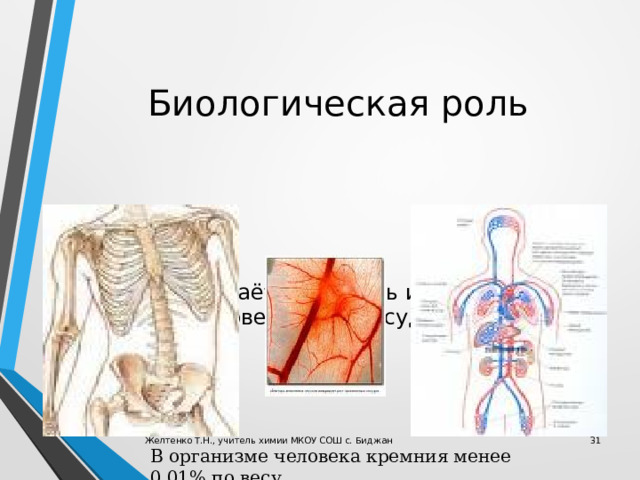
Биологическая роль
Кремний придаёт гладкость и прочность костям и кровеносным сосудам человека.
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан
25
В организме человека кремния менее 0,01% по весу.

Кремний - микроэлемент, постоянно содержащийся в организме человека. Наибольшее его количество содержится в лимфоузлах, соединительной ткани аорты, трахеи, в волосах и коже. Кремний необходим для построения эпителиальных клеток.
Кремний играет важную роль в процессе минерализации костной ткани; необходим для поддержания эластичности стенки артерий, оказывает положительное влияние на иммунитет и замедляет процессы старения в тканях организма человека. Среднее содержание кремния в крови составляет 8,25 мг/сутки. С возрастом его уровень в организме снижается, поэтому у пожилых людей потребность в кремнии, как правило, повышается. Улучшают усвоение кремния организмом наличие кальция, магния, марганца и калия.
25
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Биологическая роль
Кремний входит и в состав низших живых организмов – диатомовых водорослей и радиолярий, - нежнейших комочков живой материи, которые создают свои непревзойденные по красоте скелеты из кремнезема.
Радиолярии
Диатомовые водоросли
25
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Кремний в продуктах питания
25
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан

Блиц-опрос по теме Кремний
1. Выберите химическую формулу кварца
а.SiF 4 б.SiO 2 с. SiO д. Si
2. Кремний в реакции с металлами
а. Не вступает б. Образует силикаты
с. Образует силициды д. Образуется сульфаты
3. Оксид кремния IV обладает ... строением
а. Атомным б. Ионным с. Молекулярным д.Металлическим
4. Кремниевая кислота отличается от многих других кислот тем, что она
а. Слабая б. Сильная с. Слабый электролит д. Нерастворима
5. Соли кремниевой кислоты носят названия
А. Силициды б. Силикаты с. Сульфиды д. Сульфаты
25
Желтенко Т.Н., учитель химии МКОУ СОШ с. Биджан


























































