
1.3. Строение вещества. ОВР .
1.3.2. Окислительно-восстановительные реакции .

Требования к знаниям и умениям
- знать правила определения степеней окисления в различных соединениях
- знать понятия ОВР, окислитель и окисление, восстановитель и восстановление, правила расстановки коэффициентов в ОВР методом электронного баланса
- уметь определять степень окисления в соединениях, составлять формулы веществ с определенной степенью окисления и называть их
- уметь определить является ли реакция ОВР, определять какой из элементов является окислителем, а какой восстановителем, когда и за счет чего протекает окислительный или восстановительный процесс, сколько электронов теряет или при приобретает элемент при изменении степени окисления элемента, расставлять коэффициенты в ОВР методом электронного баланса

Одной из важнейших характеристик химического элемента, входящего в состав вещества является его степень окисления.
- Степень окисления - это условный заряд, который мог бы появиться на атоме, если бы все электроны образующие его химические связи сместились к более электроотрицательному атому.
- Степень окисления элементов в простом веществе равна нулю . Примеры: Na 0 , H 0 2 , P 0 4 . Все элементы могут иметь такую степень окисления.
- Сумма степеней окисления всех атомов в сложном веществе равна нулю, а в ионе – заряду иона . Есть элементы, которые могут иметь только одну с.о. (кроме 0) и ее легко можно определить по положению элемента в ПС, а есть элементы с переменной степенью окисления и ее надо уметь определять по формуле вещества.

Рассмотрим применение этого правила на простых примерах.
- Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3 ).
- Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
- Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 .
- Пример 4 . Определите степени окисления всех элементов в (NH 4 ) 2 SO 4 .

Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3 ).
Решение . 1) Обозначим известную с. о. водорода, она равна +1.
2) Неизвестную степень окисления азота обозначаем «х».
3) Составляем простейшее уравнение: х + 3∙(+1) = 0.
Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . 1) Степени окисления водорода и кислорода уже известны: H(+1) и O(-2).
2) Неизвестную с.о. серы обозначаем – х.
3)Составляем уравнение для определения степени окисления серы: 2∙(+1) + х + 4∙(-2) = 0.
Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .

Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 .
Решение . Алгоритм остается неизменным.
В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1∙(+3) + 3х + 9∙(-2) = 0. Ответ: Al +3 (N +5 O -2 3 ) 3 .
Пример 4 . Определите степени окисления всех элементов в (NH 4 ) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота - нет. Решить уравнение с двумя неизвестными мы не можем. Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Получаются уравнения: х+4 = 1 и х + 4∙(-2) = -2 Находим с.о. азота и серы. Ответ: (N -3 H 4 +1 ) 2 S +6 O 4 -2 .

Рассчитайте степени окисления всех элементов :
MnO 2 , Na 2 SO 3 , Zn, FeCl 3 , Cr 3 N 2 , O 3 , CoSO 4 ,(NH 4 ) 3 PO 4

Проверьте себя. Где вы сделали ошибку? Почему?
- Mn +4 O 2 -2
- Na + 2 S +4 O -2 3
- Zn 0
- Fe +3 Cl 3
- O 0 3
- Cr +2 3 N -3 2
- Co +2 S +6 O -2 4
- (N -3 H + 4 ) 3 P +5 O -2 4
 Hg + O 2 Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР) . " width="640"
Hg + O 2 Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР) . " width="640"
- Определите, какие из реакций относятся к ОВР?
- Fe(OH) 3 + HCl → FeCl 3 + H 2 O
- H 2 S + O 2 → H 2 O + SO 2
- HgO = Hg + O 2
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР) .
 Hg 0 + O 0 2 " width="640"
Hg 0 + O 0 2 " width="640"
Проверьте себя
- Fe +3 (O -2 H + ) 3 + H + Cl - → Fe +3 Cl - 3 + H + 2 O -2
- H + 2 S -2 + O 0 2 → H + 2 O -2 + S +4 O -2 2
- Hg +2 O -2 = Hg 0 + O 0 2

Окисление —это процесс, в котором элемент теряет свои электроны. Элемент, который теряет электроны и повышает степень окисления, называется восстановитель .
- Если атом отдает свои электроны, то он приобретает положительный заряд:
Zn 0 -2e = Zn +2
- Если отрицательно заряженный ион (заряд -1), например Сl - , отдает один электрон, то он становится нейтральным атомом: Cl - - 1e =Cl 0
- Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов: Fe +2 - 1e = Fe +3 S +4 - 2e = S +6 Mn +2 - 4e = Mn +6

Восстановление — это процесс, в котором элемент присоединяет электроны. Элемент, который присоединяет электроны и понижает степень окисления, называется окислителем.
- Если атом присоединяет электроны, то появляется отрицательная степень окисления:
S 0 + 2e = S -2 Br 0 + 1e = Br -
- Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
S +6 + 2e = S + 4 Mn +7 + 5e = Mn +2
- или положительный ион может превратится в нейтральный атом:
H + + 1e = H 0 Al +3 + 3e = Al 0 .
 Ca +2 ; б) Al +3 …..= Al 0 в) S -2 …..= S 0 ; г) Sb +5 …..= Sb +2 д) N +5 …..= N -3 " width="640"
Ca +2 ; б) Al +3 …..= Al 0 в) S -2 …..= S 0 ; г) Sb +5 …..= Sb +2 д) N +5 …..= N -3 " width="640"
По изменению степени окисления определите сколько электронов атом принял или потерял. Обозначьте: где происходит процесс окисления, а где – восстановления? какой из элементов будет окислителем, а какой – восстановителем?
- а) Ca 0 …..= Ca +2 ;
- б) Al +3 …..= Al 0
- в) S -2 …..= S 0 ;
- г) Sb +5 …..= Sb +2
- д) N +5 …..= N -3

Рассмотрите схему и сделайте вывод:
Как зависят окислительные и восстановительные свойства от степени окисления элементов?
S -2 → S 0 → S +4 → S +6
S -2 ← S 0 ← S +4 ← S +6

- Сера (-2) теряет электроны, т.е. проявляет восстановительные свойства, она не может принять электроны и быть окислителем: S -2 → S 0 → S +4 → S +6
- Сера (+6) принимает электроны, т.е. проявляет окислительные свойства, она не может отдать электроны и быть восстановителем: S -2 ← S 0 ← S +4 ← S +6
- В других степенях окисления сера может быть и окислителем, и восстановителем, в зависимости от того, с кем и при каких условиях она взаимодействует.

Вывод:
Окислительные и восстановительные свойства элементов и их соединений зависят и от свойств элемента и от степени окисления в которой находится элемент: min с.о. – элемент не может принять электроны и быть окислителем, только восстановительные свойства max с.о. - элемент не может отдать электроны и быть восстановителем, только окислительные свойства
промежуточные с.о. – элемент может быть и окислителем, и восстановителем

Определите какие ОВ свойства будут характерны для элементов:
Мg 0 Cu +2 Al +3 Cl 0 Sb +5 N -3 N +2

Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса.
1) Запишите схему реакции (формулы исходных веществ и продуктов реакции).
2) Определите и сравните степени окисления элементов до и после реакции.
3) Выбрать (подчеркнуть) элементы, степени, окисления которых изменяются.
4)Выписать эти элементы (простые вещества выписываются с индексами).
5) Определить сколько отдал или принял элемент электронов (помнить, что электроны заряжены отрицательно).Количество электронов с участием простых веществ умножается на индекс, а перед ионом выставляется коэффициент, равный индексу.
6) Определите окислитель и восстановитель (окислитель всегда принимает электроны – степень окисления понижается, восстановитель их отдает – степень окисления повышается).
7) Выписать то количество электронов, которое определили. Найти для этих чисел наименьшее кратное.

Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса. (продолжение)
8 ) Определить коэффициенты (разделив поочередно наименьшее кратное на количество электронов).
9) Определить процесс окисления и восстановления (окислитель в процессе реакции восстанавливается, восстановитель окисляется).
10) Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса. Полученные коэффициенты поставить в правой части уравнения (после стрелки) перед теми элементами, напротив которых они стоят в окислительно-восстановительном балансе. Если атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения (в последнем уравнении для кислорода).
11) Уравнять правую и левую части уравнения (проверить по кислороду, количество атомов кислорода справа и слева должно быть одинаковым).
12) Устно проверьте правильность составленного уравнения.

Электронный баланс в ОВР
0
+1
-1
0
-1
+2
Zn + 2HCl = ZnCl 2 + H 2
+2
0
Восстановитель
0
+1
Окислитель

- 1) CH 4 + O 2 → CO 2 + H 2 O
- 2) NH 3 + O 2 → NO + H 2 O
- 3) N 2 + Na → Na 3 N
- 4) P + Mg → Mg 3 P 2
- 5) H 3 PO 4 + Ca → Ca 3 (PO 4 ) 2 + H 2
- 6) Al + PbCl 2 → Al Cl 3 + Pb
- 7) KI + Cu(NO 3 ) 2 → CuI + I 2 + KNO 3
- 8) MnS + HNO 3 → MnSO 4 + NO 2 + H 2 O
- 9) NH 4 NO 3 → N 2 O + H 2 O
- 10) NaClO → NaClO 3 + NaCl
Пользуясь алгоритмом, определите степени окисления элементов; укажите окислитель и восстановитель; расставьте коэффициенты в ОВР методом электронного баланса. .

Окислительно-восстановительные процессы сопровождают круговороты веществ в природе. С ними связаны процессы брожения, и гниения, горение топлива, процессы фотосинтеза и дыхания, протекающие в живых организмах.
Значение ОРВ

- Получение оксидов и других соединений в неорганическом и органическом синтезе;
- Получение металлов из их природных соединений;
- Получение многих продуктов питания (кисломолочные продукты, квашение овощей);
- Переработка отходов различных производств.
Применение ОВР

- Обычно в ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции выделяется в виде тепла.
- Но! Энергия любой ОВР может быть превращена в электрическую энергию. Это реализовано в гальванических элементах (батарейках), где электрическая энергия получается из химической энергии ОВР.

Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы.
Если металлическую пластину (электрод) опустить в водный раствор, то на границе металл-раствор будут происходить химические процессы.
В результате этого ОВ процесса между раствором и металлом, на электроде появляется электрический заряд. А на границе металл – раствор – двойной электрический слой.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Его значение и знак (+ или -) определяются природой раствора и находящегося в нем металла.

- Электродные потенциалы металлов были измерены при определенных (стандартных) условиях относительно нормального водородного электрода (его потенциал принят равным нулю).
- Если расположить металлы в порядке возрастания их электродных потенциалов мы получим ряд активности металлов, которым научились пользоваться еще в школе.
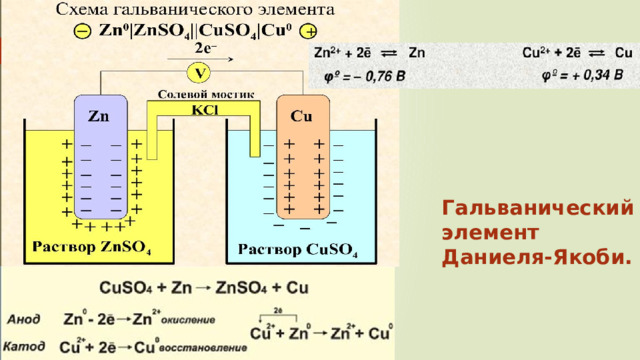
Гальванический элемент Даниеля-Якоби.

Электродные потенциалы металлов

Определить электродные потенциалы можно для любого ОВ процесса. Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников.


Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют
- 1) предсказать какие ОВ свойства будут проявлять атомы, ионы или молекулы в химических реакциях. Например
E° (F 2 /2F — ) = +2,87 В – сильнейший окислитель
E° (K + /K) = — 2,924 В – сильнейший восстановитель
- 2) предсказать возможность самопроизвольного протекания ОВР
 0, то реакция возможна. Если ∑ Если ∑ = 0, то в системе равновесие, значит возможность прямой или обратной реакции зависит от условий (концентрации о-в, кислотности среды, температуры). " width="640"
0, то реакция возможна. Если ∑ Если ∑ = 0, то в системе равновесие, значит возможность прямой или обратной реакции зависит от условий (концентрации о-в, кислотности среды, температуры). " width="640"
Алгоритм определения возможности протекания ОВР
- По таблице потенциалов определить потенциал окислителя и восстановителя. Во всех справочниках потенциалы указаны для окислителей, поэтому для восстановителя величину потенциала берут с противоположным знаком.
- Найти алгебраическую сумму потенциалов окислителя и восстановителя.
- Если ∑ 0, то реакция возможна.
- Если ∑
- Если ∑ = 0, то в системе равновесие, значит возможность прямой или обратной реакции зависит от условий (концентрации о-в, кислотности среды, температуры).
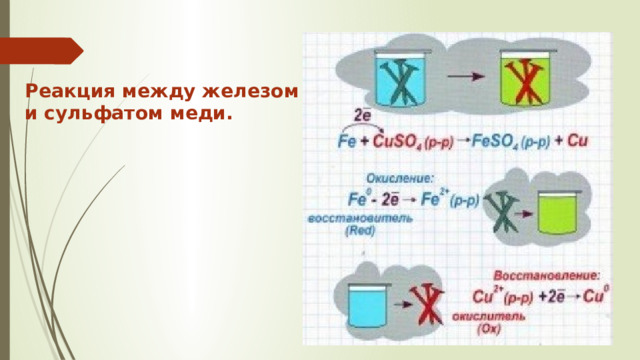
Реакция между железом и сульфатом меди.

Возможна ли ОВР между веществами (при с.у) Допишите уравнения возможных реакций.
- 1) Zn + HCl →
- 2) Al + PbCl 2 →
- 3) Cr + ZnBr 2 →
- 4) Sn + Pb(NO 3 ) 2 →
- 5) Hg + CuSO 4 →
- 6) Ag + HCl →
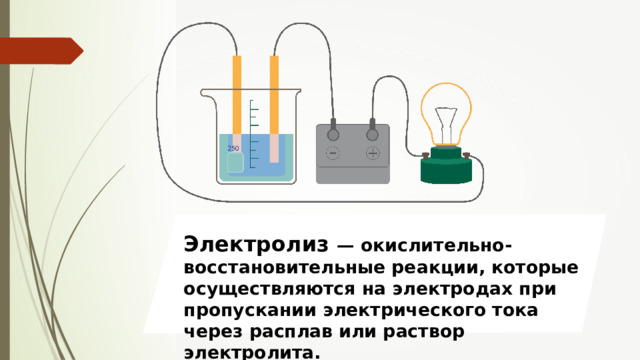
Электролиз — окислительно-восстановительные реакции, которые осуществляются на электродах при пропускании электрического тока через расплав или раствор электролита.

Электролиз расплава хлорида натрия
–
+
электроны
+
–
Анод
Катод
+
NaCl = Na + Cl
–
Cl 2 ↑
–
Cl
+
Na
Na
–
Cl
+
Na

Диссоциация молекул воды при электролизе растворов
–
+
электроны
+
–
–
+
→
Н 2 О Н + ОH
Анод
Катод
→
Cl 2 ↑
–
+
–
OH
Cl
H
+
Na
Na
–
–
OH
+
Cl
+
H
Na
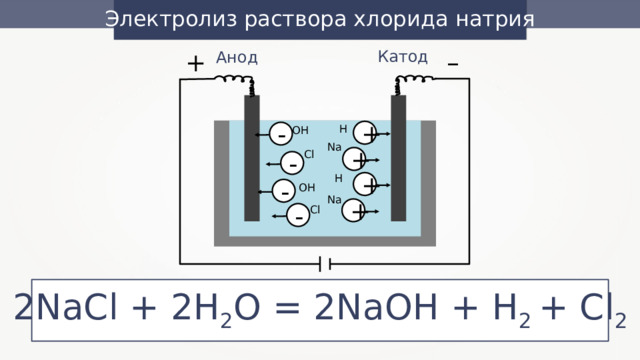
Электролиз раствора хлорида натрия
Катод
–
+
Анод
H
OH
+
-
Na
Cl
+
-
H
+
OH
-
Na
+
Cl
-
2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2

Применение электролиза















 Hg + O 2 Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР) . " width="640"
Hg + O 2 Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР) . " width="640"
 Hg 0 + O 0 2 " width="640"
Hg 0 + O 0 2 " width="640"


 Ca +2 ; б) Al +3 …..= Al 0 в) S -2 …..= S 0 ; г) Sb +5 …..= Sb +2 д) N +5 …..= N -3 " width="640"
Ca +2 ; б) Al +3 …..= Al 0 в) S -2 …..= S 0 ; г) Sb +5 …..= Sb +2 д) N +5 …..= N -3 " width="640"


















 0, то реакция возможна. Если ∑ Если ∑ = 0, то в системе равновесие, значит возможность прямой или обратной реакции зависит от условий (концентрации о-в, кислотности среды, температуры). " width="640"
0, то реакция возможна. Если ∑ Если ∑ = 0, то в системе равновесие, значит возможность прямой или обратной реакции зависит от условий (концентрации о-в, кислотности среды, температуры). " width="640"

























