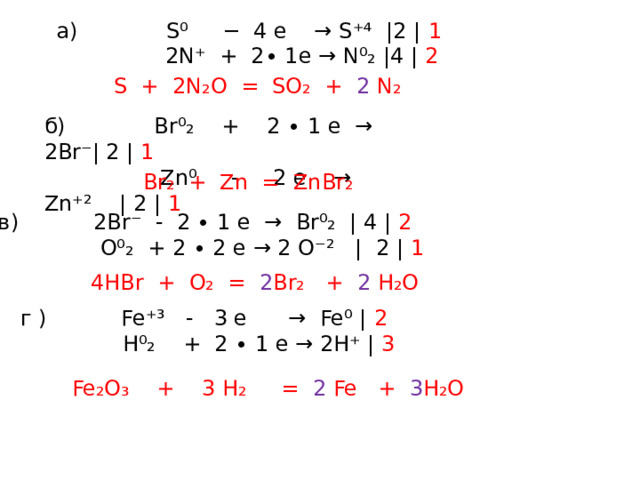Упражнения в составлении ОВР.



Процессы восстановления ( +е )
P⁰ + 3e → P ‾ ³ Na⁺ + 1e → Na⁰
S⁺⁴ + 2e → S⁺2 S⁰ + 4e → S-⁴
Cl⁰ + 1e → Cl ‾ Cl⁺⁷ + 8e → Cl-¹
степень окисления У М Е Н Ь Ш А Е Т С Я

Процессы окисления ( - е )
Ba⁰ - 2e → Ba⁺² S ‾ ² - 2e → S⁰
Fe⁺² - 1e → Fe⁺
Na⁰ - 1e → Na⁺
степень окисления У В Е Л И Ч И В А Е Т С Я

ПРИМЕРЫ
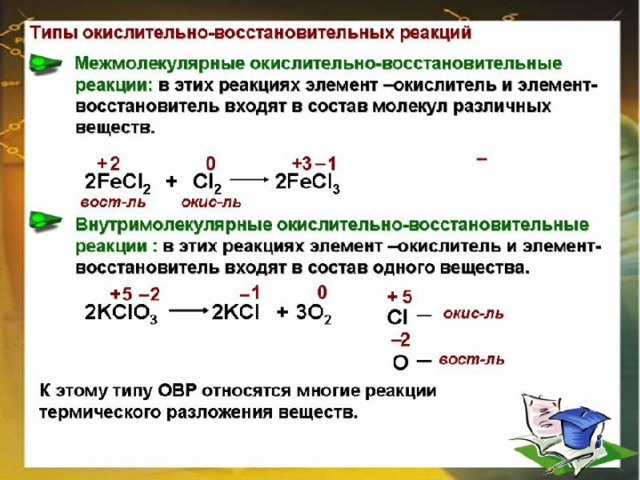
H₂S ‾ ² + O₂⁰ = H₂O ‾ ² + S⁺⁴O₂
Окисление: S ‾ ² - 6e → S⁺⁴ |4 | 2 Восстановление: O₂⁰ + 4e → 2O ‾ ² | 6| 3
Окислитель : O₂⁰ Восстановитель: S ‾ ²
2 H₂S ‾ ² + 3 O₂⁰ = 2 H₂O ‾ ² + 2 S⁺⁴O₂
P ⁰ + Na⁰ → Na⁺₃P ‾ ³
Восстановление: P⁰ + 3e → P ‾ ³ | 1
Окисление: Na⁰ - 1e → Na⁺ | 3
P⁰ - окислитель Na⁰ - восстановитель
P ⁰ + 3 Na⁰ = Na⁺ ₃ P ‾ ³



СОСТАВЛЕНИЕ ОВР методом электронного баланса
1. Определим степени окисления элементов в уравнении реакции.
2. Подчеркнем символы элементов, изменяющие степени
окисления.
3. Составим электронный баланс
( уравнения процессов окисления – восстановления).
Находим множители для уравнений процессов
окисления-восстановления.
4. Найденные множители запишем перед формулами продуктов
окислителя и восстановителя, то есть в правую часть уравнения
реакции.
5. Расставим коэффициенты в уравнении реакции:
А) продукты окисления-восстановления
Б) металлы
В) неметаллы
Г) водород
Д) кислород.
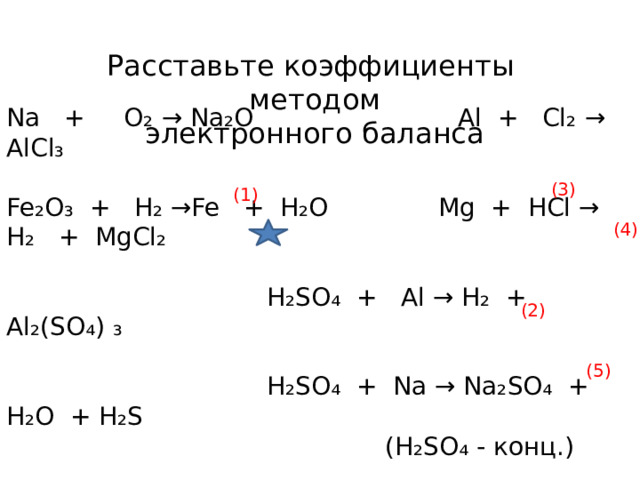
Расставьте коэффициенты методом
электронного баланса
Na + O₂ → Na₂O Al + Cl₂ → AlCl₃
Fe₂O₃ + H₂ → Fe + H₂O Mg + HCl → H₂ + MgCl₂
H₂SO₄ + Al → H₂ + Al₂(SO₄) ₃
H₂SO₄ + Na → Na₂SO₄ + H₂O + H₂S
(H₂SO₄ - конц.)
(3)
(1)
(4)
(2)
(5)
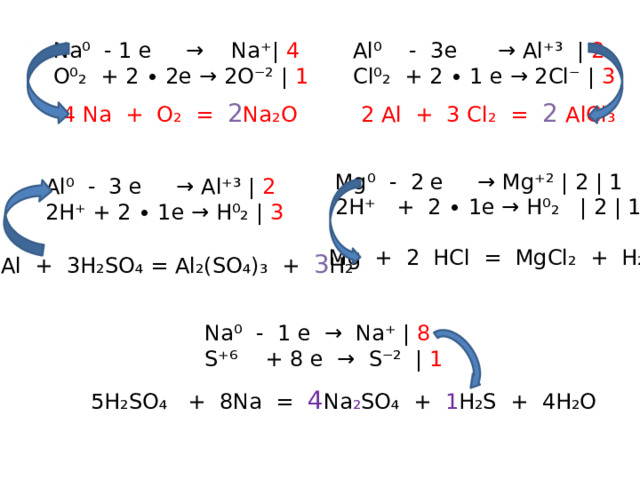
Na⁰ - 1 e → Na⁺| 4
Al⁰ - 3e → Al⁺³ | 2
O⁰₂ + 2 ∙ 2e → 2O⁻² | 1
Cl⁰₂ + 2 ∙ 1 e → 2Cl⁻ | 3
2 Al + 3 Cl₂ = 2 AlCl₃
4 Na + O₂ = 2 Na₂O
Mg⁰ - 2 e → Mg⁺² | 2 | 1
2H⁺ + 2 ∙ 1e → H⁰₂ | 2 | 1
Al⁰ - 3 e → Al⁺³ | 2
2H⁺ + 2 ∙ 1e → H⁰₂ | 3
Mg + 2 HCl = MgCl₂ + H₂
2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3 H₂
Na⁰ - 1 e → Na⁺ | 8
S⁺⁶ + 8 e → S⁻² | 1
5H₂SO₄ + 8Na = 4 Na ₂ SO₄ + 1 H₂S + 4H₂O


Т Е С Т
- Укажите ОВР: а) PH₃ + 2O₂ = H₃PO₄
б) KOH + HCl = KCl + H₂O
в) CO₂ + CaO = CaCO₃
г) P₂O₅ + H₂O = 2HPO₃
ОТВЕТ: А
- Укажите какие процессы происходят:
а) N⁰₂ - 4e → 2N⁺²
б) S⁺⁶ + 2e → S⁺⁴
в) Fe⁰ - 3e → Fe⁺³
г) P⁺³ + 2e → P⁺⁵
ОТВЕТ: а, в - окисление; б, г - восстановление
3. Cоставьте ОВР методом электронного баланса. Определите окислитель и восстановитель.
а) S + N ₂O → SO₂ + N₂ б) Br₂ + Zn → ZnBr₂
в) H Br + O₂ → H₂O + Br₂ г) Fe ₂O₃ + H₂ → H ₂ O + Fe
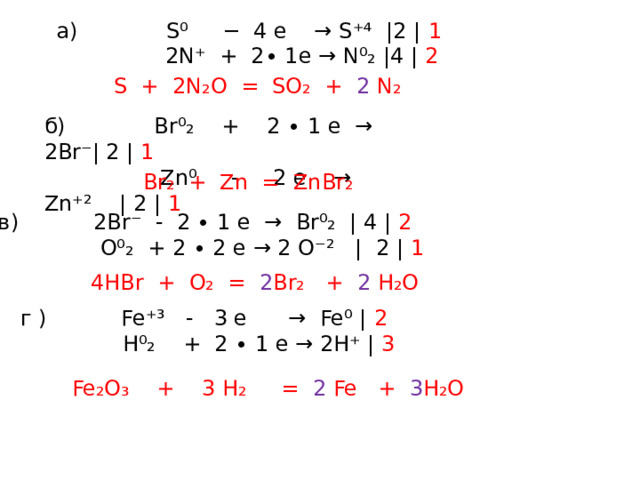
a) S⁰ − 4 e → S⁺⁴ |2 | 1
2N⁺ + 2∙ 1e → N⁰₂ |4 | 2
S + 2N₂O = SO₂ + 2 N₂
б) Br⁰₂ + 2 ∙ 1 e → 2Br⁻| 2 | 1
Zn⁰ - 2 e → Zn⁺² | 2 | 1
Br₂ + Zn = ZnBr₂
в) 2Br⁻ - 2 ∙ 1 e → Br⁰₂ | 4 | 2
O⁰₂ + 2 ∙ 2 e → 2 O⁻² | 2 | 1
4HBr + O₂ = 2 Br₂ + 2 H₂O
г ) Fe⁺³ - 3 e → Fe⁰ | 2
H⁰₂ + 2 ∙ 1 e → 2H⁺ | 3
Fe₂O₃ + 3 H₂ = 2 Fe + 3 H₂O

Коэффициент перед формулой восстановителя уравнении реакции, схема которой
Mg ⁰ + HN ⁺⁵ O 3 → N ⁺ 2 O + Mg ⁺² (NO 3 ) 2 + H 2 O,
равен 1) 3 2) 4 3) 5 4) 6
Коэффициенты в электронном балансе не сокращать.
ОТВЕТ: Mg ⁰ - восстановитель : 4
Mg⁰ − 2e → Mg⁺² | 4
N⁺⁵ + 4e → N⁺ | 2
4Mg + 10HNO₃ = N ₂ O + 4 Mg(NO₃)₂ + 5H₂O