

1854
Французский химик и промышленник Сент - Клер Девиль разработал первый промышленный способ получения алюминия – восстановлением расплава тетрахлоралюминиата натрием.
1827
Немецкий химик Фридрих Вёлер выделил алюминий в виде порошка восстановлением гексафторалюмината калием: Na 3 AlF 6 + 3K → Al + 3NaF + 3KF,
в 1845 г. получил металл в слитке.
1825
Датский ученый Ганс - Христиан Эрстед открыл алюминий. Пропустив хлор через раскаленную смесь глинозема с углем, получил хлористый алюминий, нагрев его с амальгамой калия выделил металл.
Периодическая система химических элементов Д.И.Менделеева
Периоды
Ряды
Группы элементов
V
VI
VII
IV
VIII
III
I
II
He
H
2
1
1
I
1.00797
4,003
Гелий
Водород
F
C
N
O
Li
В
Ne
Be
5
8
1 0
4
7
9
3
6
II
2
12,011
15 .996
20,18
10 .811
18.9984
14.0 067
6,9 39
9 ,012
фтор
Кислород
Углерод
Азот
Бор
Литий
Неон
Вериллий
S
Si
Na
Cl
Mg
P
Al
Ar
11
13
1 4
1 2
1 6
1 5
1 8
1 7
III
3
39,948
28,086
32,064
30,9738
35,453
22,9898
24,312
26,9815
Натрий
Алюминий
Кремний
Аргон
Магний
Фосфор
Хлор
Сера
Ti
Fe
Ni
V
Ca
S с
K
Cr
Mn
Co
22
20
21
27
25
24
19
28
2 3
26
4
IV
40,08
47.90
54.938
58.933
51.996
55.847
39.102
44.956
50.942
58.71
Железо
Хром
Ванадий
Никель
Скандий
Кобальт
Титан
Марганец
Кальций
Калий
Kr
Se
Br
Zn
Cu
As
Ga
Ge
30
34
31
29
35
36
33
32
5
74.9216
78.96
83,8
79.904
72.59
65 . 37
63.54 6
69.72
Мышьяк
Криптон
Медь
Селен
Галлий
Цинк
Бром
Германий
Y
Nb
Pd
Rh
Ru
Rb
T с
Sr
Zr
Mo
4 3
44
45
41
39
38
37
40
42
46
V
6
85.47
106.4
92.906
101.07
91.224
87.62
88.9059
102.905
99
95.94
Рутений
Цирконий
Технеций
Ниобий
Иттрий
Молибден
Палладий
Родий
Стронций
Рубидий
In
Sn
Te
Xe
I
Ag
Cd
Sb
53
47
49
51
54
50
48
52
7
126.904
127.60
131,3
114 .82
121.75
107.868
118.71
112.41
Иод
Олово
Кадмий
Сурьма
Теллур
Индий
Серебро
Ксенон
Cs
Pt
Os
Hf
W
Re
Ir
Ta
Ba
La
72
76
77
56
78
75
57
73
55
74
VI
8
138.81
178.49
192.2
190.2
186.2
195.09
180.9479
137.34
132.905
183.85
Иридий
Платина
Вольфрам
Гафний
Осмий
Цезий
Лантан
Рений
Барий
Тантал
Tl
Bi
Rn
Po
Au
At
Pb
Hg
79
83
81
82
85
84
80
8 6
9
210
[22 2 ]
196.966
208.98
208.982
200.59
207.2
204.383
Таллий
Ртуть
Золото
Астат
Свинец
Полоний
Радон
Висмут
Sg
Rf
Bh
Ac
Mt
Hs
Db
Fr
Ra
89
106
88
107
87
105
108
109
104
10
VII
[ 261 ]
[ 265 ]
[ 262 ]
[ 226 ]
[ 262 ]
227.028
[ 223 ]
[ 263 ]
[ 266 ]
Резерфордий
Актиний
Мейтнерий
Хассий
Борий
Сиборгий
Франций
Радий
Дубний

Поставьте пропущенные слова
- Алюминий - элемент III периода, III группы, главной подгруппы.
- Заряд ядра атома алюминия равен +13 .
- В ядре атома алюминия 13 протонов, 14 нейтронов.
- В атоме алюминия 13 электронов.
- Электронное строение алюминия .
- На внешнем уровне в атоме 3 электронов.
- Степень окисления атома алюминия равна +3 .
- Простое вещество алюминия является металлом .
- Формула оксида алюминия Al 2 O 3 , его характер амфотерный .
- Формула гидроксида алюминия Al(OH) 3 , его характер амфотерный .
2p 6
3s 2
3p 1
2s 2
1s 2
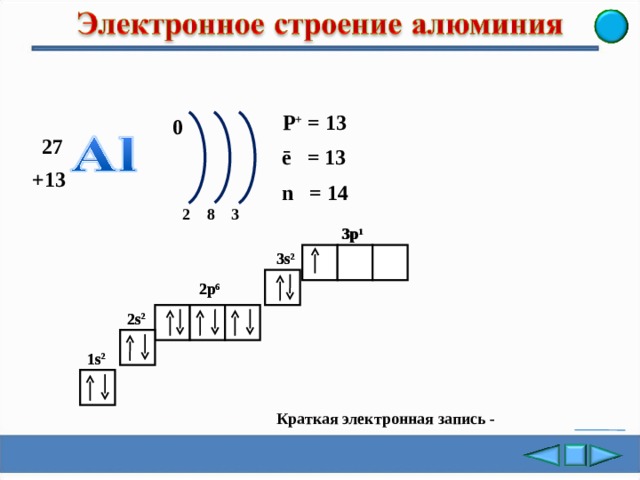
P + = 13
0
27
ē = 13
+13
n = 14
2
8
3
3p 1
3p 1
3s 2
3s 2
2 p 6
2p 6
2 s 2
2s 2
1s 2
1s 2
Краткая электронная запись -

! В природе алюминий встречается только в соединениях .
! По распространенности в литосфере алюминий занимает среди металлов I место - 8,8%, это третье место среди химических элементов после кислорода и кремния

Бокситы (от названия местности Ле-Бо, Lex Baux, на юге Франции, где впервые обнаружены их залежи) — алюминиевая руда, состоящая в основном из гидроокислов алюминия, окислов и гидроокислов железа и глинистых минералов. Цвет бокситов зависит от содержания железа обычно красный различных оттенков или серый.

Нефелин (элеолит) — породообразующий минерал, алюмосиликат калия и натрия ортокремниевой кислоты (Na,K)AlSiO 4 . Используют в производстве алюминия, соды, в стекольной, кожевенной промышленности. В больших количествах получается в качестве отхода при добыче апатита.

Каолинит - (название от китайского "Кау-Линг", что означает "высокая гряда") - глинистый минерал из группы водных силикатов алюминия. Химический состав: Al 4 [Si 4 O 10 ] (OH) 8 ; содержит 39,5% Al 2 O 3 , 46,5% SiO 2 и 14% H 2 O. Образует землистые массы, в которых при увеличениях под электронным микроскопом обнаруживаются мелкие шестигранные кристаллы.

Название берилла от древнегреческого « B erullos» означает «кристалл». Разновидности: золотисто- желтый (золотой берилл), розовый (морганит),
голубой (аквамарин),
красный (биксбит), бесцветный (гошенит), зеленый (изумруд).
Химический состав: ВеО - 14,1%, Аl 2 О 3 - 19%; SiО 2 - 66,9%; отмечаются примеси Na, K, Li, Cs, Rb, Fe, V , Cr.

Свое название рубин получил от латинского rubeus или красный. Древние русские названия камня - яхонт и карбункул. Окраска варьируется от глубокого розового цвета до густо красного с фиолетовым оттенком.
Минерал: диоксид алюминия. Относится к группе корундов, и занимает по твердости второе место, уступающее в этом отношении лишь алмазу.

Название гранат произошло от латинского Granatus, так назывались зернышки гранатового дерева.
Минерал густо-красного цвета, цвета "чистого пламени", и высокой твердости.
Химическое название граната - алюмосиликат магния-железа-марганца(Mg,Fe,Mn) 3 Al 2 (SiO 4 ) 3 .

Название cапфира происходит от греческого "sappheiros" - "синий камень". Несмотря на то, что в названии заложен только один из многочисленных оттенков, цветовая гамма сапфиров поражает своим разнообразием: пурпурно-голубой, зеленый, желтый, бесцветный, оранжевый и розово-оранжевый.
Минерал: голубая или синяя разновидность корунда.

Название «лазурит» произошло от персидского слова lazurite - синий. Темно-синий с вкраплениями золотистого пирита, создающего впечатление звезд на синем небе. Яркий и сверкающий на солнечном свету лазурит становится темным и мрачным при свечах и электрическом освещении. Лазурит - довольно мягкий и хрупкий минерал, легко обрабатывается и полируется.
Химическая формула: 6Nа(АlSiO 4 )Na 2 S.

Название от французского spinelle уменьшительной формы латинского слова spina (шип). Чистая шпинель бесцветна, но в природе такие камни встречаются очень редко. Различают оттенки синего и красного цвета шпинели, она бывает зеленоватой и коричневатой.
Шпинель является сложным окислом магния и алюминия MgAl 2 O 4 .

Название дано за сияющие голубые переливы.
Минерал образует прозрачные кристаллы с голубовато-белым, "лунным" мерцанием поверхности. Встречаются кристаллы и светло-желтого цвета.
Химическая формула: К(АlSi 3 О 8 )

Назван по острову Топазион (ныне Зебергед) в Красном море.
Цвет топаза разнообразный, чаще встречаются прозрачные бесцветные и бледно-голубые топазы, на мировом рынке больше всего ценятся фиолетовые.
Топаз - очень твердый (режет стекло). Химическая формула:
Al 2 (OH, F) 2 SiO 4

легкий
серебристо-белый металл
=2,699 г/см 3
Проводник электрического тока и тепла
Пластичный, ковкий и тягучий
Отражательная способность, устойчив к коррозии
t пл =660,1 °С,
t кип =2500 °С
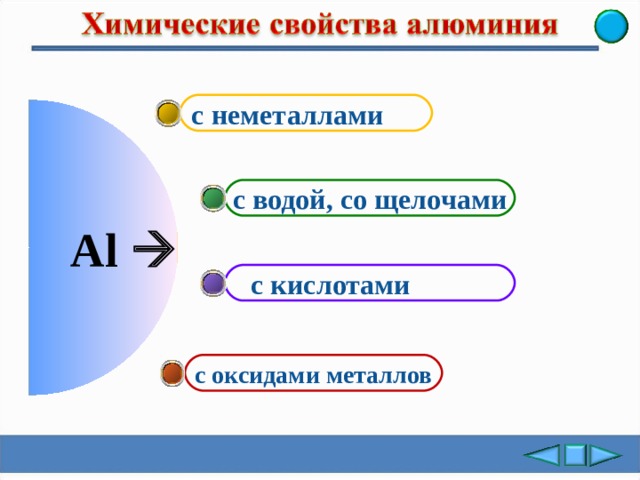
с неметаллами
с водой, со щелочами
Al
с кислотами
с оксидами металлов

Легко реагирует с простыми веществами:
С кислородом :
4Al + 3O 2 = 2Al 2 O 3
С галогенами :
2Al + 3 J 2 = 2Al J 3
С другими неметаллами
реагирует при нагревании:
2Al + 3S = Al 2 S 3
2Al + N 2 = 2AlN
4Al + 3С = Al 4 С 3
Реакция алюминия с иодом
![Алюминий реагирует с растворами щелочей . Сначала растворяется защитная оксидная пленка: Al 2 О 3 + 2 NaOH + 3H 2 O = 2Na[Al(OH) 4 ]. Затем протека е т реакция алюминия с водой : 2 Al + 6H 2 O = 2Al(OH) 3 + 3H 2 , NaOH + Al(OH) 3 = Na[Al(OH) 4 ], или суммарно: 2 Al + 6H 2 O + 2NaOH = Na[Al(OH) 4 ] + 3 Н 2](https://fsd.multiurok.ru/html/2020/11/08/s_5fa820ae63a80/img21.jpg)
Алюминий реагирует с растворами щелочей .
Сначала растворяется защитная оксидная пленка:
Al 2 О 3 + 2 NaOH + 3H 2 O = 2Na[Al(OH) 4 ].
Затем протека е т реакция алюминия с водой :
2 Al + 6H 2 O = 2Al(OH) 3 + 3H 2 ,
NaOH + Al(OH) 3 = Na[Al(OH) 4 ],
или суммарно:
2 Al + 6H 2 O + 2NaOH = Na[Al(OH) 4 ] + 3 Н 2

Легко растворяется в соляной и разбавленной серной кислотах :
2Al + 6HCl = 2AlCl 3 + 3H 2
2Al + 3H 2 SO 4 (разб) = Al 2 (SO 4 ) 3 + 3H 2
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
2Al + 6H 2 SO 4 ( конц ) = Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Al + 6HNO 3 ( конц ) = Al(NO 3 ) 3 + 3NO 2 + 3H 2 O

Восстанавливает металлы из их оксидов ( алюмотермия ):
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr
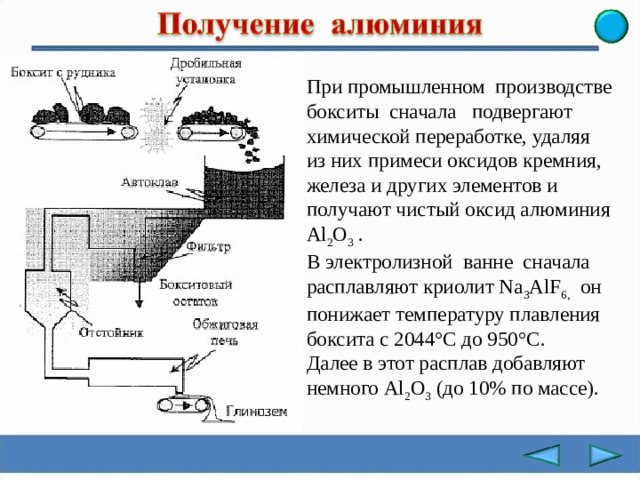
При промышленном производстве
бокситы сначала подвергают
химической переработке, удаляя
из них примеси оксидов кремния,
железа и других элементов и
получают чистый оксид алюминия
Al 2 O 3 .
В электролизной ванне сначала расплавляют криолит Na 3 AlF 6, он
понижает температуру плавления
боксита с 2044°C до 950°C.
Далее в этот расплав добавляют
немного Al 2 О 3 (до 10% по массе).
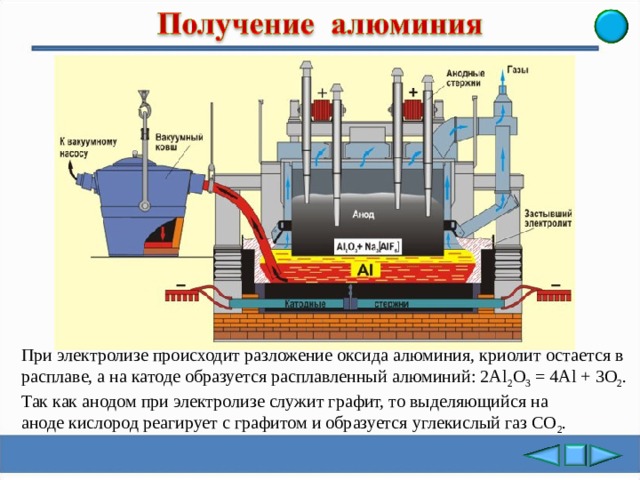
При электролизе происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий: 2Al 2 О 3 = 4Al + 3О 2 .
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО 2 .
Электротехника
Упаковка
Транспорт
Дизайн
Строительство
Фармацевтика
08.11.20
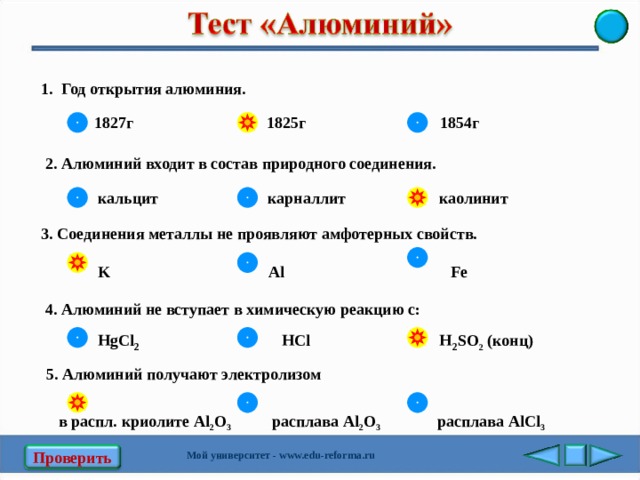
1. Год открытия алюминия .
1827г 1825г 1854г
2. Алюминий входит в состав природного соединения.
кальцит карналлит каолинит
3. Соединения металлы не проявляют амфотерных свойств.
K Al Fe
4. Алюминий не вступает в химическую реакцию с:
Н gCl 2 3 НС l H 2 SO 2 ( конц)
5. Алюминий получают электролизом
в распл. криолите Al 2 O 3 расплава Al 2 O 3 расплава AlCl 3
Мой университет - www.edu-reforma.ru
Проверить
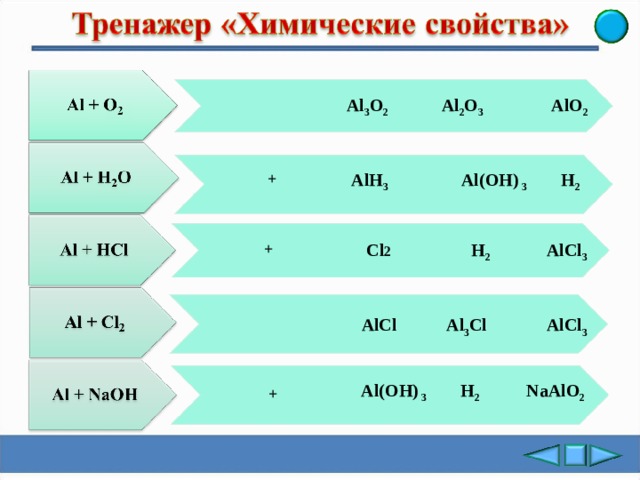
Al 2 O 3
AlO 2
Al 3 О 2
Al( ОН ) 3
+
AlH 3
H 2
AlCl 3
Cl 2
+
H 2
Al 3 Cl
AlCl
AlCl 3
H 2
Al(OH) 3
NaAlO 2
+

О.С.Габриелян «Химия-9», М, Дрофа, стр 3, 57-62; М.Фримантл «Химия в действии», 2 часть, М,, Мир, 1991 г, стр191-192 ;
Н.В.Манцевич «Неорганическая химия в таблицах», Минск, Современная школа, 2008г, стр . 364-372;
Видеофрагменты из CD «Химия для всех XXI. Химические опыты со взрывами и без» 1С –Образовательная коллекция;
http://ru.wikipedia.org/wiki/
http://www.catalogmineralov.ru/1.html
http://www.aluminiumleader.com/
http://webelements.narod.ru/elements/Al.htm
http://www.uchmarket.ru/n_2237_9.htm
http://archive.businesskomi.ru/rk/branches/4887/
http://www.mtodelta.ru/?id=histal1


























![Алюминий реагирует с растворами щелочей . Сначала растворяется защитная оксидная пленка: Al 2 О 3 + 2 NaOH + 3H 2 O = 2Na[Al(OH) 4 ]. Затем протека е т реакция алюминия с водой : 2 Al + 6H 2 O = 2Al(OH) 3 + 3H 2 , NaOH + Al(OH) 3 = Na[Al(OH) 4 ], или суммарно: 2 Al + 6H 2 O + 2NaOH = Na[Al(OH) 4 ] + 3 Н 2](https://fsd.multiurok.ru/html/2020/11/08/s_5fa820ae63a80/img21.jpg)


















