
Закон сохранения массы и энергии. Закон постоянства состава. Закон Авогадро.

Цель урока:
Знать формулировки законов, применять законы для решения задач.

Фронтальный опрос
1. Что такое период? Сколько периодов в периодической системе? Какие бывают периоды?
2. Что в периодической системе называют группой? Сколько групп имеется в периодической системе? На какие подгруппы делятся группы в периодической системе?
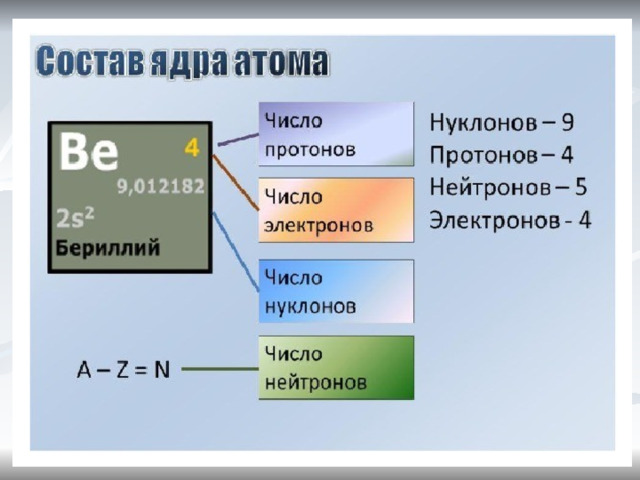
3. Как устроен атом? Как, пользуясь ПСХЭ, определить количество частиц в атоме?
4. Как определить количество электронов на внешнем электронном слое?
6. Что такое изотопы? Что называется химическим элементом?
![Расчет электронов с присутствующими ионами Ион - это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8] Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться. Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом. Например, у N 3 - заряд -3, а у Ca 2+ заряд +2. Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления .](https://fsd.multiurok.ru/html/2022/10/12/s_6346c35734fd2/img4.jpg)
Расчет электронов с присутствующими ионами
- Ион - это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8] Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.
- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N 3 - заряд -3, а у Ca 2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления .

Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10 ).


Задачи.
1. Определите состав ядер следующих изотопов: 79 Br, 109 Ag.
Решение:
79 Br число протонов р = 35, число нейтронов n =44
109 Ag число протонов р = 47, число нейтронов n=62
2. Рассчитайте число электронов, протонов и нейтронов в следующих частицах: 24 Mg 2+ , 31 P 3- , 15 N .
Решение:
24 Mg 2+ р=12; е = 10; n = 12
31 P 3- р=15; е = 1 8 ; n = 1 6
15 N р= 7 ; е = 7 ; n = 8


Закон сохранения массы веществ
«Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ».
«Все перемены в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупится к другому».
1748 год.


Закон постоянства состава веществ
Ж. Пруст, 1799 г.
«От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.


Вещества
дальтониды
бертоллиды
вещества постоянного состава (в честь английского химика и физика Джона Дальтона).
вещества переменного состава (в память о французском химике Клоде Луи Бертолле).

Расчёты на основе закона постоянства состава
?
Решение:
Задача №1.
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H 2 SO 4
- Используя ПСХЭ найдём относительные атомные массы химических элементов:
- Ar(H)=1, Ar(S)=32, Ar(O)=16.
- Определим массовые отношения этих элементов в формуле H 2 SO 4
- m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
- Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г - Н, 16 г - S и 32 г - О.

Расчёты на основе закона постоянства состава
Задача 2
Решение :
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
- Используя ПСХЭ найдём относительные атомные массы химических элементов:
- Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
- Обозначим количество атомов меди в формуле - х, серы - у, а кислорода - z: Cu x S y O z
- m(Cu) : m(S) : m(O) = х Ar(Cu) : у Ar(S) : zAr(O) = x64 : y32 : z16 = (1*64) : (1*32) : (4*16) = 64:32:64 = 2:1:2




Домашнее задание
§2 . Упражнение 3, с.9
1. Установите изотопный состав элемента по массовым числам изотопов: 79 Br и 81 Br .
2. Некоторый элемент состоит из двух изотопов. Число протонов в ядрах этих изотопов равно 29, а число нейтронов соответственно 34 и 35. Определите относительную атомную массу элемента, если известно, что массовая доля более легкого изотопа в земной коре составляет 73%.











![Расчет электронов с присутствующими ионами Ион - это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8] Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться. Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом. Например, у N 3 - заряд -3, а у Ca 2+ заряд +2. Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления .](https://fsd.multiurok.ru/html/2022/10/12/s_6346c35734fd2/img4.jpg)

































