
10 класс
Амфотерность алюминия и его соединений.
Бозаджи Н.М.,
учитель химии,
высшая категория

В результате изучения темы ,вы будете способны:
1.Обобщить знания об алюминии и его соединениях,
2.Опытным путем изучить амфотерность оксида и гидроксида алюминия,
3.Уметь составлять уравнения реакций с участием соединений алюминия в свете ТЭД,
4.Показать большое практическое значение алюминия и его соединений.
5.Осуществлять рефлексию учебной деятельности

Я металл серебристый и легкий
И зовусь самолетный металл.
И покрыт я оксидною пленкой
Чтоб меня кислород не достал!

«Люди гибнут за металл» В.Гете.
Задание 1.
1. Подумайте, почему алюминий так дорого ценился?
2. Какие соединения образует алюминий?
3. Назовите формулы этих соединений.

Алюминий и его свойства

Задание 2. Закончите уравнения реакций
1.Al + O 2
2.Al + H 2 O
3.Al + Сl 2
4.Al + HСl
5.Al +HgСl 2
6.Al + Fе 3 О 4
2Al + 3O 2 = 2Al 2 O 3
2Al + 6H 2 O= 2Al(OH) 3 + 3H 2
2Al + 3Сl 2 = 2AlСl 3
2Al + 6HСl= 2AlСl 3 + 3H 2
2Al + 3HgСl 2 = 2AlСl 3 + 3Hg
8Al + 3Fе 3 О 4 = 4Al 2 O 3 + 9Fе
![Проблема Как осуществить превращения: ? 1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ? 2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al ↓ ? Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img6.jpg)
Проблема
Как осуществить превращения: ?
1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ?
2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al
↓ ?
Na[Al(OH) 4 ]

Алюминий
и его соединения
проявляют
амфотерные свойства

Вещества - «хамелеоны»
При добавлении к таким веществам кислоты, они проявляют основные свойства, а при добавлении к ним щелочи – кислотные свойства .
Такая кислотно-основная двойственность химических свойств получила название
«Амфотерность»
способность соединений проявлять либо кислотные либо основные свойства, в зависимости от того с чем они реагируют.
![Алюминий проявляет амфотерные свойства Реагирует и с кислотами и с щелочами Проявляет сновные свойства 2Al + 6HCl 2AlCl 3 + 3H 2 Проявляет кислотные свойства 2Al 0 + 2NaOH + 6H 2 O 2Na[Al +3 (OH) 4 ] + 3H 2 тетрагидроксоалюминат натрия](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img9.jpg)
Алюминий проявляет амфотерные свойства
Реагирует и с кислотами и с щелочами
Проявляет сновные свойства
2Al + 6HCl 2AlCl 3 + 3H 2
Проявляет кислотные свойства
2Al 0 + 2NaOH + 6H 2 O 2Na[Al +3 (OH) 4 ] + 3H 2
тетрагидроксоалюминат натрия
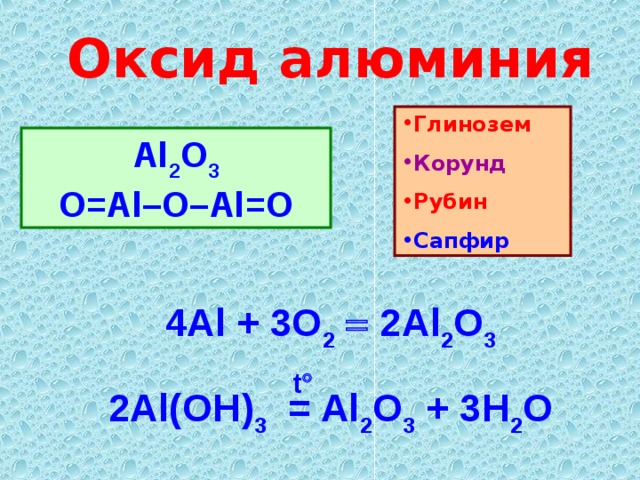
Оксид алюминия
Al 2 O 3
O=Al–O–Al=O
4Al + 3O 2 2Al 2 O 3
t
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
![Амфотерный оксид Как основной оксид: Al 2 O 3 + 6HCl 2AlCl 3 + 3H 2 O Как кислотный оксид: Al 2 O 3 + 2NaOH + 3H 2 O 2Na[Al(OH) 4 ] Al 2 O 3 + 2NaOH 2NaAlO 2 + H 2 O ](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img11.jpg)
Амфотерный оксид
Как основной оксид:
Al 2 O 3 + 6HCl 2AlCl 3 + 3H 2 O
Как кислотный оксид:
Al 2 O 3 + 2NaOH + 3H 2 O 2Na[Al(OH) 4 ]
Al 2 O 3 + 2NaOH 2NaAlO 2 + H 2 O


Гидроксид алюминия
Al(OH) 3
AlCl 3 + 3NaOH Al(OH) 3 + 3NaCl

Al(OH) 3 - амфотерный гидроксид
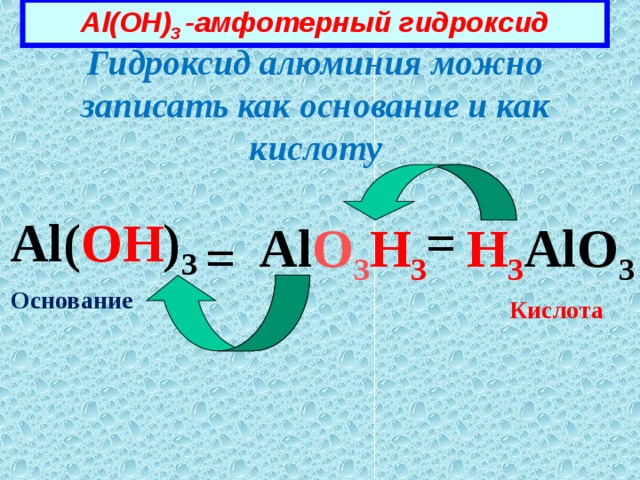
Al(OH) 3 - амфотерный гидроксид
Гидроксид алюминия можно записать как основание и как кислоту
Al( OH ) 3
=
H 3 AlO 3
Al O 3 H 3
=
Основание
Кислота
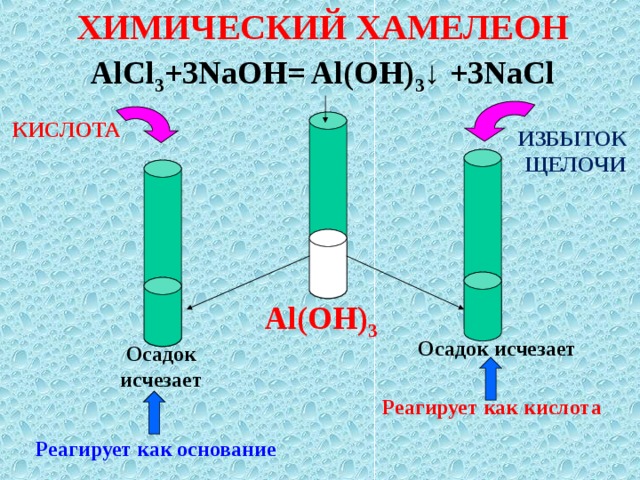
ХИМИЧЕСКИЙ ХАМЕЛЕОН
AlCl 3 +3NaOH= Al(OH) 3 ↓ +3NaCl
КИСЛОТА
ИЗБЫТОК
ЩЕЛОЧИ
Al(OH) 3
Осадок исчезает
Осадок исчезает
Реагирует как кислота
Реагирует как основание
![Амфотерный гидроксид Как основание : Al(OH) 3 + 3HCl AlCl 3 + 3H 2 O Как кислота Al(OH) 3 + NaOH Na[Al(OH) 4 ] тетрогидроксоалюминат натрия H 3 AlO 3 + 3NaOH = Na 3 AlO 3 +3H 2 O алюминат натрия](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img17.jpg)
Амфотерный гидроксид
Как основание :
Al(OH) 3 + 3HCl AlCl 3 + 3H 2 O
Как кислота
Al(OH) 3 + NaOH Na[Al(OH) 4 ]
тетрогидроксоалюминат
натрия
H 3 AlO 3 + 3NaOH = Na 3 AlO 3 +3H 2 O
алюминат натрия
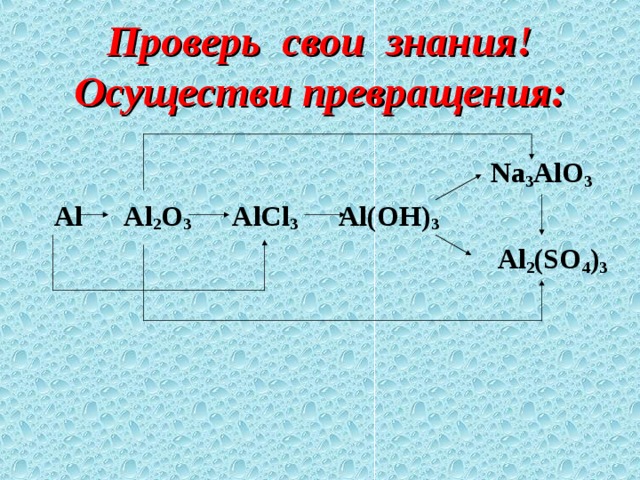
Проверь свои знания! Осуществи превращения:
Na 3 AlO 3
Al Al 2 O 3 AlCl 3 Al(OH) 3
Al 2 (SO 4 ) 3
![Проблема Как осуществить превращения: ? 1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ? 2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al ↓ ? Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img19.jpg)
Проблема
Как осуществить превращения: ?
1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ?
2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al
↓ ?
Na[Al(OH) 4 ]

Применение

Биологическое значение алюминия
Болезнь Альцгеймера?
Акселерация?

Рефлексия
1.На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок я… 5.Мое настроение… 6.Материал урока мне был…
активно, доволен, коротким, не устал, полезен, стало лучше, понятен, интересен, легким.

- Выучить конспект.
- Решить ЦП
- стр.232 упр.1-в
- решить ЦП классной работы











![Проблема Как осуществить превращения: ? 1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ? 2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al ↓ ? Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img6.jpg)


![Алюминий проявляет амфотерные свойства Реагирует и с кислотами и с щелочами Проявляет сновные свойства 2Al + 6HCl 2AlCl 3 + 3H 2 Проявляет кислотные свойства 2Al 0 + 2NaOH + 6H 2 O 2Na[Al +3 (OH) 4 ] + 3H 2 тетрагидроксоалюминат натрия](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img9.jpg)

![Амфотерный оксид Как основной оксид: Al 2 O 3 + 6HCl 2AlCl 3 + 3H 2 O Как кислотный оксид: Al 2 O 3 + 2NaOH + 3H 2 O 2Na[Al(OH) 4 ] Al 2 O 3 + 2NaOH 2NaAlO 2 + H 2 O ](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img11.jpg)





![Амфотерный гидроксид Как основание : Al(OH) 3 + 3HCl AlCl 3 + 3H 2 O Как кислота Al(OH) 3 + NaOH Na[Al(OH) 4 ] тетрогидроксоалюминат натрия H 3 AlO 3 + 3NaOH = Na 3 AlO 3 +3H 2 O алюминат натрия](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img17.jpg)

![Проблема Как осуществить превращения: ? 1) Al → Al(OH) 3 → AlCl 3 → Al(OH) 3 → Na[Al(OH) 4 ] ? 2) Al → Al 2 O 3 → Na[Al(OH) 4 ] → Al(OH) 3 → Al 2 O 3 → Al ↓ ? Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedff781a9e5/img19.jpg)






















