
Коррозия металлов и способы защиты от нее

Базовый уровень сложности
1. При электролизе AgNO 3 на катоде выделяется (-ются):
1) серебро
2) водород
3) серебро и водород
4) водород и кислород
- При электролизе водного раствора нитрата калия на аноде выделяется
1) О 2 2) NO 2 3) N 2 4) H 2
- При электролизе водного раствора какой соли на катоде и аноде будут выделятся газообразные вещества
- AgNO 3 2) КNO 3 3) CuCl 2 4) SnCl 2
- AgNO 3 2) КNO 3 3) CuCl 2 4) SnCl 2

Повышенный уровень сложности
4. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) Al 2 (SO 4 ) 3
- гидроксид металла, кислота
- металл, галоген
- металл, кислород
- водород, галоген
- водород, кислород
- металл, кислота, кислород
Б) CsOH
В ) Hg( N O 3 ) 2 Г) AuBr 3

Повышенный уровень сложности
5. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе его водного раствора
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) Na 3 PO 4
- O 2
- H 2 S
- Br 2
- HBr
- NO 2
- SO 2
Б) NaNO 3 В ) A l 2 ( S O 4 ) 3 Г) AlBr 3

Коррозия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического взаимодействия с окружающей средой.

Виды коррозии:
Химическая коррозия металлов — это разрушение металла при контакте с газами и ж и д к о с т ям и - не э лек т р о ли т ам и без возникновения электрического тока в системе.
Примеры: Двигатели, арматура, газовые турбины

Основной окислитель – кислород воздуха. Процессы химической коррозии железа: 2Fe + O 2 = 2FeO
4Fe + 3O 2 = 2Fe 2 O 3
3Fe + 3O 2 = FeO·Fe 2 O 3 смешанный оксид железа (II, III) 4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3 (на воздухе в присутствии влаги) 3Fe + 4H 2 O (пар) = Fe 3 O 4 + 4H 2
2Fe + 3Cl 2 = 2FeCl 3

Например, образование окалины при
взаимодействии материалов на основе железа при высокой температуре с кислородом:
4Fe + 3O → 2Fe O
2 2 3
.

Виды коррозии:
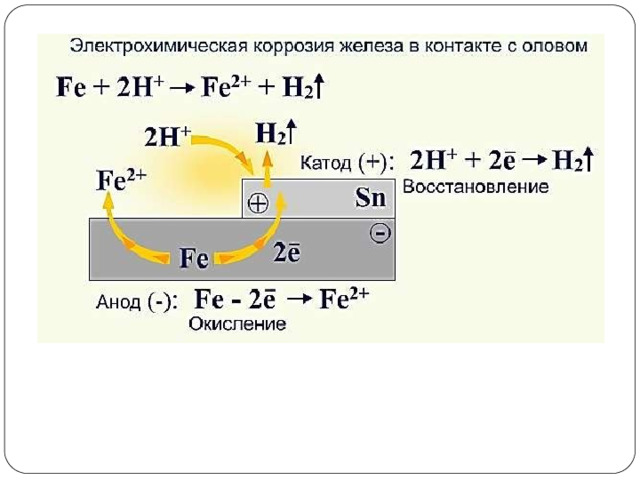
Электрохимическая коррозия
- Токопроводящая среда
- Контакт 2-х металлов.
Электрохимическая коррозия
— э т о
разрушение металла в среде электролита с возникновением внутри системы электрического тока.

Способы защиты от коррозии
1. Защитные покрытия:
- металлические покрытия – анодное (покрытие более активным металлом Zn, Cr) –
оцинкованное железо; катодное (покрытие
менее активным металлом Ni, Sn, Ag, Au) – белая жесть (лужёное железо) – не защищает от
разрушения в случае нарушения покрытия.
- неметаллические покрытия – лаки, краски, эмали.

2. Протекторная защита – присоединение пластины из более активного металла (Al, Zn, Mg) – защита морских судов.

3. Легирование металлов – введение в сплав компонентов, которые пассивируют металл (Ti, Cr, Ni, Mn).

Ответьте на вопросы:
Вопрос №1. Известны случаи разрушения и затопления кораблей, железная обшивка которых была скреплена медными заклепками. В чем причина этого явления?
В 20 годы ХХ в. по заказу одного миллионера была построена роскошная яхта “Зов моря”. Днище яхты было обшито медно- никелевым сплавом, а рама руля, киль и другие детали изготовлены из стали. Когда яхта была спущена на воду, она затонула, ни сделав ни одного рейса.

Ответьте на вопросы:
Вопрос №2. Более полутора тысяч лет назад в Индии была изготовлена железная колонна весом в 6,5 т, высотой 7,3 м, диаметром у основания 41,6 см, у верха 29,5 см, стоящая ныне на одной из площадей индийской столицы. Она стоит на тропическом солнце, под дождями 15 столетий, но не подверглась ни малейшей коррозии. Почему на нее не действует коррозия?

Ответ: Колонна содержит малое
количество примеси
углерода и, по одной из версий, сделана из
метеоритного железа (99,72 %).

Ответьте на вопросы:
Во п ро с № 3 . К оло с с Родосский. В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса.
Колосс Родосский считался одним из семи чудес света, однако просуществовал всего 66 лет и рухнул во время землетрясения. У Колосса Родосского бронзовая оболочка была смонтирована на железном каркасе. Почему это чудо света так быстро разрушилось?

Домашнее задание:
§34

Рассмотрите рисунок, ответьте на вопросы:
Обратите внимание!
В вос с та н овл е н и и к и с л о р о д а у ч а ству ю т
ионы Н + . Если концентрация Н + понижается (при повышении рН), восстановление О 2 затрудняется. Замечено, что железо, находящееся в контакте с раствором, рН которого выше 9–10, не корродирует.
С усилением коррозии в присутствии солей часто сталкиваются автомобилисты в тех местностях, где в зимнее время для борьбы с гололедицей дороги обильно посыпают солью. Влияние солей объясняется тем, что образуемые ионы создают электролит, но сходным для возникновения замкнутой электрической цепи.

- Определить тип коррозии в каждом стакане.
- * В каких стаканах железный гвоздь
прокорродировал сильнее, в каких меньше, а в каких коррозии не подвергся? Почему?
- * Объясните, что усиливает коррозию, а что ее замедляет?











































