Просмотр содержимого документа
«Презентация по химии: Окислительно-восстановительные реакции»

окислительно – восстановительные реакции (ОВР)

Окислительно-восстановительные реакции (ОВР) – это реакции,
в процессе которых меняется степень окисления двух элементов, один из которых является окислителем, а другой – восстановителем
Восстановитель – это тот элемент, который
в процессе реакции отдает электроны
и сам при этом окисляется
Окислитель – это тот элемент, который
в процессе реакции принимает электроны
и сам при этом восстанавливается


1. Запишем уравнение реакции
2. Расставим степени окисления всех элементов
3. Выделим элементы, которые поменяли степени окисления
Видим, что в результате реакции поменяли степени окисления два элемента –
- сера ( S) поменяла полностью (от – 2 до 0 )
- a зот ( N ) поменял частично (от +5 до +2 поменял), часть осталась +5
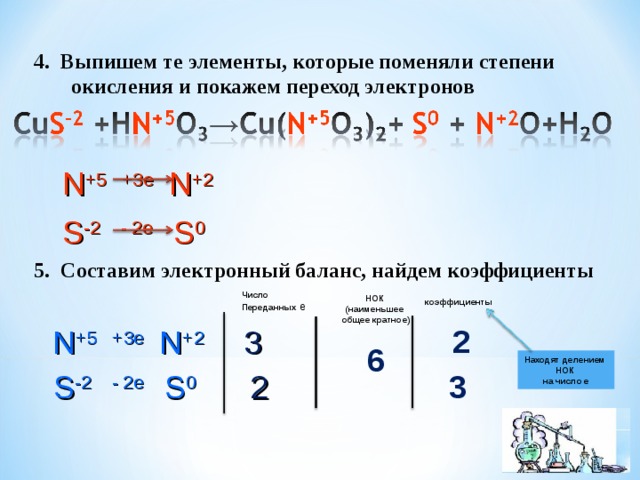
4. Выпишем те элементы, которые поменяли степени
окисления и покажем переход электронов
N +5 +3 e N +2
S -2 - 2e S 0
5 . Составим электронный баланс, найдем коэффициенты
Число
Переданных е
НОК
(наименьшее
общее кратное)
коэффициенты
2
N +5 +3 e N +2 3
6
Находят делением
НОК
на число е
S -2 - 2e S 0 2
3
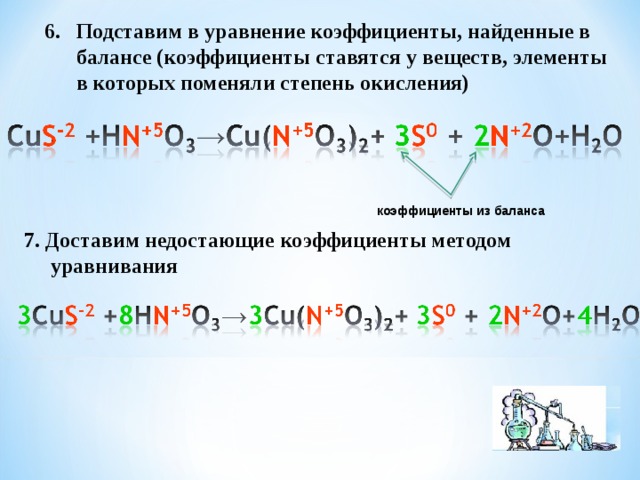
- Подставим в уравнение коэффициенты, найденные в балансе (коэффициенты ставятся у веществ, элементы в которых поменяли степень окисления)
коэффициенты из баланса
7. Доставим недостающие коэффициенты методом
уравнивания
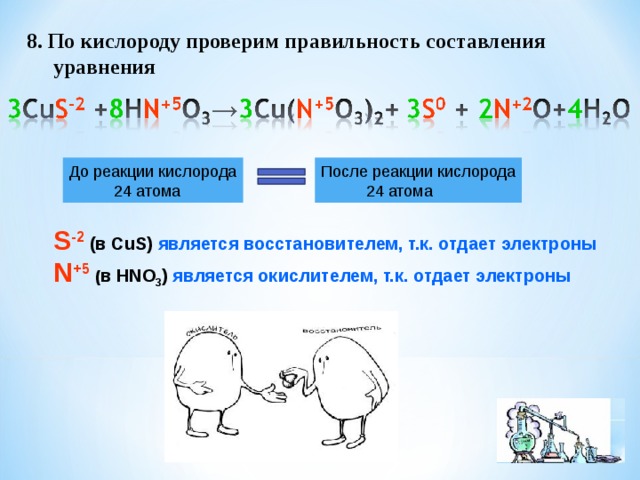
8. По кислороду проверим правильность составления
уравнения
До реакции кислорода
24 атома
После реакции кислорода
24 атома
S -2 (в CuS) является восстановителем, т.к. отдает электроны
N +5 ( в HNO 3 ) является окислителем, т.к. отдает электроны
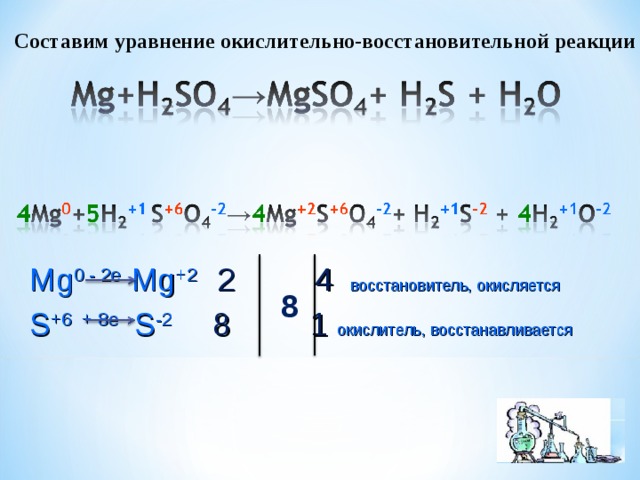
Составим уравнение окислительно-восстановительной реакции
Mg 0 - 2e Mg +2 2 4 восстановитель, окисляется
8
S +6 + 8e S -2 8 1 окислитель, восстанавливается

Тест
Вопрос № 1
Какое уравнение соответствует окислительно-восстановительной реакции?
- CaCO 3 = CaO + CO 2
- BaCl 2 + Na 2 SO 4 = BaSO 4 + 2NaCl
- Zn + H 2 SO 4 = ZnSO 4 + H 2
- Na 2 CO 3 + CO 2 + H 2 O = 2NaHCO 3
Вопрос № 2
В уравнении реакции 2Al + 3Br 2 =2AlBr 3 коэффициент перед формулой восстановителя равен
Вопрос № 3
В уравнении реакции 5С a + 12 HNO 3 = 5 Ca(NO 3 ) 2 + N 2 + 6 H 2 O окислителем является
- Ca 2. Ca(NO 3 ) 2 3. HNO 3 4. H 2 O
Вопрос № 4
Какая из предложенных схем будет соответствовать восстановителю
1. S 0 → S -2 2. S +4 → S +6 3. S -2 → S -2 4. S +6 → S +4

Вопрос № 5
В уравнении реакции 2 SO 2 + O 2 → 2 SO 3 сера
- окисляется
- восстанавливается
- ни окисляется, ни восстанавливается
- и окисляется, и восстанавливается
Вопрос № 6
Какой элемент является восстановителем в уравнении реакции
2KClO 3 → 2 KCl + 3 O 2
- калий 2. хлор 3. кислород 4. водород
Вопрос № 7
Схема Br -1 → Br +5 соответствует элементу
1. окислителю 2. восстановителю 3. и окислителю, и восстановителю
Вопрос № 8
Соляная кислота является восстановителем в реакции
- PbO 2 + 4HCl = PbCl 2 + Cl 2 + 2H 2 O
- Zn + 2HCl = ZnCl 2 + H 2
- PbО + 2HCl = PbCl 2 + H 2 О
- Na 2 CO 3 + 2HCl = 2NaCl+ CO 2 + H 2 O




































