
ТЕРМОДИНАМИКА Подготовка к ЕГЭ
Учитель: Горшкова Л.А. МБОУ СОШ № 44
г. Сургут

Цель: повторение основных понятий, законов и формул ТЕРМОДИНАМИКИ в соответствии с кодификатором ЕГЭ

Элементы содержания, проверяемые на ЕГЭ 2018:
- 1 . Тепловое равновесие и температура.
- 2. Внутренняя энергия.
- 3. Теплопередача как способ изменения внутренней энергии без совершения работы. Конвекция, теплопроводность, излучение.
- 4. Количество теплоты. Удельная теплоемкость вещества.
- 5.Удельная теплота парообразования r: Q = rm .
- 6.Удельная теплота плавления λ: Q = λ m .
- 7.Удельная теплота сгорания топлива q : Q = qm
- 8. Работа в термодинамике. Вычисление работы по графику процесса на pV -диаграмм.
- 9. Уравнение теплового баланса.
- 10. Первый закон термодинамики.
- Применение первого закона термодинамики к изопроцессам.
- 11. Второй закон термодинамики, необратимость.
- 12. Принцип действия тепловых машин.
- КПД тепловой машины.

Термодинамика. Основные понятия
- 1. Тепловое равновесие и температура.
- Тепловое равновесие с течением времени устанавливается между любыми телами, имеющими различную температуру.
- Все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
- 2. Внутренняя энергия.
- Внутренняя энергия идеального газа равна кинетической энергии теплового движения его атомов или молекул. Существует формула для внутренней энергии одного моля идеального газа, молекулы которого совершают только поступательное движение:

Термодинамика. Основные понятия
3. Теплопередача как способ изменения внутренней энергии без совершения работы. Конвекция, теплопроводность, излучение.
- Теплопроводность-явление передачи энергии от более нагретых участков тела к менее нагретым в результате теплового движения и взаимодействия частиц, из которых состоит тело.
- Происходит в твердых телах, жидкостях и газах.
- Конвекция-процесс переноса энергии потоками жидкости или газа.
- Происходит в жидкостях и газах.
- Излучение ( лучистый теплообмен)- процесс переноса энергии от одного тела к другому с помощью электромагнитных волн.
 t 1 и, следовательно, Q 0 (тело получает тепло). При охлаждении тела t 2и t 1 и, следовательно, Q " width="640"
t 1 и, следовательно, Q 0 (тело получает тепло). При охлаждении тела t 2и t 1 и, следовательно, Q " width="640"
Термодинамика. Основные понятия
- 4. Количество теплоты. Удельная теплоемкость вещества.
- Количество теплоты – это энергия, которую тело теряет или приобретает при теплопередаче.
- При остывании тело будет терять (отдавать) некое количество теплоты, а при нагревании поглощать.
- Удельная теплоемкость вещества - это величина показывает, какое количество теплоты надо передать телу массой один килограмм, чтобы его температура увеличилась на один градус Цельсия. Измеряется в Дж/(кг * ˚С).
- Расчет количества теплоты:
- Q=cm(t 2 - t 1 ) ,
- где Q – количество теплоты,
- m – масса тела,
- (t 2 - t 1 ) – разность между начальной и конечной температурами тела,
- t 1 — начальная температура, t 2 — конечная температура.
- При нагревании тела t 2 t 1 и, следовательно, Q 0 (тело получает тепло).
- При охлаждении тела t 2и t 1 и, следовательно, Q

Термодинамика. Основные понятия
- 5.Удельная теплота парообразования r: Q = rm .
- Парообразование это переход жидкости в газообразное состояние (в пар).
- Существует два способа парообразования: испарение и кипение.
- Конденсация — переход вещества из газообразного состояния (пара) в жидкое.
-
- Удельная теплота парообразования – это физическая величина, которая показывает количество теплоты, нужное, чтобы превратить жидкость массой 1 кг в пар при температуре кипения. Обозначается удельная теплота парообразования буквой L.
- Единица измерения- Дж/кг.
- Если известно, что вещество находится при температуре кипения, то для вычисления количества теплоты, необходимого для превращения его в газообразное состояние используют следующую формулу:
- Обозначения:
- количество теплоты парообразования, Дж;
- удельная теплота парообразования и конденсации, ;
- масса вещества, кг.
Термодинамика. Основные понятия
- 6.Удельная теплота плавления λ: Q = λ m .
- Переход вещества из твердого кристаллического состояния в жидкое называется плавлением . Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
- Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится (т.е. происходит выделение энергии в окружающую среду). Переход вещества из жидкого состояния в твердое называется отвердеванием , или кристаллизацией . Температура, при которой вещество кристаллизуется, называется температурой кристаллизации .
- Удельная теплота плавления — физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1кг, чтобы при температуре плавления полностью перевести его в жидкое состояние.
- Для вычисления количества теплоты, необходимого для плавления вещества, используется формула: Q = λ m
- , где:
- Q – количество теплоты (Дж);
- λ – удельная теплота плавления;
- m – масса вещества.

Термодинамика. Основные понятия
- 7.Удельная теплота сгорания топлива q : Q = qm
- уголь, нефть, спирт, газ и т.д.
- Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива.
- Удельная теплота сгорания обозначается буквой q.
- Единицей удельной теплоты сгорания является 1 Дж / кг.
- Расчетная формула для количества теплоты, выделившейся при полном сгорании топлива:
- Q = qm ;
- где Q - количество выделившейся теплоты ( Дж ),
- q - удельная теплота сгорания ( Дж/кг ),
- m - масса сгоревшего топлива ( кг ).
Термодинамика. Основные понятия
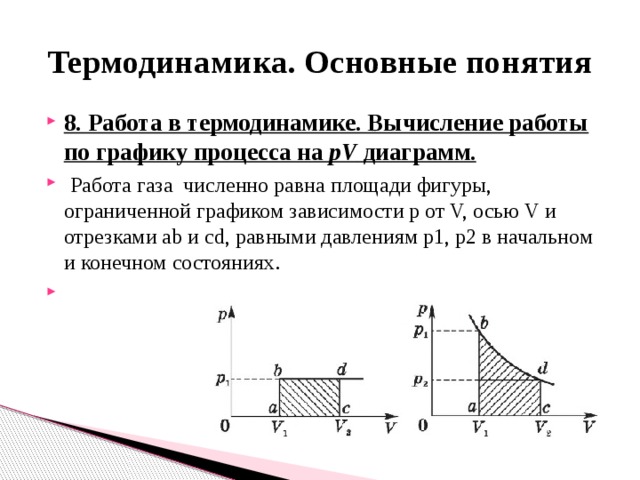
- 8. Работа в термодинамике. Вычисление работы по графику процесса на pV диаграмм.
- Работа газа численно равна площади фигуры, ограниченной графиком зависимости p от V, осью V и отрезками ab и cd, равными давлениям p1, p2 в начальном и конечном состояниях .
-

Термодинамика. Основные понятия
- 9. Уравнение теплового баланса.
- Если в изолированной системе тел не происходит ни каких превращений энергии кроме теплообмена, то количество теплоты, отданное телами, внутренняя энергия которых уменьшается, равно количеству теплоты, полученному телами, внутренняя энергия которых, увеличивается.

Термодинамика. Основные понятия
- 10. Первый закон термодинамики.
- Применение первого закона термодинамики к изопроцессам.
- Первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A газом. Формула первого закона термодинамики записывается так:
Изохорный процесс.
- Изобарный процесс.
- Адиабатный процесс . Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:

Термодинамика. Основные понятия
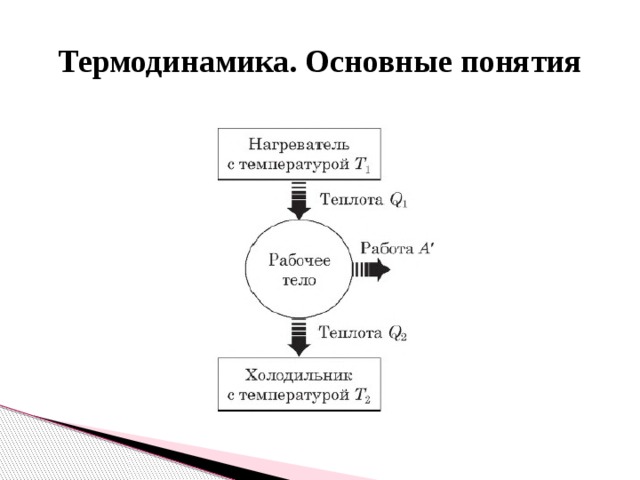
- 11. Второй закон термодинамики, необратимость.
- Немецкий ученый Р. Клаузиус формулировал закон так: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах. Это означает, что теплота не может самопроизвольно переходить от более холодного тела к более горячему ( принцип Клаузиуса ).
Термодинамика. Основные понятия

Термодинамика. Основные понятия
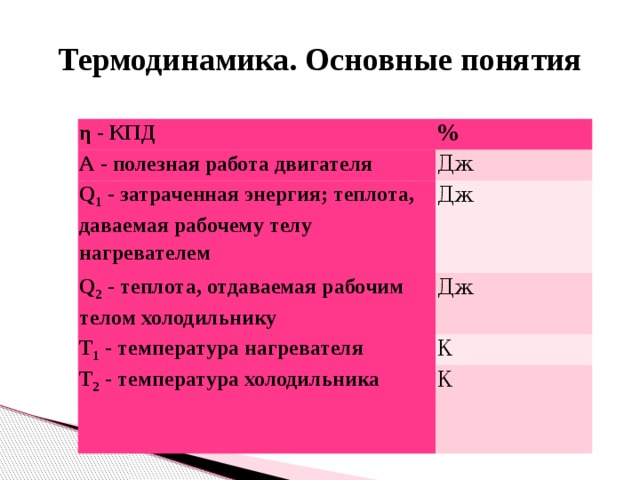
- Коэффициент полезного действия: Другие формулы КПД: КПД реального теплового двигателя. КПД идеального теплового двигателя (максимально возможный):
Термодинамика. Основные понятия
η - КПД
%
А - полезная работа двигателя
Дж
Q 1 - затраченная энергия; теплота, даваемая рабочему телу нагревателем
Дж
Q 2 - теплота, отдаваемая рабочим телом холодильнику
Дж
Т 1 - температура нагревателя
К
Т 2 - температура холодильника
К

Первое начало термодинамики
- Идеальный газ получил количество теплоты 300 Дж и при этом внутренняя энергия газа увеличилась на 100 Дж. Какова работа, совершенная газом?
- Согласно первому началу термодинамики тепло, переданное системе, идёт на изменение внутренней энергии и совершение работы против внешних сил:
- Отсюда находим работу, совершённую газом :
(Ответ дать в джоулях.)
Ответ: 200.

Первое начало термодинамики
- Идеальный газ отдал количество теплоты 300 Дж и при этом внутренняя энергия газа увеличилась на 100 Дж. Какова работа, совершенная газом?
- Согласно первому началу термодинамики, тепло, переданное системе, идет на изменение внутренней энергии и совершение работы против внешних сил:
- Отсюда находим работу, совершенную газом:
(Ответ дать в джоулях.)
Ответ: −400.
Первое начало термодинамики
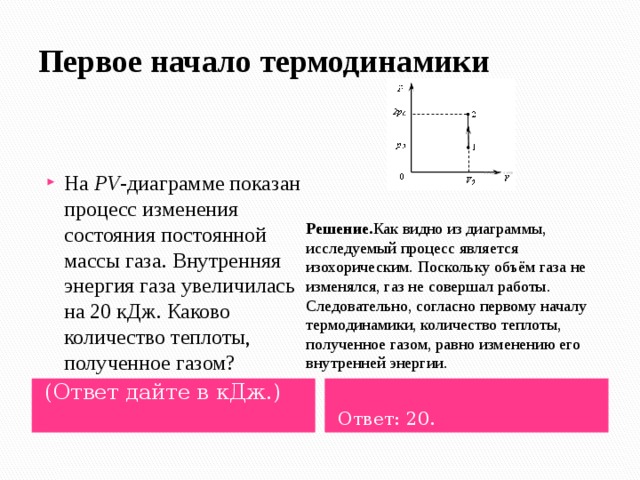
- На PV -диаграмме показан процесс изменения состояния постоянной массы газа. Внутренняя энергия газа увеличилась на 20 кДж. Каково количество теплоты, полученное газом?
Решение. Как видно из диаграммы, исследуемый процесс является изохорическим. Поскольку объём газа не изменялся, газ не совершал работы. Следовательно, согласно первому началу термодинамики, количество теплоты, полученное газом, равно изменению его внутренней энергии.
(Ответ дайте в кДж.)
Ответ: 20.

Первое начало термодинамики
- Один моль идеального одноатомного газа, находящегося при температуре +27 °С, изобарически нагревают. При этом абсолютная температура этого газа увеличивается в 3 раза. Определите, чему равно количество теплоты, сообщённое этому газу. Ответ выразите в Дж.
Согласно первому началу термодинамики В изобарном процессе газ совершает работу и внутренняя энергия его изменяется следующим образом:
Ответ выразите в Дж.
Ответ: 12465.

Работа идеального газа
- Какую работу совершает газ при переходе из состояния 1 в состояние 3? (Ответ дайте в кДж.)
На диаграмме p—V работе, совершаемой газом при переходе из начального состояния в конечное, соответствует площадь под линией, изображающей процесс перехода.
Для процесса 1—2—3 эта площадь показана на рисунке штриховкой. Таким образом, при переходе из состояния 1 в состояние 3 газ совершает работу

Первое начало термодинамики
- На рисунке показано, как менялось давление идеального газа в зависимости от его объема при переходе из состояния 1 в состояние 2, а затем в состояние 3. Каково отношение работ газа на этих двух отрезках P—V диаграммы?
- Решение.
Работе, совершаемой газом при переходе из начального состояния в конечное, на диаграмме P—V соответствует площадь под линией, изображающей процесс перехода. Таким образом, отношение работ газа на участках 1—2 и 2—3 равняется отношению площадей под соответствующими линиями на диаграмме. Посчитав площади по клеточкам, получаем, что

Работа идеального газа
- С двумя молями одноатомного идеального газа совершают циклический процесс 1–2–3–1 (см. рисунок). Чему равна работа, совершаемая газом на участке 1–2 в этом циклическом процессе?
- Решение.
- Процесс 1–2 — это процесс изобарного нагревания. Учитывая закон Менделеева-Клапейрона, работа газа в этом процессе равна
- Ответ: 4986.

КПД тепловых машин, циклы
- Тепловая машина с КПД за цикл работы отдает холодильнику 100 Дж. Какое количество теплоты за цикл машина получает от нагревателя? (Ответ дайте в джоулях.)
- Решение.
- КПД тепловой машины связано с количеством теплоты, полученным за цикл от нагревателя, и количеством теплоты, отданным холодильнику, соотношением
- Отсюда находим количество теплоты, которое за цикл получает машина от нагревателя:

КПД тепловых машин, циклы
- Температура нагревателя тепловой машины 1 000 К, температура холодильника на 200 К меньше, чем у нагревателя. Каков максимально возможный КПД машины? (Ответ дайте в процентах.)
- Решение.
Температура холодильника равна
Максимально возможный КПД тепловой машины равен КПД машины Карно

Объяснение явлений
- В результате эксперимента по изучению циклического процесса, проводившегося с некоторым постоянным количеством одноатомного газа, который в условиях опыта можно было считать идеальным, получилась зависимость давления p от температуры T , показанная на графике. Выберите два утверждения, соответствующие результатам этого эксперимента, и запишите в таблицу цифры, под которыми указаны эти утверждения.
- 1) В процессе 2–3 газ не совершал работу.
- 2) В процессе 1–2 газ совершал положительную работу.
- 3) В процессе 2–3 газ совершал положительную работу.
- 4) В процессе 3–1 газ совершал положительную работу.
- 5) Изменение внутренней энергии газа на участке 1–2 было равно модулю изменения внутренней энергии газа на участке 3–1.

Решение.
Проанализируем каждое утверждение.
1) Процесс 2−3 — изотермическое уменьшение давления, следовательно, по закону Бойля — Мариотта: значит, газ расширялся, то есть совершал положительную работу.
2) Заметим, что график построен в переменных p−T, процесс 1−2 — линейный, следовательно, процесс 1−2 — изохора, значит, работа не совершается.
3) Процесс 2−3 — изотермическое уменьшение давления, следовательно, газ расширялся, то есть совершал положительную работу.
4) Процесс 3−1 — это изобарическое уменьшение температуры, следовательно, по закону Гей-Люссака то есть объём также уменьшался. Следовательно, над газом совершают работу, то есть газ совершает отрицательную работу.
5) Изменение внутренней энергии идеального газа прямо пропорционально изменению температуры, Изменение температуры в процессах 1−2 и 3−1 одинаково по модулю, следовательно, модуль изменения внутренней энергии на участке 1−2 равно модулю изменения внутренней энергии на участке 3−1.
Ответ: 35.

Объяснение явлений
- На рисунке в координатах p − V показан циклический процесс 1−2−3−4−1, который совершает один моль идеального одноатомного газа. Из предложенного перечня выберите два верных утверждения и укажите их номера.
- 1) В процессе 1−2 внутренняя энергия газа не изменяется.
- 2) В процесс 2−3 газ совершает положительную работу.
- 3) В процессе 3−4 над газом совершают работу.
- 4) В процессе 4−1 температура газа уменьшается в 4 раза.
- 5) Работа, совершённая газом в процессе 1−2, в 4 раза больше работы, совершённой над газом в процессе 3−4.

Решение.
1) Процесс 1−2 — изобарическое увеличение объёма. Внутренняя энергия идеального одноатомного газа вычисляется по формуле: Произведение в данном процессе увеличивается, значит, внутренняя энергия газа растёт.
2) Процесс 2−3 — изохорное уменьшение давления, в изохорном процессе работа не совершается.
3) Процесс 3−4 — изобарическое уменьшение объёма. Из графика видно, что газ переходит в состояние с меньшей температурой, следовательно, уменьшается внутренняя энергия газа. Также заметим, что над газом совершают работу, значит, от газа отнимают некоторое количество теплоты.
4) Из графика видно, что Найдём отношение внутренней энергии газа в состоянии 4 к внутренней энергии газа в состоянии 1:
То есть, в процессе 4−1 температура газа увеличивается в 4 раза.
5) Работу можно найти как площадь под кривой процесса на графике pV. Площадь под процессом 1−2 в 4 раза больше площади под процессом 3−4.
Таким образом, верны утверждения под номерами 3 и 5.
Ответ: 35.

Объяснение явлений
- Температура нагревателя идеального теплового двигателя, работающего по циклу Карно, равна T1, а температура холодильника равна T2. За цикл двигатель получает от нагревателя количество теплоты Q1. Установите соответствие между физическими величинами и формулами, по которым их можно рассчитать.
- К каждой позиции первого столбца подберите соответствующую позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
- ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ ФОРМУЛЫ 1)
- А) КПД двигателя
- Б) работа, совершаемая двигателем за цикл 2)
3)
4)
- Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:

Решение.
А) КПД идеального теплового двигателя, работающего по циклу Карно рассчитывается по формуле
Б) Работа, совершаемая двигателем за цикл равна количеству теплоты, получаемому от нагревателя, умноженному на КПД
Ответ: 12 .

Источники информации
- 1.ФИПИ: открытый банк заданий
- 2.ЕГЭ-2018 Физика Демидова М. Ю. типовые экзаменационные варианты: 30 вариантов ФИПИ
- 3.ЕГЭ-2018 Е. В. Лукашева, Н. И. Чистякова Типовые тестовые задания от разработчиков ЕГЭ
- 4.Решу ЕГЭ












 t 1 и, следовательно, Q 0 (тело получает тепло). При охлаждении тела t 2и t 1 и, следовательно, Q " width="640"
t 1 и, следовательно, Q 0 (тело получает тепло). При охлаждении тела t 2и t 1 и, следовательно, Q " width="640"



































