ПРезентация урока по теме "Основания", 7 класс. Изучение нового материала- состав, название, классификация, физические и химические свойства оснований.
Просмотр содержимого документа
«Презентация урока по теме "Основания"»

ОСНОВАНИЯ

Основания - сложные вещества, состоящие из атомов металла, соединённых с одной или
несколькими гидроксогруппами
Общая формула: Me(OH) n
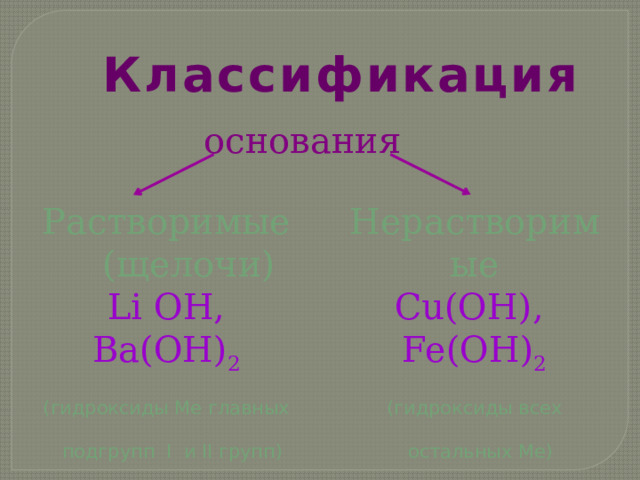
Классификация
основания
Растворимые
Нерастворимые
(щелочи)
Cu(OH), Fe(OH) 2
Li OH, Ba(OH) 2
(гидроксиды всех
(гидроксиды Ме главных
остальных Ме)
подгрупп I и II групп)
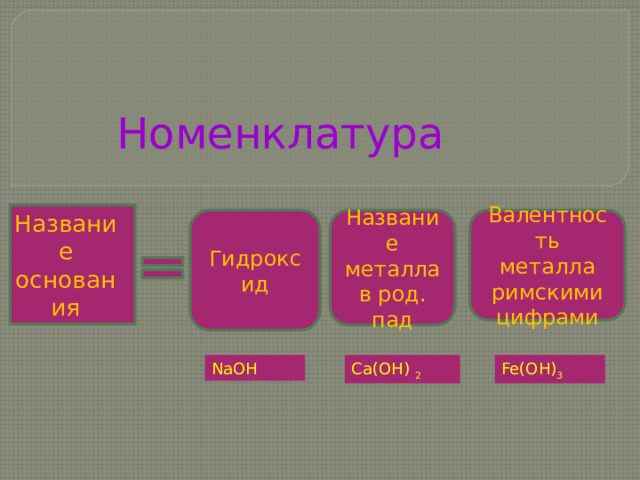
Номенклатура
Название
основания
Гидроксид
Название металла в род. пад
Валентность
металла римскими цифрами
Fe(OH) 3
Ca(OH) 2
NaOH

Химические свойства оснований
- Взаимодействия с кислотами
- Взаимодействие с оксидами неметаллов

Качественные реакции
Индикатор – вещество, изменяющее свой цвет
в зависимости от среды растворов
Действие щелочей на индикаторы
Индикатор
Фенолфталеин
Окраска индикатора
Лакмус
Малиновый
Синий
Метиловый оранжевый
Желтый
назад

Взаимодействие с кислотами

Нейтрализация
Нейтрализация- реакция кислот с основаниями, приводящая к образованию сол и и воды :
NaOH + HCl = NaCl + H 2 O
Fe(OH) 3 + 3HCl = FeCl 3 + 3H 2 O
За прохождением реакций можно наблюдать по изменениям окраски индикаторов.
Вывод: В результате данных реакций раствор стал нейтральными.
назад

Взаимодействие с оксидами неметаллов
NaOH + CO 2 = Na 2 CO 3 + H 2 O
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
( качественная реакция на гидроксид кальция –
помутнение известковой воды)

































