
- Классификация химических реакций в неорганической и органической химии
Подготовила и провела :учитель химии и биологии высшей категории
Т. И. Гребенникова
19.02.2018г.

- Цели урока:
- обобщить представления о химической реакции как о процессе превращения одного или нескольких веществ в другие вещества;
- рассмотреть классификацию химических реакций в органической и неорганической химии, применять ее при характеристике химических реакций

Химические реакции -
это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
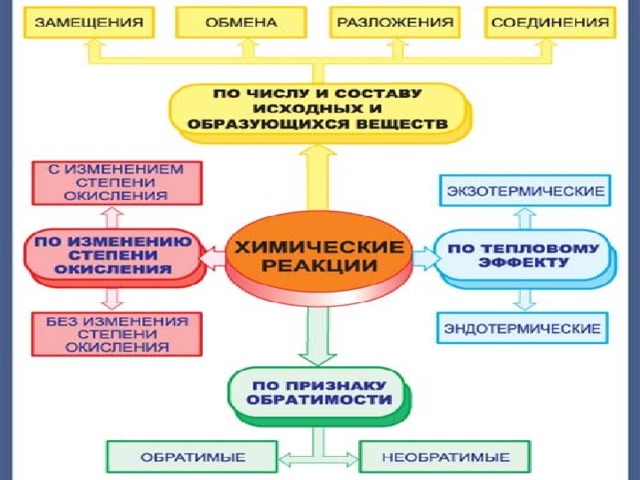
- Классификация химических реакций

Классификация
химических реакций
1). По числу и составу реагирующих и образующихся веществ
2).По изменению степени окисления атомов элементов
3).По использованию катализатора
4).По направлению
5).По механизму
6).По тепловому эффекту
7). По виду энергии, инициирующей реакцию
8). По фазовому составу

1. По числу и составу реагирующих и образующихся веществ:

Классификация
химических реакций
I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие без изменения состава веществ.
В неорганической химии к таким реакциям относят процессы получения аллотропных модификаций одного химического элемента, например:
Sn (белое олово) Sn (серое олово)

Классификация
химических реакций
I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие с изменением состава вещества
1. Реакции соединения – реакции, при которых из двух и более веществ образуется одно сложное вещество.
S + O 2 = S O 2
2SO 2 + O 2 = 2SO 3
SO 3 + H 2 O = H 2 SO 4

П.П. Бажов
«Малахитовая шкатулка»

Реакция разложения малахита:
(CuOH) 2 CO 3 = 2CuO + H 2 O + CO 2
оксид углерода
(IV)
оксид меди
(II)
малахит
вода


Классификация
химических реакций
Получение кислорода из перманганата калия:
10

Классификация
химических реакций
I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие с изменением состава вещества
2. Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
2Hg O = 2Hg + O 2
2KNO 3 = 2KNO 2 + O 2
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
10

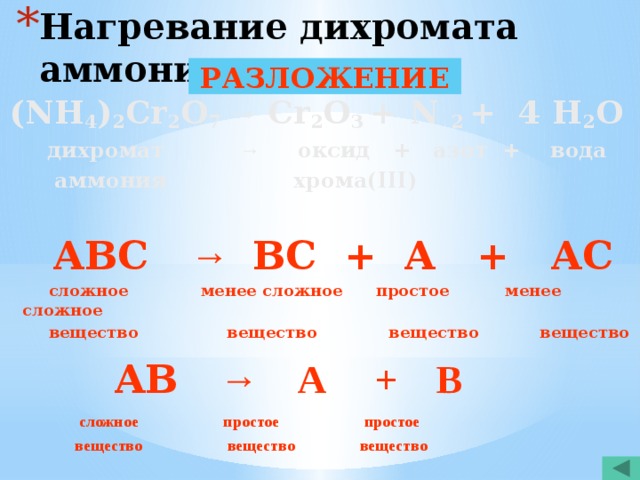
- Нагревание дихромата аммония
(NH 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + N 2 + 4 H 2 O
дихромат → оксид + азот + вода
аммония хрома(III)
АВС → ВС + А + АС
сложное менее сложное простое менее сложное
вещество вещество вещество вещество
АВ → А + В
сложное простое простое
вещество вещество вещество
РАЗЛОЖЕНИЕ

Классификация
химических реакций
I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие с изменением состава вещества
3. Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
Zn + 2 H Cl = Zn Cl 2 + H 2
2Na + 2H 2 O = 2NaOH + H 2
Fe + CuSO 4 = FeSO 4 + Cu ↓
10

Классификация
химических реакций
I. По числу и составу реагирующих и образующихся веществ:
Реакции, идущие с изменением состава вещества
4. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Cu SO 4 + 2 K OH = Cu (OH) 2 + K 2 SO 4
NaOH + HNO 3 = NaNO 3 + H 2 O
2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
10


II. По изменению степеней окисления химических элементов

Классификация
химических реакций
II. По изменению степеней окисления химических элементов:
1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней окисления элементов (все реакции замещения, а также реакции соединения и разложения, в которых участвует хотя бы одно простое вещество).
Cu SO 4 + Fe = Fe SO 4 + Cu↓
Zn + 2HCl = ZnCl 2 + H 2 ↑
Mg + H 2 SO 4 = MgSO 4 + H 2 ↑
10

- По признаку изменения степени окисления
- 2) протекают без изменения степени окисления элементов
10
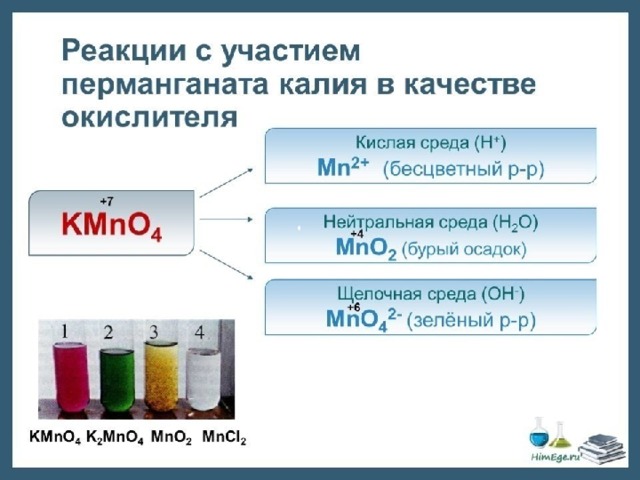
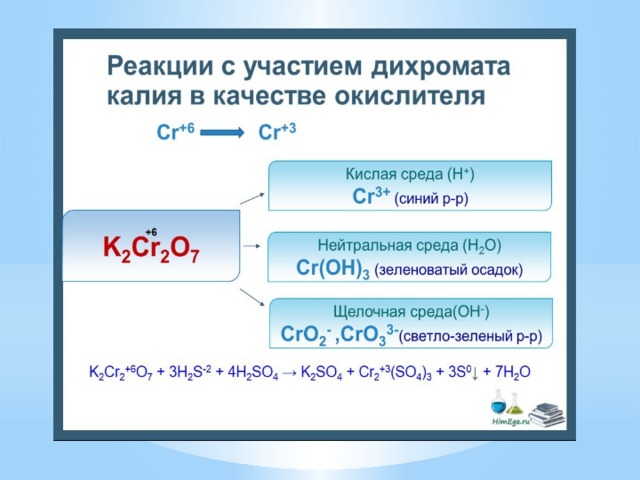

- III. По использованию катализатора:

Классификация
химических реакций
III. По использованию катализатора:
1. Некаталитические реакции – реакции, идущие без участия катализатора:
t
2 Hg O = 2 Hg + O 2 ↑
10

КАК РАЗЛАГАЕТСЯ ХЛОРАТ КАЛИЯ и как горит аммиак ?

Классификация
химических реакций
III. По использованию катализатора:
1. Каталитические реакции – реакции, идущие с участием катализатора:
MnO 2
2 H 2 O 2 = 2 H 2 O + O 2 ↑
10


Классификация
химических реакций
IV. По направлению:
1. Необратимые реакции протекают в данных условиях только в одном направлении:
Ba(ClO 2 ) 2 + H 2 SO 4 = 2HClO 2 + BaSO 4 ↓
2. Обратимые реакции в данных условиях протекают одновременно в двух направлениях:
3H 2 + N 2 2NH 3
N 2 O 4 2NO 2
10

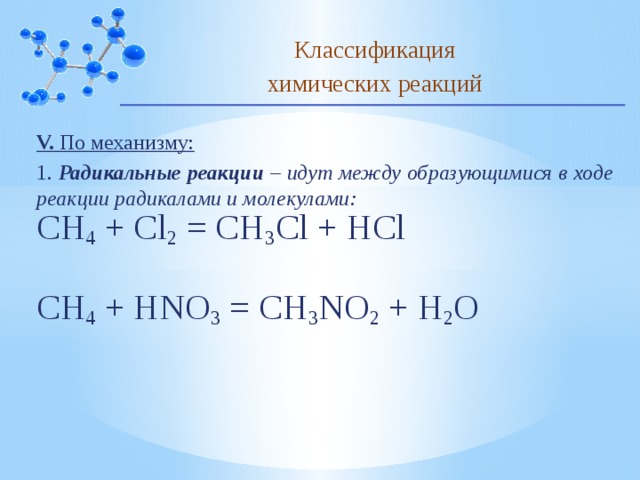
V. По механизму:
Классификация
химических реакций
V. По механизму:
1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
CH 4 + Cl 2 = CH 3 Cl + HCl
CH 4 + HNO 3 = CH 3 NO 2 + H 2 O
10

Классификация
химических реакций
V. По механизму:
2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции ионами:
C 2 H 4 + HBr = C 2 H 5 Br
10

VI. По тепловому эффекту:

Классификация
химических реакций
VI. По тепловому эффекту:
2. Эндотермические реакции протекают с поглощением энергии :
N 2 + O 2 = 2NO – Q кДж
2HgO = 2Hg↓ + O 2 ↑ - Q кДж
10

Классификация
химических реакций
VI. По тепловому эффекту:
1. Экзотермические реакции протекают с выделением энергии :
4P + 5O 2 = 2P 2 O 5 + Q кДж
10

VII. По виду энергии, инициирующей реакцию

Классификация
химических реакций
VII. По виду энергии, инициирующей реакцию:
- Фотохимические реакции инициируются световой энергией .
- Радиационные реакции инициируются излучениями большой энергии – рентгеновскими лучами, ядерными излучениями.
- Электрохимические реакции инициируются электрическим током (электролиз).
- Термохимические реакции инициируются тепловой энергией (все эндотермические реакции и множество экзотермических).
10

VIII. По фазовому составу

Классификация
химических реакций
Восстановление оксида меди (II) водородом:
10

Классификация
химических реакций
VIII. По фазовому составу:
1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся в разных агрегатных состояниях:
CuO↓ + H 2 ↑ = Cu ↓ + H 2 O
10

Классификация
химических реакций
VIII. По фазовому составу:
2. Гомогенные реакции – реакции, в которых реагирующие вещества и продукты находятся в одном агрегатном состоянии (в одной фазе):
2 СО ↑ + О₂↑ = 2 СО₂↑
10

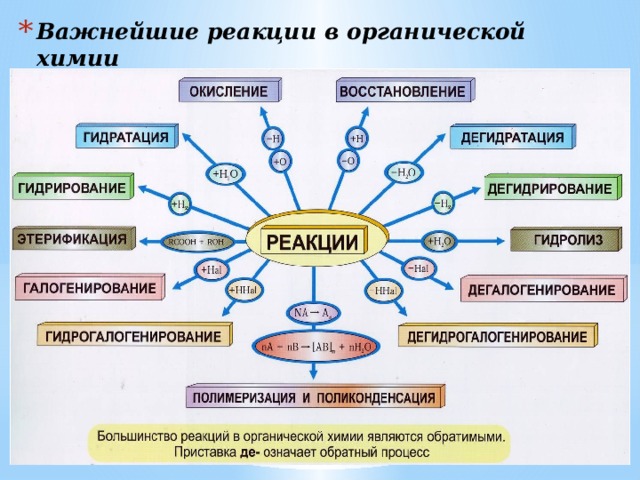
- Важнейшие реакции в органической химии
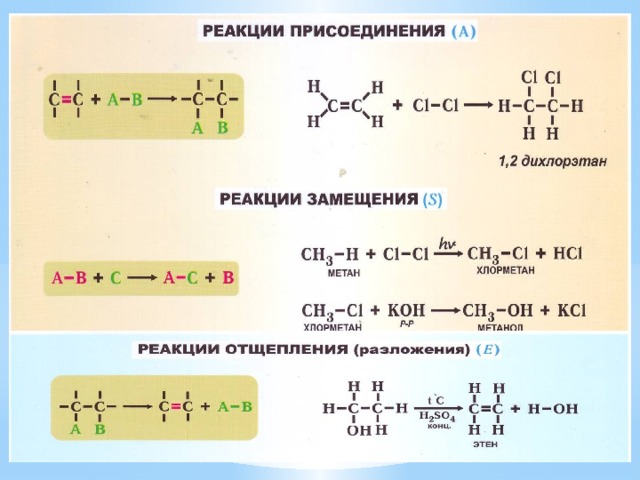
- Типы химических реакций по числу и составу реагирующих веществ
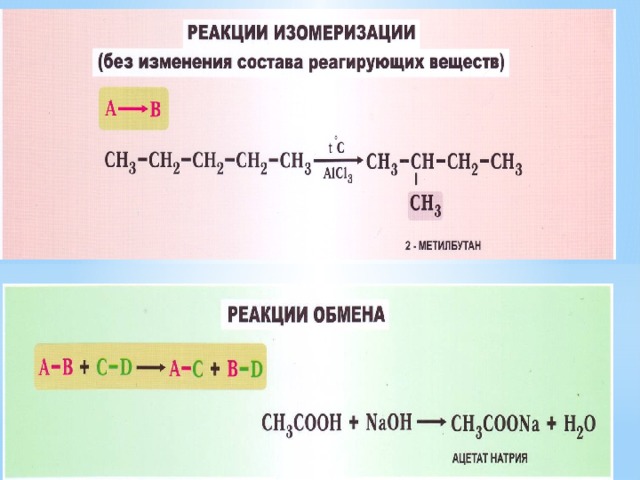
- Типы химических реакций по числу и составу реагирующих веществ
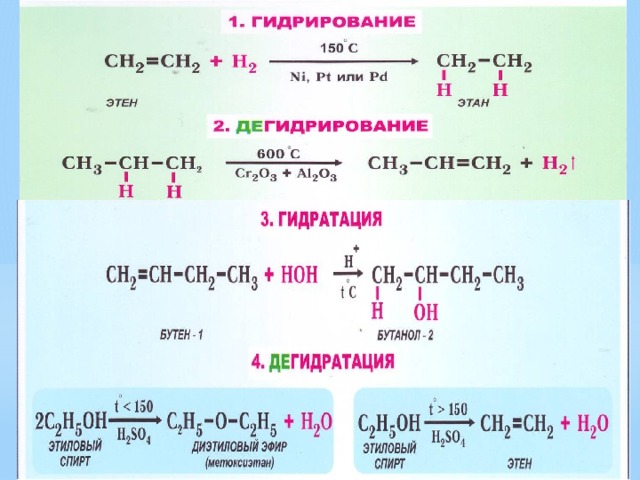
- Виды органических реакций
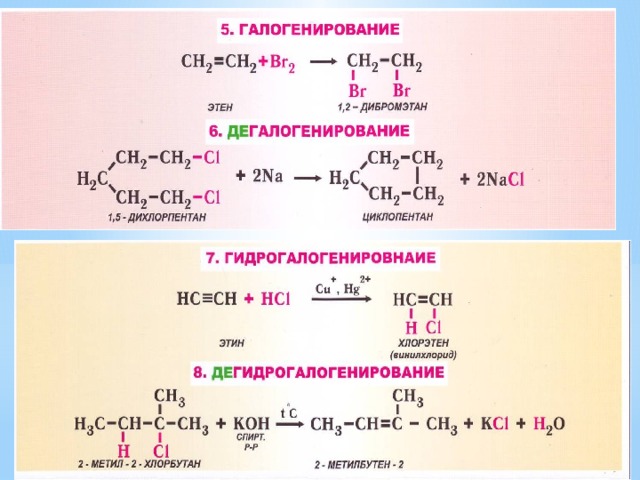
- Виды органических реакций
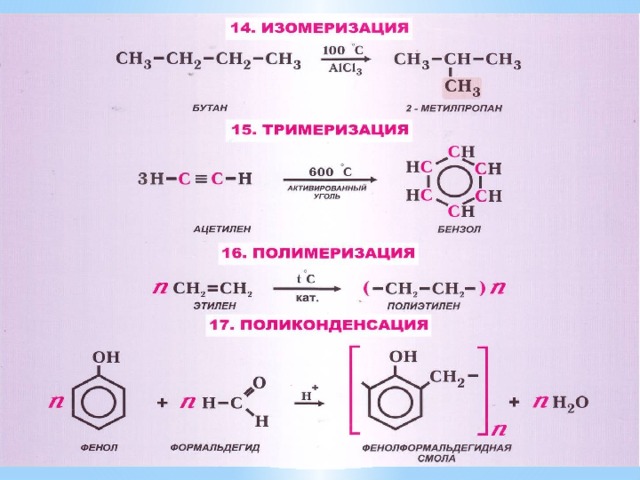
- Виды органических реакций
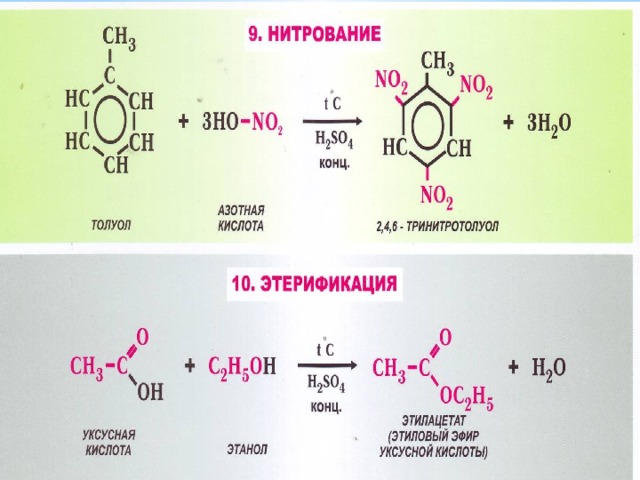
- Виды органических реакций
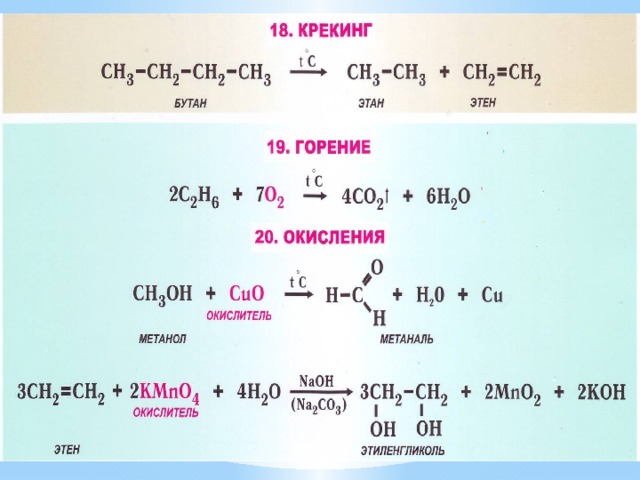
- Виды органических реакций


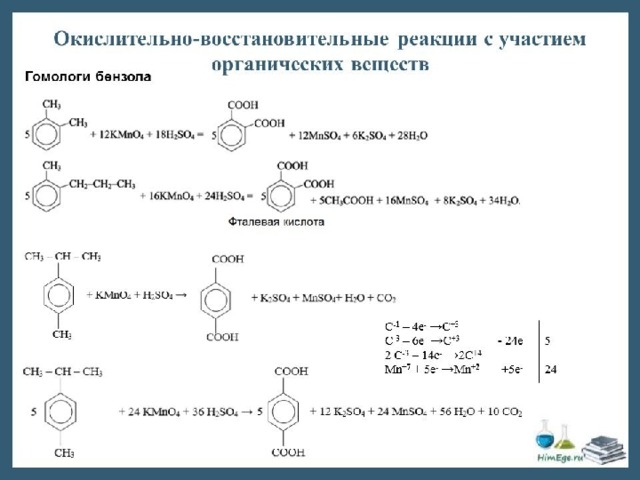

Подумай ещё немного!


18
Задание 18 № 980. К реакциям замещения относится взаимодействие
1) ацетилена с хлором
2) этилена с хлором
3) бензола с хлором в присутствии катализатора
4) бутадиена-1,3 с хлором
Ответ:

1. К какому типу реакций относится: а) получение хлорметана из метана; б) получение бромбензола из бензола; в) получение хлорэтана из этилена ; г) получение этилена из этанола; д) превращение бутана в изобутан; е) дегидрирование этана; ж) превращение бромэтана в этанол? 2. Какие реакции характерны для: а) алканов; б) алкенов? Приведите примеры реакций.

Задание 23. К реакциям синтеза высокомолекулярных веществ относится
1) гидратация
2) полимеризация
3) гидрогенизация
4) пиролиз

Задание 18. К реакциям замещения относится взаимодействие брома с
1) водородом
2) магнием
3) этиленом
4) пропаном

Реакция, уравнение которой
2СО (г) → СО 2(г) + С (тв) + Q
относится к реакциям:
А) соединения, экзотермическим
Б) разложения, экзотермическим
В) соединения, эндотермическим
Г) разложения, эндотермическим

Дайте характеристику для химического уравнения по признакам классификации:
MnO2
2Н2О2=2Н2О+О2 +Q

Определите окислитель и восстановитель .
Задание 36. Используя метод электронного
баланса, составьте уравнение реакции:



МОЛОДЦЫ!!

- Конспект , читать параграф 11.
- СТР.76 № 1-3.

Спасибо за
внимание!


























































































