
Тема урока:
Общая характеристика галогенов.
Галогены - простые вещества
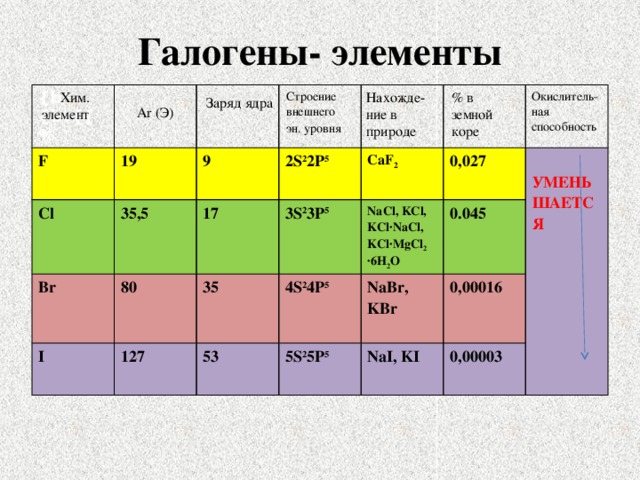
Галогены- элементы
Строение внешнего
Хим.
Нахожде-ние в природе
% в земной коре
Окислитель-ная
эн. уровня
элемент
способность
{b/ {bv{{%
F
Cl
19
9
35,5
Br
2S 2 2P 5
17
I
80
CaF 2
3S 2 3P 5
127
35
NaCl, KCl,
0,027
53
4S 2 4P 5
УМЕНЬШАЕТСЯ
0.045
KCl∙NaCl,
NaBr, KBr
5S 2 5P 5
KCl∙MgCl 2 ∙6H 2 O
0,00016
NaI, KI
0,00003
Заряд ядра
Ar (Э)
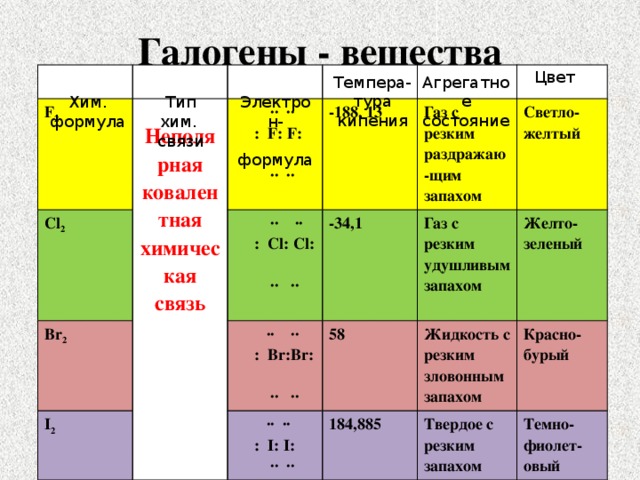
Галогены - вещества
Цвет
F 2
Ти
Cl 2
Неполярная ковалентная химическая связь
Br 2
∙∙ ∙∙
: F: F:
-188, 13
∙∙ ∙∙
I 2
∙∙ ∙∙
Газ с резким раздражаю-щим запахом
: Сl: Cl:
-34,1
∙∙ ∙∙
: Br:Br:
58
Светло-желтый
Газ с резким удушливым запахом
∙∙ ∙∙
∙∙ ∙∙
Желто-зеленый
∙∙ ∙∙
Жидкость с резким зловонным запахом
: I: I:
184,885
Красно-бурый
∙∙ ∙∙
Твердое с резким запахом
Темно-фиолет-овый
Темпера-
Агрегатное
тура кипения
состояние
Хим. формула
Тип хим.
Электрон-
связи
формула

Фтор F
Хлор Cl
Иод I
Бром Br

Химические свойства
Галогены- самые сильные окислители в своих периодах
- Взаимодействие с металлами:
а) F 2 реагирует с металлами при обычных условиях:
Zn 0 + F 2 0 → Zn +2 F 2 -1
б) остальные галогены реагируют при нагревании:
2Sb 0 + 3Cl 2 0 → 2Sb +3 Cl 3 -1
2Sb 0 + 5Cl 2 0 → 2Sb +5 Cl 5 -1
2Fe 0 + 3Cl 2 0 → 2Fe +3 Cl 3 -1
Cu 0 + Br 2 0 → Cu +2 Br 2 -1
2Al 0 + 3I 2 0 → 2Al +3 I 3 -1 (катализатор – Н 2 О)
2) Вытеснение галогенов из растворов их солей:
2Na Br - + Cl 2 0 → 2NaCl - + Br 2 0
2K I - + Cl 2 0 → 2KCl - + I 2 0

Химические свойства
3) Горение воды во фторе
2F 2 + 2H 2 O → 4HF + O 2
4) Взаимодействие с водородом
H 2 + Г 2 → 2НГ
Фтор реагирует без нагревания, хлор –на свету, бром – при нагревании, иод – при более сильном нагревании.

Демонстрация опытов
№ 130,131,128, 132,135

Решение задачи на избыток и недостаток
Решить упр.8
Домашнее задание §17,
упр. 1-4, 7

Тема урока:
Соединения галогенов.
Получение и применение галогенов

Цели урока
Рассмотреть свойства и применение важнейших соединений галогенов . Изучить качественные реакции на галогенид-ионы. Рассмотреть природные соединения галогенов и способы получения галогенов в промышленности

Проверка домашнего задания
1.Чем отличаются свойства галогенов от свойств ЩМ?
2. С какими простыми веществами взаимодействуют галогены?
3. Как реагирует фтор с водой? Назовите окислитель и восстановитель?
4. Назовите условия образования галогеноводородов
5. Что показывает относительная плотность какого-либо газа по водороду
по кислороду, по воздуху?
6. Сформулируйте закон Авогадро

Важнейшие соединения галогенов
1.Все галогеноводороды – бесцветные газы, с резким запахом, токсичны. Хорошо растворяются в воде, дымят на воздухе. Водные растворы галогеноводородов – кислоты:
HF – фтороводородная , или плавиковая ;
HCl – хлороводородная, или соляная;
HBr - бромоводородная;
HI – иодоводородная.
Вывод : самая сильная кислота - ?
Самая слабая кислота - ?
Ответ аргументируйте
Степень диссоциации
Увеличивается

Хлороводород и соляная кислота
Получение
1). В лаборатории:
2 NaCl (крист.) + H 2 SO 4(конц.) → 2HCl↑ + Na 2 SO 4(крист.)
2). В промышленности:
H 2 + Cl 2 → 2HCl
Соляная кислота – Бесцветная жидкость, дымит на воздухе, несколько тяжелее воды. Типичная кислота
Свойства соляной кислоты:
HCl + M → ?
HCl + оксиды металлов → ?
HCl + основания→ ?
HCl + соли → ?
Охарактеризовать реакции в свете теории электролитической диссоциации
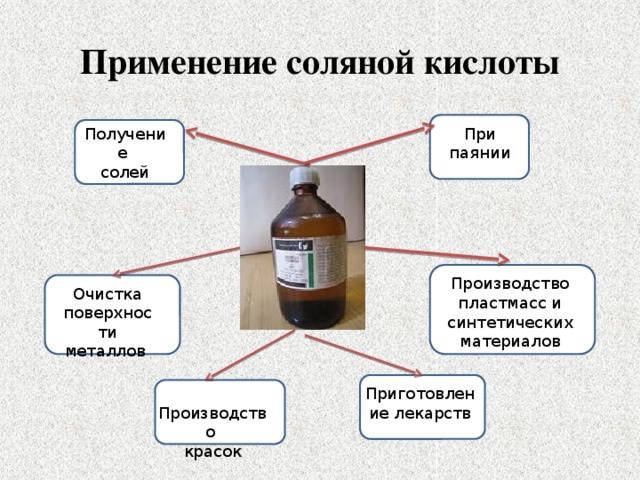
Применение соляной кислоты
при
По
Получение
При паянии
солей
При паянии
Производство пластмасс и синтетических материалов
о
Очистка поверхности металлов
Приготовление лекарств
Производство
красок

Распознавание хлоридов, бромидов, иодидов
- NaCl + AgNO 3 → NaNO 3 + AgCl↓
(белый осадок)
2. NaBr + AgNO 3 → NaNO 3 + AgBr↓
(Светло-желтый осадок)
3. NaI + AgNO 3 → NaNO 3 + AgI↓
(желтый осадок)

Домашнее задание
§18, упр.2-4, 19, упр. 1,2








































