Просмотр содержимого документа
«Презентация к уроку по химии 8 класс»

Презентацию подготовила
учитель химии и биологии
МБОУ «Обоянская СОШ № 3»,
Астанина Надежда Николаевна
2013 г

«Зимняя ночь» Б.Пастернак
Мело, мело по всей земле
Во все пределы.
Свеча горела на столе,
Свеча горела.

Химический эксперимент
- Zn + 2HCl = ZnCl2 + H2↑ + Q
- Признаками проводимой реакции будут выделение газа и теплоты.
- NH4NO3 + H2O ⇄ NH4OH + HNO3 – Q
- Признаком проводимой реакции будет поглощение теплоты.

- Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции.
- Тепловой эффект обозначается Q и измеряется в Дж или кДж.
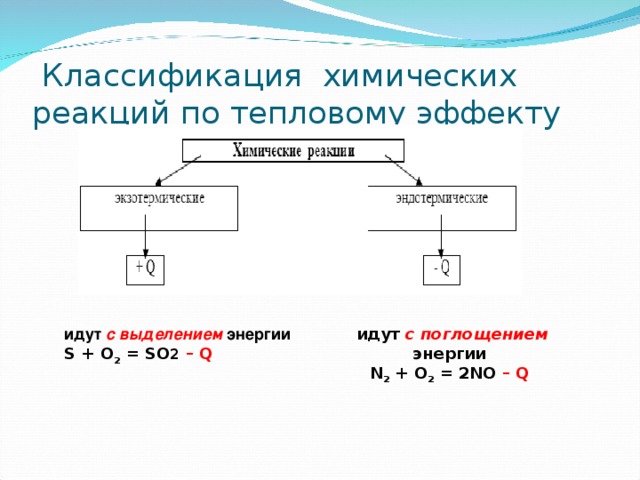
Классификация химических реакций по тепловому эффекту
идут с выделением энергии S + O 2 = SO 2 – Q
идут с поглощением энергии N 2 + O 2 = 2NO – Q
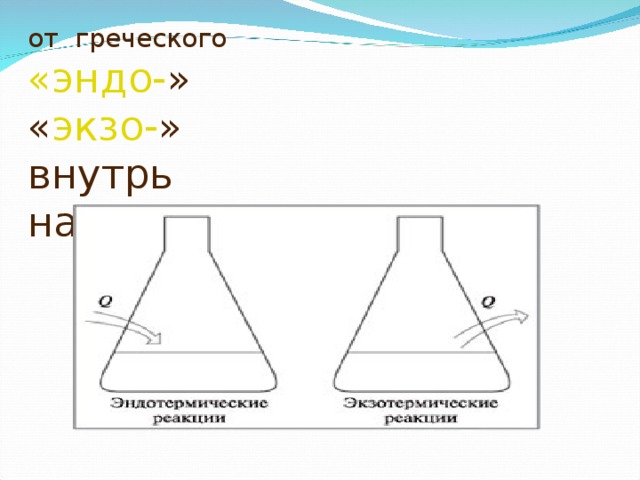
от греческого «эндо- » « экзо- » внутрь наружу
 2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж " width="640"
2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж " width="640"
Химические уравнения, в которых указывается тепловой эффект, называют термохимическими.
2HgO — 2Hg + O 2 – 180 кДж,
С(тв) + O 2 (г) — СO 2 (г) + 394 кДж

Герман Иванович Гесс
-Российский академик
-Основоположник термохимии
Термохимия — раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции

Алгоритм решения задач по термохимическому уравнению
- Кратко записать условия задачи (“дано”).
- Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркнуть то, что известно и то, что необходимо определить.
- Провести вспомогательные вычисления. m = M * v
- Составить пропорцию, используя вспомогательные вычисления и условия задачи, и решить ее.
- Записать ответ.

Заполни пропуски
1. Реакции, протекающие с выделением теплоты и света называются реакциями …..
- а) разложения;
- б) эндотермические;
- в) экзотермические
- г)замещения

2. Какие схемы можно назвать термохимическими уравнениями реакций?
- а) 2 H 2 (г) + O 2 (г) = 2 H 2 О(ж) + 572 кДж
- б) 2 H 2 + O 2 = 2 H 2 О + 572 кДж
- в) 2 H 2 (г) + O 2 (г) = 2 H 2 О(ж)

3. Какая запись, соответствует эндотермической реакции?
- а) С(тв) + O 2 (г) = СO 2 (г) + 394 кДж
- б) СаСO 3 = СO 2 + СаО – 310 кДж
- г) Н 2 + I 2 = 2HI – 52 кДж
- д) 3Fe + O 2 = Fe 3 O 4 + 118 кДж

4. Приведены уравнения реакций:
1. С+О 2 = СО 2 + 402,24кДж
2. 2HgO = 2Hg + О 2 -180кДж
Определите тип, к которому относятся данные реакции.
- А) обе реакции экзотермические
- Б) обе реакции эндотермические
- В) А – эндотермическая, а Б – экзотермическая
- Г) А – экзотермическая, а Б – эндотермическая

Самопроверка
1-в 2-а,б 3-б,г 4-г













 2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж " width="640"
2Hg + O 2 – 180 кДж, С(тв) + O 2 (г) — СO 2 (г) + 394 кДж " width="640"

















