Презентация к уроку по химии в 9 классе. Тема: "Положение металлов в ПСХЭ, нахождение и физические свойства". Тип урока: комбинированный. Рассматривается электронное строение, нахождение, получение и физические свойства металлов.
Просмотр содержимого документа
«Презентация "Металлы".»



- составляют большую часть химических элементов
- с увеличением номера периода металлов становится больше:
- 2-ой период – 2 металла (литий и бериллий),
- 3-ий период – 3 металла (натрий, магний, алюминий),
- 4-ой период – 13 металлов,
- 7-ой период – 29 металлов.

Электронное строение атомов металлов
На внешнем электронном слое: один – три электрона
Радиус атомов металлов
Больше, чем у неметаллов
Следовательно :
Атомы металлов легче отдают наружные электроны, чем атомы неметаллов
Следовательно:
являются сильными восстановителями
Следовательно:
атомы металлов при химических превращениях в положительно заряженные ионы:
Ме 0 – ne – →Me n+
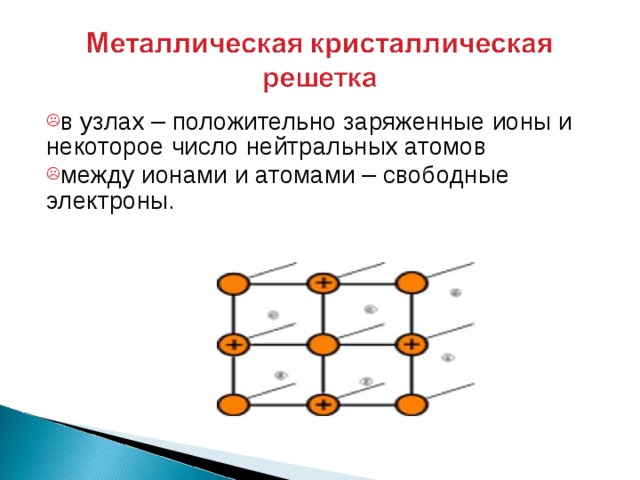
- в узлах – положительно заряженные ионы и некоторое число нейтральных атомов
- между ионами и атомами – свободные электроны.
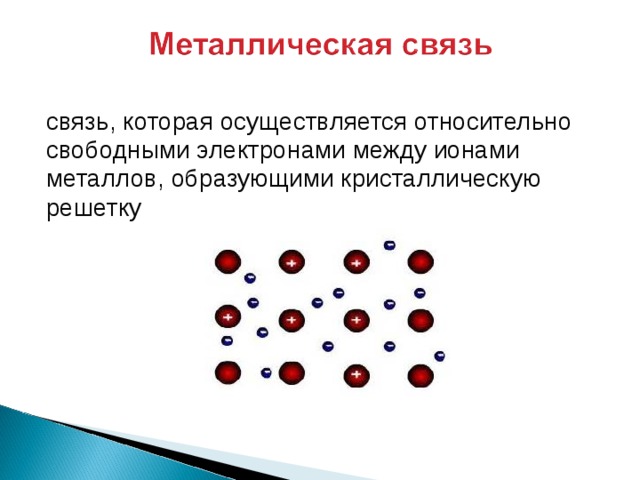
связь, которая осуществляется относительно
свободными электронами между ионами
металлов, образующими кристаллическую
решетку

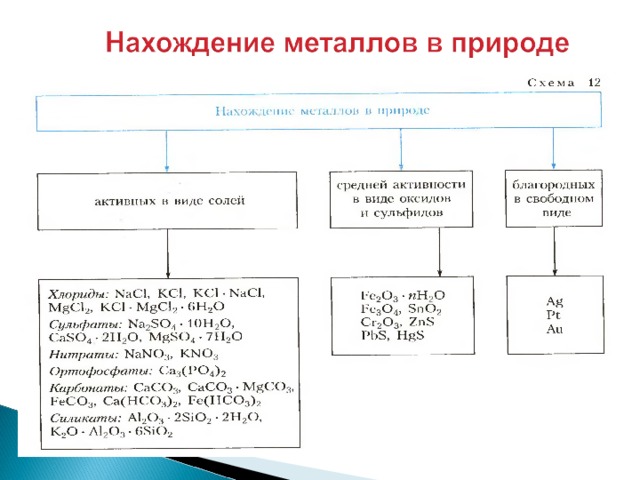
- Самый распространенный металл в земной коре – алюминий.
- За ним следует железо, кальций, натрий, калий, магний и титан.
- Металлы встречаются в природе как в свободном виде, так и в различных соединениях.

Основаны на процессе восстановления из различных соединений:
1) Из оксидов:
а) действием водорода
б) действием оксида углерода ( II )
в) действием алюминия (магния)
2) Из солей:
а) гидрометаллургический
б) из сульфидов с предварительным обжигом

а) действием водорода (водородотермия)
CuO + H 2 = Cu + H 2 O
б) действием оксида углерода ( II )
Fe 2 O 3 + CO = Fe + CO 2
в) действием алюминия (алюмотермия) или магния ( магнийтермия )
MnO 2 +AI=AI 2 O 3 +Mn
Cr 2 O 3 + Mg = Cr + Mg O
Расставьте коэффициенты в уравнениях!

а) гидрометаллургический
- растворени е природного соединения с целью получения раствора соли этого металла :
CuO + H 2 SO 4 = CuSO 4 + H 2 O
- вытеснение металла более активным металлом
CuSO 4 + Fe = FeSO 4 + Cu
б) из сульфидов с предварительным обжигом

- Теплопроводность;
- Металлический блеск;
- Ковкость и пластичность;
- Электропроводность
Обусловлены:
- металлической связью,
- металлической кристаллической решеткой.


§34, §35, §36
Выполнить упражнение 9, задача 1 (стр.112)








































