
Тема УРОКА:
«Белки»

Что такое жизнь ?
Философско-теоретическое представление Ф. Энгельса о сущности жизни: «Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, не находящееся в процессе разложения, мы без исключения встречаем и явления жизни».

Определение жизни
“ Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и сама жизнь, что приводит к разложению белка”. (Ф.Энгельс)

Проблема урока
Сегодня мы должны раскрыть тайну веществ, лежащих в основе понятия “жизнь”, т.е. должны ответить на вопрос “Что такое белок?”

Я приглашаю вас в живой природы мир,
Где интерес – наш главный ориентир.
Узнаем мы, что всё здесь не случайно,
Найдём ответы, разгадаем тайны…
Порой, чтоб разрешились все сомненья,
Достаточно нам будет наблюденья.
Вопрос возник, иль снова сомневаемся –
Тогда к эксперименту обращаемся.
Тема занятия:
«Белки»

Цели занятия:

Образовательные :
- расширить знания о белках - биологических полимерах.
- выяснить строение, состав и свойства белков.
- классифицировать белки по их функциям в организме.
- с помощью межпредметных связей способствовать формированию научной картины мира.

Развивающие:
- формирование основных учебных компетенций: учебной, коммуникативной, личностной;
- развитие умений и навыков самостоятельного учебного труда с информационными источниками;
- развитие умений анализировать, сравнивать, обобщать, делать выводы, выступать перед аудиторией;
- формирование высокого уровня мыслительной деятельности.

Воспитательные:
- формирование адекватной самостоятельности УЧАЩИХСЯ ;
- воспитание потребности в знаниях, повышения познавательных интересов;
- привитие интереса к естественным наукам.

Вопросы, рассматриваемые на УРОКЕ :
- Понятие о белках. Состав и строение белковых молекул.
- Физико-химические свойства белков.
- Функции белков и их классификация.
- Значение белков в природе, в пищевой промышленности и в жизни человека.

Вопрос № 1
Понятие о белках. Состав и строение белковых молекул

Белки - основа жизни
Химический состав организма человека:
- вода 65%,
- жиры 10%,
- углеводы 5%,
- белки 18%,
- другие неорганические и органические вещества 2%.

Преобладающим компонентом в клетках тканей является белок
- На долю белков приходится более 50% сухой массы клетки.
- Содержание белков в сухой массе различных тканей сильно различается:
- в мышцах — 80%,
- в коже — 63%,
- в печени — 57%,
- в мозге — 45%,
- в костях —20%.

Белки обладают большой молекулярной массой:
Молекулярная масса:
- яичного альбумина составляет 36 000,
- гемоглобина — 152 000,
- миозина (одного из белков мышц) — 500 000.
Это в тысячи и десятки тысяч раз больше молекулярных масс неорганических соединений.

«Жизнь есть способ существования белковых тел…».
Ф. Энгельс

Где есть белки, там есть и жизнь, поэтому второе название белков – протеины (от греческого «первый», «важнейший»).

«Чтобы постичь бесконечное, надо сначала разъединить,
а потом соединить»
Гете

Элементарный состав белков :
- углерод - 50-55%,
- кислород - 21-23%,
- азот - 15-17%,
- водород - 6-7%,
- сера - 0,3-2,5%.
- В составе отдельных белков обнаружены также фосфор, йод, железо, магний и некоторые другие элементы. Белки относят к азотсодержащим органическим соединениям.
-

Огромная роль в исследовании белков принадлежит:
Я. Беккари
Фредерик Сенджер
Фишер
А.Я.Данилевский
В 1888 году высказал мысль о том, что белки состоят из остатков аминокислот, соединённых пептидной связью.
Первый очищенный белок получен в 1728 г.
Л. Полинг
разработал представления о структуре полипептидной цепи в белках, впервые высказал мысль о ее спиральном строении и дал описание альфа-спирали (1951г., совместно с американским биохимиком Р. Б. Кори).
В 1902 году выдвинул полипептидную теорию строения белков.
В 1945 г. установил структуру инсулина, а
в 1953 г синтезировал его

Белки- это высокомолекулярные природные соединения (полимеры), молекулы которых построены из остатков аминокислот, соединенных пептидной связью

- В клетках и тканях обнаружено свыше 170 различных аминокислот. В составе всех белков входит только
20 α -аминокислот.
- из них может быть образовано 2 432 902 008 176 640 000 комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением и …

Строение аминокислот:
у всех аминокислот, входящих в состав белковых молекул, аминогруппа находится в α -положении, т.е. у второго углеродного атома.

Задание.
- Напишите формулу трипептида, образованного аминокислотами: валином, цистеином, тирозином .
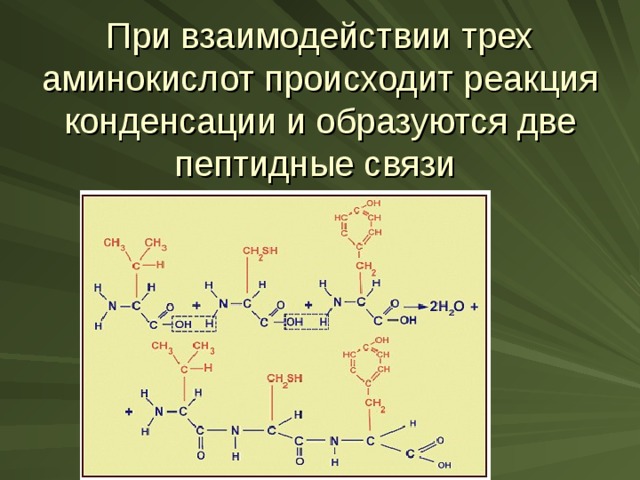
При взаимодействии трех аминокислот происходит реакция конденсации и образуются две пептидные связи

Схема образования полипептида
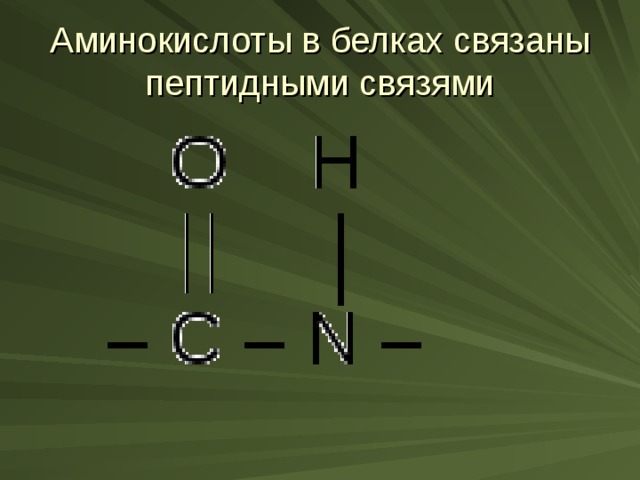
Аминокислоты в белках связаны пептидными связями

Аминокислоты, входящие в состав белков
Большинство аминокислот, входящих в состав белков, могут синтезироваться в организме в процессе обмена (из других аминокислот, поступающих в избытке). Они получили название заменимых аминокислот. Некоторые аминокислоты не могут синтезироваться в организме и должны поступать в наш организм с пищей. Они получили название незаменимых аминокислот. Их 8, они не способны синтезиро ваться в организме человека, но поступают в него с растительной пищей. Какие же это аминокислоты? Это валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан. Иногда в их число включают гистидин и аргинин. Две последние не синтезируются в организме ребенка.
Большинство аминокислот, входящих в состав белков, могут синтезироваться в организме в процессе обмена (из других аминокислот, поступающих в избытке). Они получили название заменимых аминокислот. Некоторые аминокислоты не могут синтезироваться в организме и должны поступать в наш организм с пищей. Они получили название незаменимых аминокислот. Их 8, они не способны синтезиро ваться в организме человека, но поступают в него с растительной пищей. Какие же это аминокислоты? Это валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан. Иногда в их число включают гистидин и аргинин. Две последние не синтезируются в организме ребенка.

Большинство аминокислот, входящих в состав белков, могут синтезироваться в организме в процессе обмена (из других аминокислот, поступающих в избытке). Они получили название заменимых аминокислот .

Некоторые аминокислоты не могут синтезироваться в организме и должны поступать в наш организм с растительной пищей. Они получили название незаменимых аминокислот . Их 8. Это валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан . Иногда в их число включают гистидин и аргинин . Две последние не синтезируются в организме ребенка

Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул.
Выделяют 4 уровня структурной организации белка
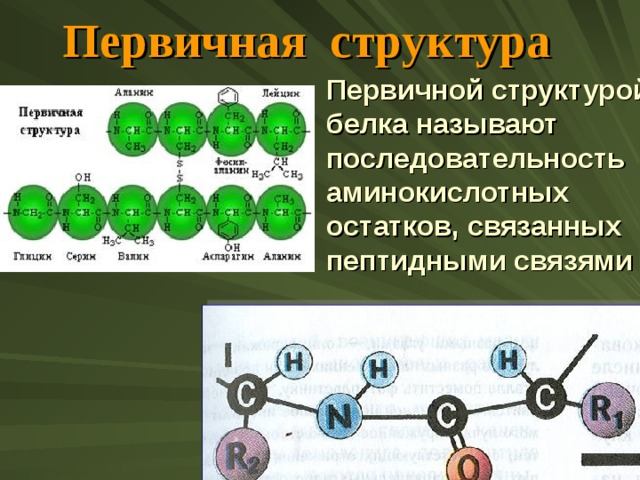
Первичная структура
Первичной структурой белка называют последовательность аминокислотных остатков, связанных пептидными связями
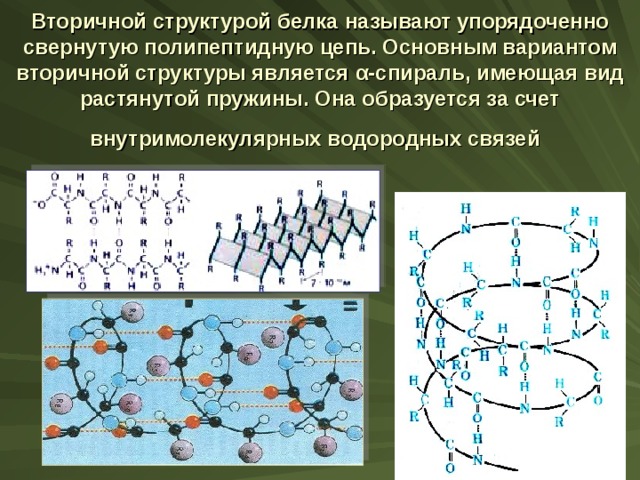
Вторичной структурой белка называют упорядоченно свернутую полипептидную цепь. Основным вариантом вторичной структуры является α -спираль, имеющая вид растянутой пружины. Она образуется за счет внутримолекулярных водородных связей

Третичная структура
В образовании третичной структуры большая роль
принадлежит радикалам, за счёт которых образуются дисульфидные мостики, сложноэфирные связи, водородные связи.
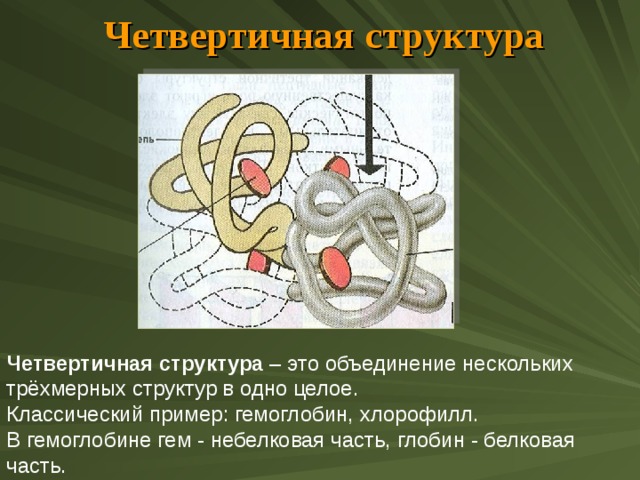
Четвертичная структура
Четвертичная структура – это объединение нескольких трёхмерных структур в одно целое.
Классический пример: гемоглобин, хлорофилл.
В гемоглобине гем - небелковая часть, глобин - белковая часть.

Характеристика трех структур белковых молекул
Структура белковой молекулы
Первичная — линейная
Характеристика структуры
Порядок чередования аминокислот в полипептидной цепи — линейная структура
Вторичная — спиралевидная
Тип связи, определяющий структуру
Пептидная связь
— NH— СО-
Закручивание полипептидной линейной цепи в спираль — спиралевидная структура
Графическое изображение
Третичная — глобулярная
Упаковка вторичной спирали в клубок — клубочковидная (глобулярная) структура или фибриллы
Внутримолекулярные водородные связи
Дисульфидные и ионные связи

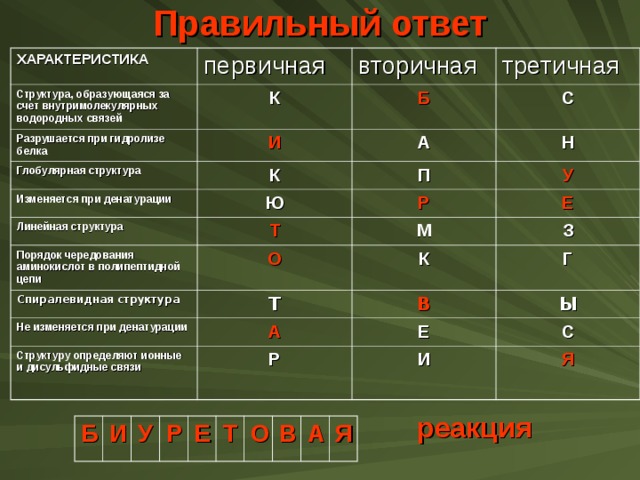
Задание
Отметьте в таблице характеристики, соответствующие структурам молекул белков.
Из букв, соответствующих правильным ответам, вы составите название качественной реакции на белки :
реакция
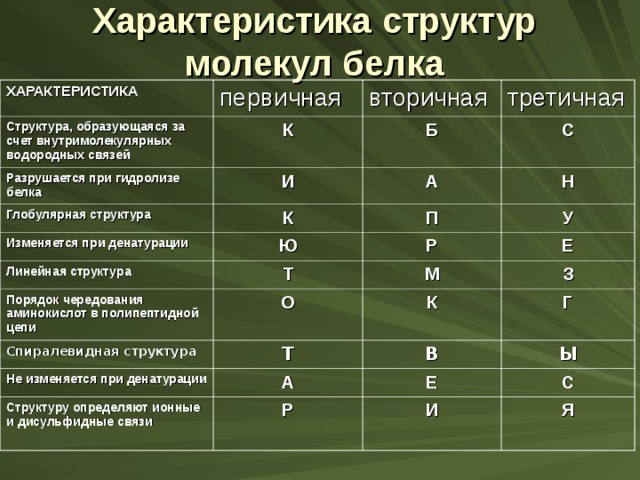
Характеристика структур молекул белка
ХАРАКТЕРИСТИКА
первичная
Структура, образующаяся за счет внутримолекулярных водородных связей
вторичная
К
Разрушается при гидролизе белка
Глобулярная структура
третичная
Б
И
Изменяется при денатурации
К
А
С
Н
П
Ю
Линейная структура
У
Р
Т
Порядок чередования аминокислот в полипептидной цепи
Е
М
О
Спиралевидная структура
З
К
Т
Не изменяется при денатурации
Структуру определяют ионные и дисульфидные связи
Г
В
А
Р
Ы
Е
С
И
Я
Правильный ответ
ХАРАКТЕРИСТИКА
первичная
Структура, образующаяся за счет внутримолекулярных водородных связей
вторичная
Разрушается при гидролизе белка
К
третичная
И
Глобулярная структура
Б
С
А
К
Изменяется при денатурации
П
Ю
Линейная структура
Н
Порядок чередования аминокислот в полипептидной цепи
У
Р
Т
Спиралевидная структура
О
Е
М
З
К
Т
Не изменяется при денатурации
Структуру определяют ионные и дисульфидные связи
Г
В
А
Р
Е
Ы
С
И
Я
реакция
Б
И
У
Р
Е
Т
О
В
А
Я

Физико-химические свойства белков

Белки – амфотерные электролиты. При определённом значении рН среды (она называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одной из свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения их из растворов, например в технологии получения белковых продуктов.

Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства:
- Набухают, их масса и объём увеличиваются.
Набухание белка сопровождается его частичным растворением.
- При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями.
- Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока).
- Фибриллярные белки не растворяются в воде.

Денатурация белка
- Денатурация белка - нарушение природной вторичной и третичной и четвертичной структур белка под действием различных факторов (температуры, радиации, химических веществ, и т.д.)
Виды денатурации :
(т.е.высаливание)
Фильм1
Фильм2
Фильм3

Денатурированный белок теряет свои биологические свойства.
Процесс восстановления вторичной и третичной структур белка называется ренатурацией.

Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость –газ», называемые пенами.
Белки в качестве пенообразователей используются в кондитерской промышленности (пастила, зефир, суфле).
Структуру пены имеет хлеб, а это влияет на его вкусовые свойства.

Для пищевой промышленности можно выделить два очень два очень важных свойства белков:
1) Гидролиз белков под действием ферментов;
2) Реакция меланоидинообразования.
Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
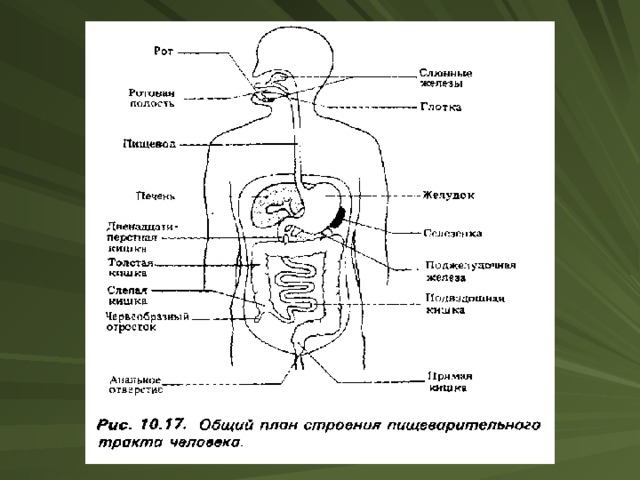

Превращение белков в организме
В организмах животных и человека под влиянием ферментов ( пепсин, трипсин, эрипсин и т. д.) происходит гидролиз белков. В результате этого образуются аминокислоты, которые всасываются ворсинками кишечника в кровь. При этих процессах в организме выделяется энергия.

Проведение эксперимента






Меланоидинообразование
Под меланоидинообразованием понимают взаимодействие восстанавливающих сахаров (монозы и восстанавливающие дисахариды, как содержащиеся в продукте, так и образующиеся пи гидролизе более сложных углеводов) с аминокислотами, пептидами и белками, приводящее к образованию темноокрашенных продуктов — меланоидинов

Топленое молоко
Ряженка, варенец, кефир, йогурт из топленого молока




Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жжёных перьев.

- биуретовая , при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди( II ) с образованием комплексных соединений между ионами Cu 2+ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Доказывает наличие пептидных связей в белках
Фильм

- ксантопротеиновая , при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением жёлтой окраски;
Фильм

- Цистеиновая реакция (сульфгидрильная):
Наличие в белках серы доказывается действие раствора щелочи и ацетата свинца. Выпадение черного осадка свидетельствует о присутствии в полученном растворе сульфид-аниона:
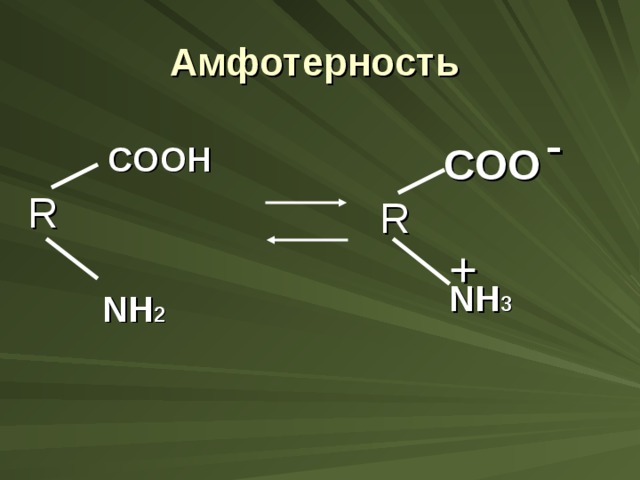
Амфотерность
-
COOH
COO
R
R
+
NH 3
NH 2

Проведение экспериментальной исследовательской работы

Задание группам:
Номер группы
Объект исследования
Группа №1
Содержание эксперимента
Белки пищи
Группа №2
Белки шелка и шерсти
1.Доказать наличие белков в молоке и молочных продуктах.
2.Определить массовую долю белков в молоке.
3. Сделать анализ содержания белков в молочных продуктах.
Группа №3
1. Исследовать состав и свойства белков шелка и шерсти.
2. Изучите данные таблицы и ответьте на вопрос: «Какие изменения происходят в шерсти и шелке при эксплуатации изделий из них?»
Белки кожи
1. Исследовать белки кожи.
2. Изучите данные таблицы и ответьте на вопрос: «Какие изменения происходят в коже при эксплуатации изделий из нее?»

Функции белков и их классификация

Запасающая (резервная)
Накопление белков в организме в качестве запасных питательных веществ
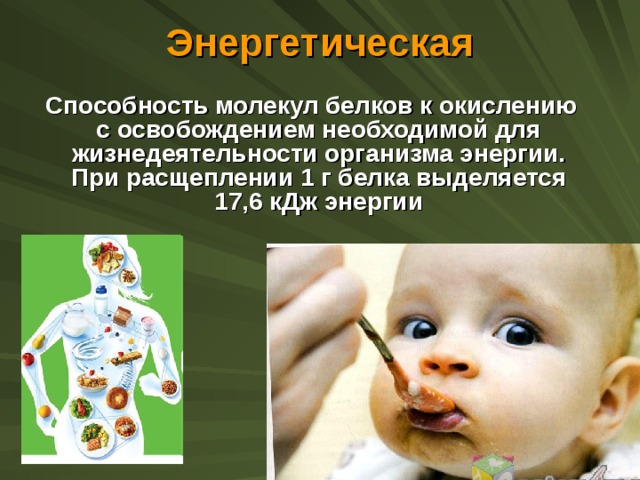
Энергетическая
Способность молекул белков к окислению с освобождением необходимой для жизнедеятельности организма энергии. При расщеплении 1 г белка выделяется 17,6 кДж энергии

Транспортная
Например, гемоглобин – белок, входящий в состав эритроцитов и обеспечивающий перенос кислорода и углекислого газа
Защитная
Антитела, фибриноген, тромбин – белки, участвующие в выработке иммунитета и свертывания крови
Двигательная (сократительная)
Актин и миозин – белки, входящие в состав мышечных волокон и обеспечивающие их сокращение.
Строительная
Белки – элементы всех тканей и органов, плазматической мембраны клетки, а также костей, хрящей, перьев, ногтей, волос
Гормональная
Гормоны – вещества, обеспечивающие на ряду с нервной системой гуморальную регуляцию функций в организме
Каталитическая или ферментативная
Белки -катализаторы, увеличивающие скорость химических реакций в клетках организма
Рецепторная
Реакция на внешний раздражитель

Функции белков в клетке
Название функции
Пояснения
Каталитическая
Большинство ферментов - белки
Строительная
Основа клеточных органоидов, волос, сосудов
Двигательная
Жгутики простейших - сократительные белки; белки мышц - актин и миозин
Транспортная
Гемоглобин - транспорт кислорода и углекислого газа
Защитная
Антитела (обеспечение иммунитета к заболеваниям)
Энергетическая
Некоторые белки служат источником энергии

Задание
Используя знания из химии, биологии и повседневной жизни, соотнесите типы белков и их функции в организме человека.
На столах листы с отпечатанными на них типами белков. В среднем столбике определите их функции, а в правом- подберите пример того или иного типа белков.

ТИП
БИОЛОГИЧЕСКАЯ ФУНКЦИЯ
Структурные белки мышц
ПРИМЕР БЕЛКОВ
Двигательная
Белки соединительных тканей
Миозин, актин
Строительная
Хромосомные белки
Кератин (кожа, волосы, ногти); коллаген (сухожилия)
Строительная
Контролирующие белки
Переносчики кислорода и других веществ
Контроль за потоком веществ внутрь и вовне организма, передача информации внутри организма (рецепторная)
Гистоны (часть структуры хромосом)
Белки-рецепторы мембран
Транспортная
Ферменты
Гемоглобин
Каталитическая
Гормоны
Протеазы
Регуляция процессов жизнедеятельности (регуляторная)
Защитные белки
Инсулин, половые гормоны
Защитная
Гаммаглобулин , антитела

Критерии оценок:
8 - 10 правильных ответов - «3»
11 - 13 правильных ответов - «4»
14 - 16 правильных ответов - «5»

Классификация белков

По составу (по степени сложности) различают белки:
- простые белки - протеины, состоящие только из аминокислот
- сложные белки - протеиды – содержащие небелковую часть , которая может включать углеводы (гликопротеиды), липиды (липопротеиды), нуклеиновые кислоты (нуклеопротеиды), фосфорную кислоту (фосфопротеиды) (казеин)
- полноценные – содержат весь набор аминокислот
- неполноценные – какие–то аминокислоты в их составе отсутствуют

По форме молекул :

По растворимости в отдельных растворителях:
- водорастворимые, растворимые в слабых солевых растворах (альбумины)
- спирторастворимые (проламины)
- растворимые в щелочах (глютелины)
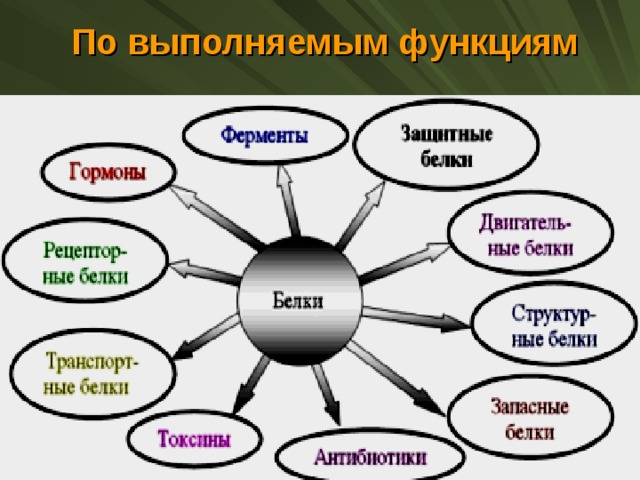
По выполняемым функциям

Вопрос № 4
Значение белков в природе, в пищевой промышленности и в жизни человека

Белки составляют примерно 20 % массы человеческого тела и 50 % сухой массы клетки. В тканях человека белки не откладываются «про запас», поэтому необходимо ежедневное их поступление с пищей.
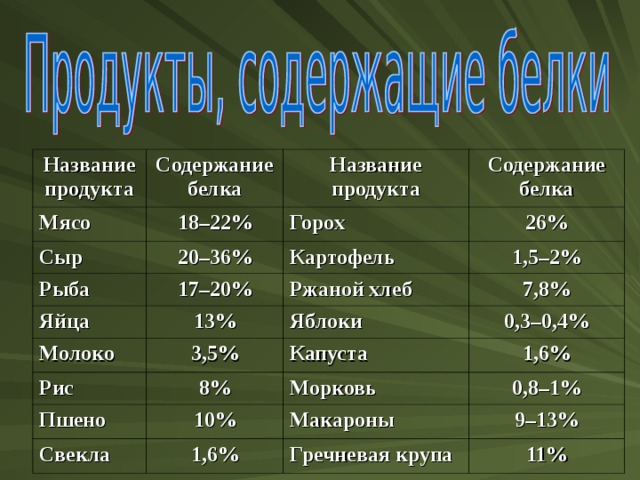
Название продукта
Содержание белка
Мясо
18–22%
Название продукта
Сыр
Рыба
Содержание белка
Горох
20–36%
17–20%
26%
Яйца
Картофель
Молоко
13%
1,5–2%
Ржаной хлеб
7,8%
3,5%
Яблоки
Рис
Пшено
8%
0,3–0,4%
Капуста
1,6%
10%
Морковь
Свекла
0,8–1%
Макароны
1,6%
9–13%
Гречневая крупа
11%

Решение задач с практическим содержанием
Задача . Больше всего белка в сыре (до 25%), мясных продуктах (в свинине 8 – 15, баранине – 16-17, говядине 16 – 20%), в птице (21%), рыбе (13 – 21%), яйцах (13%), твороге (14%). Молоко содержит 3% белков, а хлеб – 7-8%.Рассчитайте массу каждого из этих продуктов, обеспечивающую дневную потребность взрослого человека в белках, равную 200г.





Белки – обязательная составная часть всех живых клеток, они играют важную роль в живой природе, являются главным и незаменимым компонентом питания. Это связанно с той огромной ролью, которую они играют в процессах развития и жизни человека. Белки являются основой структурных элементов и тканей, поддерживают обмен веществ и энергии, участвуют в процессах роста и размножения, обеспечивают механизмы движения, развитие иммунных реакций, необходимы для функционирования всех органов и систем организма.
Можно без преувеличения сказать, что белок играет в организме самую важную роль. Из белков строится все наше тело. Каждый белок определяет какое-нибудь свойство организма: цвет глаз, волос, строение внутренних органов и т. д. Есть белки воспринимающие также тепло, запах, вкус, механические колебания. Раздражители «дергают» за кончик белкового «клубка», начиная его разматывать. В результате возбуждение передается нервным клеткам. По такому же принципу работает белок гемоглобина, разносящий по нашему телу кислород.
Белковые вещества составляют громадный класс органических углеродисто-азотистых соединений, неизбежно встречаемых в каждом организме. Роль белков в организме огромна.

Закрепление нового материала:
Ответить на вопросы теста

Ответы к тесту
Вариант 1:
- 1 - б,
- 2 - б,
- 3 - а,
- 4 - г,
- 5 - б,
- 6 – 1 -а,в; 2 -б,г,
- 7 -б,
- 8 -а,
- 9 -б,
- 10 -в
Вариант 2 :
- 1 - б,
- 2 - г,
- 3 - а,
- 4 - а,
- 5 - в,
- 6 – 1б, 2 -б, 3 -а, 4 -а;
- 7 - г,
- 8 - б,
- 9 - в,
- 10 - г

Критерии оценок:
6 – 7 правильных ответов - «3»
8 - 10 правильных ответов - «4»
11 - 13 правильных ответов - «5»

« Я всегда говорил и не устаю повторять, что мир не мог бы существовать, если бы был так просто устроен.»
Гете

Домашнее задание:
- Изучить страницы учебника:
А.П. Нечаев «Органическая химия» стр. 291-296
2 . Подготовиться к лабораторной работе.




















































































































