Вариант 1
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат валентные электроны как на s, так и на d-подуровнях.
Начало формы
Конец формы
2. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют конфигурацию внешнего энергетического уровня ns2np1.
Начало формы
Конец формы
3. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Br
2) F
3) N
4) Li
5) S
4. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
Se
Zn
Cl
S
Cd
5. Выберите два элемента, которые образуют гидроксид состава HЭО3.
Начало формы
Конец формы
6. Выберите два элемента, валентность которых в высшем оксиде совпадает с их валентностью в водородном соединении.
Начало формы
Конец формы
7. Из предложенного перечня выберите два соединения с атомной кристаллической решеткой.
Начало формы
Медь
Графит
Оксид кремния (IV)
Хлор
Хлорид алюминия
Конец формы
8. Выберите два вещества, содержащие как ионные, так и ковалентные неполярные связи.
CaCl2
CH3OLi
FeS2
Na2O2
NH4NO3
9. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите:
А) соль азотистой кислоты, Б) комплексную соль, В) сульфид меди (II)
| 1 CuSO4 | 2 Cu2S | 3 [Ag(NH3)2]Cl |
| 4 Mg3N2 | 5 Fe(NO3)3 · 9H2O | 6 KCl · MgCl2 |
| 7 CuS | 8 H2[SiF6] | 9 Ba(NO2)2 |
10. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите:
А) амфотерный гидроксид, Б) солеобразующий оксид, В) сильную кислоту
| 1 B(OH)3 | 2 H2O2 | 3 CO |
| 4 Zn(OH)2 | 5 SO2(OH)2 | 6 HClO2 |
| 7 BaO2 | 8 H2S | 9 SeO3 |
11. К одной из пробирок с гидроксидом кальция добавили раствор соли X, а через другую пропустили газ Y. В результате в каждой из пробирок наблюдалось выпадение белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) H2
2) NH3
3) FeCl3
4) CO2
5) KF
12. К одной из пробирок с раствором иодида алюминия добавили раствор вещества X, а к другой – раствор вещества Y. В результате в первой пробирке наблюдалось выпадение, а затем растворение осадка, а во второй – выпадение желтого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Na3PO4
KOH
Na2CO3
AgNO3
NH3
13. Из предложенного перечня выберите все схемы, соответствующие реакциям гидролиза.
Начало формы
CH3COOC2H5 + H2O = CH3COOH + C2H5OH
C2H5Cl + KOH = C2H4 + KCl + H2O
PCl5 + 4H2O = H3PO4 + 5HCl
NaHCO3 + NaOH = Na2CO3 + H2O
CaC2 + 2H2O = Ca(OH)2 + C2H2
Конец формы
14. Из предложенного перечня выберите все вещества, взаимодействие которых с бромоводородной кислотой относится к окислительно-восстановительным реакциям замещения.
Начало формы
Хлор
Аммиак
Оксид марганца (IV)
Оксид меди (II)
Цинк
Конец формы
15. Из предложенного перечня выберите все реакции, скорость которых зависит от давления.
Начало формы
Гидролиз этилацетата
Окисление фосфина азотной кислотой
Восстановление магнетита угарным газом
Гидрирование метаналя
Омыление жиров
Конец формы
16. Из предложенного перечня выберите все воздействия, которые не влияют на скорость реакции, протекающей по схеме:
Cu2+ + Zn = Cu + Zn2+
Начало формы
Понижение давления
Уменьшение концентрации ионов цинка
Добавление воды в реакционную колбу
Понижение температуры
Добавление металлической меди
Конец формы
17. Для выполнения задания используйте следующие справочные данные.
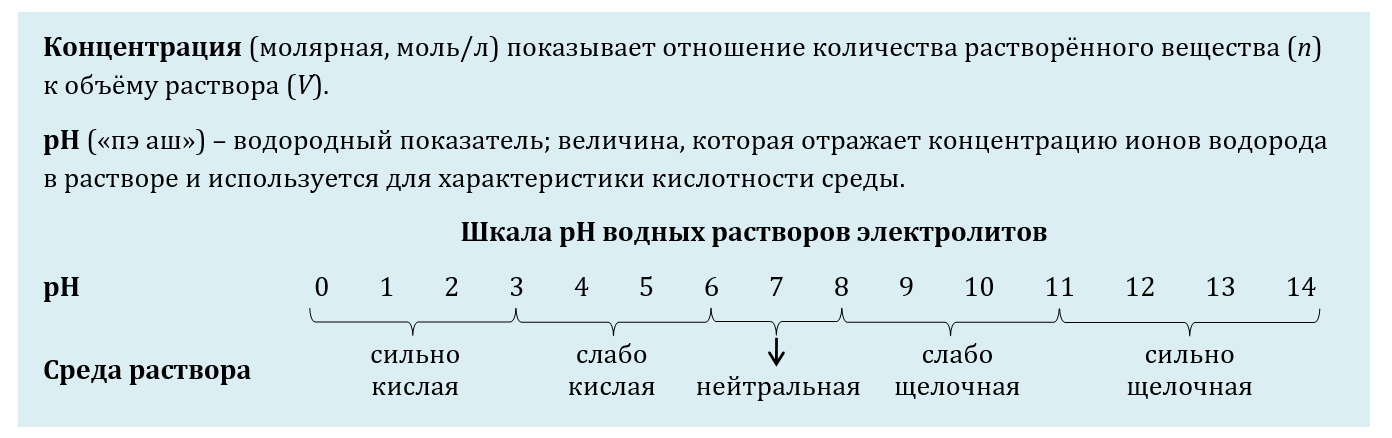
Для веществ, приведенных в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) Иодид марганца (II)
2) Перманганат калия
3) Иодоводород
4) Силикат натрия
Запишите номера веществ в порядке убывания значения pH их водных растворов.
18. Для веществ, приведенных в перечне, определите характер среды их водных растворов.
1. H3PO4
2. Na2CO3
3. K2SO4
4. AlCl3
Запишите номера веществ в порядке уменьшения значения pH их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
19. Установите соответствие между способом воздействия на равновесную систему
2HBr(г) ⇄ Br2(г) + Н2(г) – Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) понижение температуры
Б) добавление катализатора
В) повышение давления
Г) увеличение концентрации водорода | 1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3) практически не смещается |
20. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении концентрации водорода в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) H2(г) + S(тв.) ⇄ H2S(г) + Q
Б) H2O(г) + NO(г) ⇄ NO2(г) + H2(г) – Q
В) C2H2(г) + H2(г) ⇄ C2H4(г) + Q
Г) N2(г) + 3Н2(г) ⇄ 2NН3(г) + Q | 1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3) практически не смещается |
21. В результате реакции, термохимическое уравнение которой:
2C2H2 + 5O2 = 4CO2 + 2H2O + 2610 кДж,
выделилось 1305 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). Ответ запишите с точностью до целых.
22. Синтез аммиака протекает в соответствии с термохимическим уравнением реакции
N2 (г) + 3Н2 (г) = 2NН3 (г) + 92 кДж.
Определите количество теплоты, которое выделится в результате образования 560 мл (н.у.) газообразного аммиака. Запишите число с точностью до сотых.
23. Из предложенного перечня веществ выберите два сильных электролита, реакция ионного обмена между растворами которых протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
Перечень веществ: азотная кислота, гидроксид кальция, сульфид меди (II), хлорид аммония, сульфит калия, фтороводород. Допустимо использование водных растворов.























