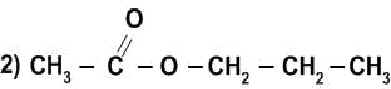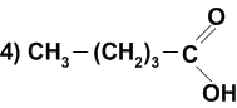СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Рабочая программа по предмету "Химия" 10 класс. Автор учебника О.С.Габриелян.
Рабочая программа составлена с учетом требований ФГОС. Рассчитана на 1 час в неделю, содержит пояснительную записку, основные требования к изучению предмета, предметные и метапредметные результаты изучения курса.
Просмотр содержимого документа
«Рабочая программа по предмету "Химия" 10 класс. Автор учебника О.С.Габриелян.»
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА с.АЛЬНЯШ»
ЧАЙКОВСКОГО МУНИЦИПАЛЬНОГО РАЙОНА
ПЕРМСКОГО КРАЯ
| Рассмотрено на заседании ШМО учителей естест.-мат.дисциплин Протокол № ___ от « » __________ 20… г., Руководитель: ________ /.............................../
| Согласовано заместитель директора по УВР ____________Е.Д.Назукина. «_____» «__________ » 2010 г «_____» __________ 20… г
| Утверждено: Директор МБОУ «СОШ с.Альняш» ______________Е,Ю,Хасанова «_____» __________ 20… г
|
РАБОЧАЯ ПРОГРАММА
учебного предмета «Химия»
муниципального бюджетного общеобразовательного учреждения
«Средняя общеобразовательная школа с.Альняш»
Чайковского муниципального района Пермского края
Ким Риммы Михайловны
Ф.И.О. учителя,
по химии 10 класс
2015-2016
1. Пояснительная записка.
Рабочая программа составлена на основе Государственного стандарта общего образования с учетом требований ФГОС второго поколения, Примерной программы среднего (полного) общего образования по химии (базовый уровень) 2007 г. и авторской Программы курса химии для 8-11 классов общеобразовательных учреждений (базовый уровень) О. С. Габриеляна 2007 г..
Общая характеристика учебного предмета
Среднее (полное) образование –третья, заключительная ступень общего образования. Содержание среднего (полного) общего образования направлено на решение двух задач:
Завершение общеобразовательной подготовки в соответствии с Законом об образовании;
2. Реализация предпрофессионального общего образования, которое позволяет обеспечить преемственность общего и профессионального образования.
Большой вклад в достижение главных целей среднего (полного) общего образования вносит изучение химии. Которое призвано обеспечить:
1.Формирование системы химических знаний как компонента естественно-научной картины мира;
2. развитие личности обучающихся, их интеллектуальное и нравственное совершенствование, формирование у них гуманистических отношений и экологически целесообразного поведения в быту и трудовой деятельности;
3. Выработку понимания общественной потребности в развитии химии, а также формирование отношений к химии как возможной области будущей практической деятельности;
4. Формирование умения безопасного обращения с веществами, используемыми в повседневной жизни.
Целями изучения химии в средней (полной) школе являются:
1. формирования умения видеть и понимать ценность образования, значимость химического знания для каждого человека независимо от его профессиональной деятельности; умения различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок с определенной системой ценностей, формулировать и обосновывать собственную позицию;
2. формирование целостного представления о мире, представления о роли химии в создании современной естественно- научной картины мира, умения объяснять объекты и процессы окружающей действительности (природной, социальной, культурной, технической среды), используя для этого химические знания.
3. приобретение опыта разнообразной деятельности, опыта познания и самопознания, ключевых навыков, имеющих универсальное значение для разных видов деятельности – навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного о обращения с веществами в повседневной жизни.
Ведущими идеями предлагаемого курса являются:
• материальное единство веществ природы, их генетическая связь;
• причинно-следственные связи между составом, строением, свойствами и применением веществ;
• познаваемость веществ и закономерностей протекания химических реакций;
• объясняющая и прогнозирующая роль теоретических знаний для фактологического материала химии элементов;
• конкретное химическое соединение представляет собой звено в непрерывной цепи превращений веществ, оно участвует в круговороте химических элементов и в химической эволюции;
• законы природы объективны и познаваемы; знание законов химии дает возможность управлять превращениями веществ, находить экологически безопасные способы производства веществ и материалов и охраны окружающей среды от химического загрязнения;
• наука и практика взаимосвязаны; требования практики — движущая сила развития науки, успехи практики обусловлены достижениями науки;
• развитие химической науки и химизация народного хозяйства служат интересам человека и общества в целом, имеют гуманистический характер и призваны способствовать решению глобальных проблем современности.
Изучение химии в старшей школе даѐт возможность достичь следующих результатов в направлении личностного развития:
В ценностно-ориентационной сфере – воспитание чувства гордости за российскую химическую науку, гуманизма, целеустремленности;
В трудовой сфере- готовность к осознанному выбору дальнейшей образовательной траектории;
В познавательной (когнитивной, интеллектуальной) сфере – умение управлять своей познавательной деятельностью.
Метапредметными результатами освоения выпускниками основной школы программы по химии являются:
использование умений и навыков различных видов различных видов познавательной деятельности, применение основных методов познания (системно-информационный анализ, моделирование) для изучения различных сторон окружающей действительности;
использование основных интеллектуальных операций: формулирование гипотез, анализ и синтез, сравнение, обобщение, систематизация, выявление причинно-следственных связей, поиск анализов;
Умение генерировать идеи и определять средства, необходимые для их реализации;
Умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
Использование различных источников для получения химической информации, понимание зависимости содержания и формы представления информации от целей коммуникации и адресата.
В области предметных результатов ученику предоставляется возможность научиться:
В познавательной сфере:
Давать определения изученным понятиям;
Описывать демонстрационные и самостоятельно проведенные эксперименты, используя для этого естественный (русский, родной) язык и язык химии;
Описывать и различать изученные классы неорганических и органических соединений, химические реакции;
Классифицировать изученные объекты и явления;
Наблюдать демонстрируемые и самостоятельно проводимые опыты, химические реакции, протекающие в природе и в быту;
Делать выводы и умозаключения из наблюдений, изученных химических закономерностей, прогнозировать свойства неизученных веществ по аналогии со свойствами изученных;
Интерпретировать химическую информацию, полученную из других источников;
Структурировать изученный материал;
Описывать строение атомов элементов 1 и 4 периодов с использованием электронных конфигураций атомов;
Моделировать строение простейших молекул неорганических и органических веществ, кристаллов;
В ценностно-ориентационной сфере
Анализировать и оценивать последствия для окружающей среды бытовой и производственной деятельности человека, связанной с переработкой веществ;
В трудовой сфере
Проводить химический эксперимент;
В сфере физической культуры
Оказывать первую помощь при отравлениях, ожогах и других травмах, связанных с веществами и лабораторным оборудованием.
В результате изучения химии на базовом уровне ученик должен знать / понимать
важнейшие химические понятия : вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
основные законы химии : сохранения массы веществ, постоянства состава, периодический закон;
основные теории химии : химической связи, электролитической диссоциации, строения органических соединений;
важнейшие вещества и материалы : основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы;
уметь
называть изученные вещества по «тривиальной» или международной номенклатуре;
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
характеризовать: элементы малых периодов по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений;
объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов;
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
объяснения химических явлений, происходящих в природе, быту и на производстве;
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
приготовления растворов заданной концентрации в быту и на производстве;
критической оценки достоверности химической информации, поступающей из различных источников информации.
Общая характеристика учебного процесса
При обучении учащихся по данной рабочей учебной программе используются следующие общие формы обучения:
индивидуальная (консультации);
групповая (учащиеся работают в группах, создаваемых на различных основах: по темпу усвоения – при изучении нового материала, по уровню учебных достижений – на обобщающих по теме уроках);
фронтальная (работа учителя сразу со всем классом в едином темпе с общими задачами);
парная (взаимодействие между двумя учениками с целью осуществления взаимоконтроля).
Данная программа предусматривает установление межпредметных связей с некоторыми предметами, изучаемыми в 10 классе: так, при изучении вопросов «Природные источники углеводородов». «Алканы», «Алкены» устанавливаются межпредметные связи с географией (месторождения природных ископаемых); при изучении физических свойств органических соединений – с физикой; при изучении вопросов применения органических соединений и их физиологического действия на организм – с биологией; при решении расчетных задач – с математикой.
При реализации данной рабочей учебной программы применяется классно – урочная система обучения. Таким образом, основной формой организации учебного процесса является урок. Кроме урока, используется ряд других организационных форм обучения (лекции с использованием презентаций по теме или материалов CD-дисков по органической химии; домашняя самостоятельная работа).
Система контроля по курсу 10 класса включает выполнение практических работ, проведение самостоятельных работ и 2 контрольных работ по темам «Углеводороды и их природные источники» (контрольная работа №1), «Кислородсодержащие органические соединения и их нахождение в живой природе» (контрольная работа № 2). Для отработки навыков составления формул изомеров и гомологов органических веществ, названий веществ по систематической номенклатуре, а также составлении уравнений химических реакций с участием органических веществ применяются дидактические карточки, которые также могут использоваться для оперативного контроля.
Учебный процесс при изучении курса химии в 10 классе построено с учетом следующих методов обучения:
- информационный;
- исследовательский (организация исследовательского лабораторного практикума, самостоятельных работ и т.д.);
- проблемный (постановка проблемных вопросов и создание проблемных ситуаций на уроке);
- использование ИКТ;
- алгоритмизированное обучение (алгоритмы планирования научного исследования и обработки результатов эксперимента, алгоритмы описания химического объекта, алгоритм рассказа о строении и свойствах химического элемента и т.д.);
- методы развития способностей к самообучению и самообразованию.
Общее количество часов в соответствии с программой: 34 часа
Количество часов в неделю по учебному плану: 1 час
- контрольных работ: 3
- практических работ: 3
2. Содержание тем учебного курса
Тема 1. «Теория строения органических соединений» (2 часа)
Межпредметные связи: неорганическая химия: валентность.
Валентность. Химическое строение как порядок соединения атомов в молекуле согласно их валентности. Основные положения теории химического строения органических соединений. Химические формулы и модели молекул в органической химии.
Демонстрации. Модели молекул гомологов и изомеров органических соединений.
Тема 2. «Углеводороды и их природные источники» (9 часов)
Межпредметные связи: география: месторождения природного газа и нефти в мире и Российской Федерации, физика: разделение жидкостей методом перегонки.
Природный газ. Природный газ как топливо. Преимущество природного газа перед другими видами топлива. Состав природного газа.
Алканы: гомологический ряд, изомерия и номенклатура алканов. Химические свойства алканов ( на примере метана и этана): горение, замещение, разложение и дегидрирование. Применение алканов на основе свойств.
Алкены. Этилен, его получение ( дегидрированием этана и дегидратацией этанола). Химические свойства этилена: горение, качественные реакции ( обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация. Полиэтилен. Его свойства и применение. Применение этилена на основе его свойств.
Алкадиены и каучуки. Понятие об алкадиенах как углеводородах с двумя двойными связями. Химические свойства бутадиена –1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки. Резина.
16
Алкины. Ацетилен, его получение пиролизом метана и карбидным способом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. Применение ацетилена на основе свойств. Реакция полимеризации винилхлорида. Поливинилхлорид и его применение.
Нефть. Состав и переработка нефти. Нефтепродукты. Бензин и понятие об октановом числе.
Бензол. Получение бензола из гексана и ацетилена. Химические свойства бензола: горение, галогенирование, нитрование. Применение бензола на основе его свойств.
Демонстрации. Горение метана, этилена, ацетилена. Отношение метана, этилена, ацетилена и бензола к раствору перманганата калия и бромной воде. Получение этилена реакцией дегидратации этанола и деполимеризации полиэтилена, ацетилена карбидным способом. Разложение каучука при нагревании, испытание продуктов разложения на непредельность. Коллекция образцов нефти и нефтепродуктов.
Лабораторные опыты.
Изготовление моделей молекул углеводородов.
Определение элементарного состава органических соединений.
Обнаружение непредельных соединений в жидких нефтепродуктах.
Получение и свойства ацетилена.
Ознакомление с коллекцией «Нефть и продукты её переработки».
Практическая работа №1 «Получение этилена и изучение его свойств.»
Тема 3. «Кислородсодержащие соединения и их нахождение в живой природе» (9 часов)
Межпредметные связи: Биология: углеводы (глюкоза, крахмал, клетчатка), жиры; каменный уголь. Физика: кокс, коксохимическое производство.
Углеводы. Единство химической организации живых организмов. Химический состав живых организмов.
Углеводы, их классификация: моносахариды(глюкоза), дисахариды(сахароза), полисахариды(крахмал и целюллоза). Значение углеводов в живой природе и жизни человека. Понятие о реакциях поликонденсации и гидролиза на примере взаимопревращений: глюкоза ↔ полисахарид.
Глюкоза – вещество с двойственной функцией – альдегидоспирт. Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, брожение
17
(молочнокислое и спиртовое).применение глюкозы на основе её свойств.
Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Представление о водородной связи. Химические свойства этанола: горение, взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основении его свойств. Алкоголизм, его последствия и предупреждение.
Понятие о предельных многоатомных спиртах. Глицерин как представитель многоатомных спиртов. Качественная реакция на многоатомные спирты. Применение глицерина на основе свойств.
Каменный уголь. Фенол. Коксохимическое производство и его продукция. Получение фенола коксованием каменного угля. Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. Поликонденсация фенола с формальдегидом в фенолформальдегидную смолу. Применение фенола на основе его свойств.
Альдегиды. Получение альдегидов окислением соответствующих спиртов. Химические свойства альдегидов: окисление в соответствующую кислоту и восстановление в соответствующий спирт. Применение формальдегида и ацетальдегида на основе свойств.
Карбоновые кислоты. Получение карбоновых кислот окислением альдегидов. Химические свойства уксусной кислоты: общие свойства с неорганическими и реакция этерификации. Применение уксусной кислоты на основе свойств. Высшие жирные кислоты на примере пальмитиновой и стеариновой.
Сложные эфиры и жиры. Получение сложных эфиров реакцией этерификации. Сложные эфиры в природе, их значение. Применение сложных эфиров на основе их свойств.
Жиры как сложные эфиры. Химические свойства жиров: гидролиз(омыление) и гидрирование жидких жиров. Применение жиров на основе свойств.
Демонстрации. Окисление спирта в альдегид. Качественная реакция на многоатомные спирты. Коллекция «Каменный уголь и продукты его переработки». Растворимость фенола в воде при обычной температуре и при нагревании. Качественные реакции на фенол. Реакция «серебряного зеркала» альдегилов и глюкозы. Окисление альдегидов и глюкозы в кислоты с помощью гидроксида меди (II). Получение уксусно – этилового и уксусно – изоамилового эфиров. Коллекция эфирных масел. Качественная реакция на крахмал.
Лабораторные опыты:
Свойства крахмала.
Свойства глюкозы.
Свойства этилового спирта.
Свойства глицерина.
Свойства формальдегида.
Свойства уксусной кислоты.
Свойства жиров.
Сравнение свойств растворов мыла и стирального порошка.
Тема 4. «Азотсодержащие соединения и их роль в живой природе» (7 часов)
Межпредметные связи. Биология: аминокислоты, пептидная связь, белки, структуры белков, функции белков. Нуклеиновые кислоты РНК и ДНК.Биотехнология и генная инженерия.
Амины. Понятие об аминах. Получение ароматического амина – анилина – из нитробензола. Анилин как органическое соединение. Взаимное влияние атомов в молекуле анилина: ослабление основных свойств и взаимодействие с бромной водой. Применение анилина на основе свойств.
Аминокислоты. Получение аминокислот из карбоновых кислот и гидролизом белков. Химические свойства аминокислот как амфотерных органических соединений : взаимодействие со щелочами, кислотами и друг с другом( реакция поликонденсации). Пептидная связь и полипептиды. Применение аминокислот на основе свойств.
Белки. Получение белков реакцией поликонденсации аминокислот. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз и цветные реакции. Биохимические функции белков.
Генетическая связь между классами органических соединений.
Нуклеиновые кислоты. Синтез нуклеиновых кислот в клетках из нуклеотидов. Общий план строения нуклеотида. Сравнение строения и функций РНК и ДНК. Роль нуклеиновых кислот в хранении и передаче наследственной информации. Понятие о биотехнологии и генной инженерии.
Демонстрации.
Взаимодействие аммиака и анилина с соляной кислотой. Реакция анилина с бромной водой. Доказательства наличия функциональных групп в растворах аминокислот. Растворение и осаждение белков. Цветные реакции белков : ксантопротеиновая и биуретовая. Горение птичьего пера и шерстяной нитки. Модель молекулы ДНК. Переходы: этанол → этилен → этиленгликоль → этиленгликолят меди (II). Этанол → этаналь → этановая кислота.
Лабораторные опыты. Свойства белков.
Практическая работа №2 Решение экспериментальных задач по идентификации органических соединений.
Тема 5. «Биологически активные органические соединения» (3 часа)
Межпредметные связи. Биология: Ферменты, гормоны, витамины, лекарства.
Ферменты. Ферменты как биологические катализаторы белковой природы. Особенности функционирования ферментов. Роль ферментов в жизнедеятельности живых организмов и в народном хозяйстве.
19
Витамины. Понятие о витаминах. Нарушения, связанные с витаминами : авитаминозы, гипо – и гипервитаминозы. Витамин С как представитель водорастворимых витаминов и витамин А как представитель жирорастворимых витаминов.
Гормоны. Понятие о гормонах как гуморальных регуляторах жизнедеятельности живых организмов. Инсулин и адреналин как представители гормонов. Профилактика сахарного диабета.
Лекарства. Лекарственная химия : от ятрохимии до химиотерапии. Аспирин. Антибиотики и дисбактериоз. Наркотические вещества. Наркомания, борьба с ней и профилактика.
Демонстрации. Разложение пероксида водорода каталазой сырого мяса и сырого картофеля. Коллекция СМС, содержащих энзимы. Испытание среды СМС индикаторной бумагой. Иллюстрации с фотографиями животных с различными формами авитаминозов. Коллекция витаминных препаратов. Испытание среды раствора аскорбиновой кислоты индикаторной бумагой. Испытание аптечного препарата инсулина на белок. Домашняя, лабораторная и автомобильная аптечка.
Тема 6. «Искусственные и синтетические органические соединения» (3 часа)
Межпредметные связи. Технология: пластмассы, волокна(натуральные, искусственные, синтетические).
Искусственные полимеры. Получение искусственных полимеров, как продуктов химической модификации природного полимерного сырья. Искусственные волокна(ацетатный шелк, вискоза), их свойства и применение.
Синтетические полимеры. Получение синтетических полимеров реакциями полимеризации и поликонденсации. Структура полимеров: линейная, разветвлённая и пространственная. Представители синтетических пластмасс: полиэтилен низкого и высокого давления, полипропилен и поливинилхлорид. Синтетические волокна: лавсан, нитрон и капрон.
Демонстрации. Коллекция пластмасс и изделий из них. Коллекции искусственных и синтетических волокон и изделий из них. Распознавание волокон по отношению к нагреванию и химическим реактивам.
Лабораторные опыты.
Ознакомление с коллекцией пластмасс, волокон и каучуков.
Практическая работа №3. Распознавание пластмасс и волокон.
Перечень учебно-методического обеспечения
Литература для учителя- основная:
Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений.– М.: Дрофа, 2005.
Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия. 10 класс. – М.: Дрофа, 2004.
Габриелян О.С., Берёзкин П.Н., Ушакова А.А. и др. Контрольные и проверочные работы по химии. 10 класс – М.: Дрофа, 2003.
Габриелян О.С., Попкова Т.Н., Карцова А.А. Органическая химия: Методическое пособие. 10 класс. – М.: Просвещение, 2005.
Габриелян О.С., Ватлина Л.П. Химический эксперимент по органической химии. 10 класс. – М.: Дрофа, 2005.
Габриелян О.С., Остроумов И.Г. Химия. 10 кл.: Методическое пособие. – М.: Дрофа,2005.
- дополнительная:
Буцкус П.Ф. Книга для чтения по органической химии – М.: Просвещение, 1985
Габриелян О.С., Остроумов И.Г. Общая химия в тестах, задачах, упражнениях. 11 класс: Учеб. пособие для общеобразоват. учреждений. - М.: Дрофа, 2004.- 304с.
Жиряков В.Г. Органическая химия. – М.: Просвещение, 1983
Лидин Р.А., Якимова Е.Е., Воротникова Н.А. Химия. Методические материалы 10-11 классы. - М.:Дрофа, 2000
Лидин Р.А и др. Химия. 10-11 классы. Дидактические материалы (Решение задач). – М.: Дрофа,2005.
Лидин Р.А., Маргулис В.Б. Химия. 10-11 классы. Дидактические материалы. (Тесты и проверочные задания). – М.: Дрофа, 2005.
Назарова Г.С., Лаврова В.Н. Использование учебного оборудования на практических занятиях по химии. –М., 2000
Органическая химия 10-11кл
Павлова Н. С. Дидактические карточки-задания по химии: 10-й кл.: к учебнику О. С. Габриеляна и др. «Химия 10 кл.».(М.: Экзамен, 2006.)
Радецкий А.М., Горшкова В.П., Кругликова Л.Н. Дидактический материал по химии для 10-11 классов: пособие для учителя. – М.: Просвещение, 2005. – 79 с.
Хомченко И. Г. Сборник задач и упражнений по химии» (для поступающих в вузы) Москва,: Новая волна, 1999.
- основная:
Габриелян О.С., Маскаев Ф.Н., Пономарев С.Ю., Теренин В.И. Химия. 10 класс: учеб. для общеобразоват. учреждений. – М.: Дрофа, 2002.
Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах, упражнениях. 10 класс. – М.: Дрофа, 2004.
Габриелян О.С., Пономарев С.Ю., Карцова А.А. Органическая химия: Задачи и упражнения. 10 класс. – М.: Просвещение, 2005.
Габриелян О.С., Решетов П.В. Остроумов И.Г. Никитюк А.М. Готовимся к единому государственному экзамену. – М.: дрофа, 2003-2004.
Габриелян О.С., Остроумов И.Г. Химия для школьников старших классов и поступающих в вузы: Учеб. Пособие. – М.: Дрофа, 2005.
- дополнительная:
Аликберова Л.Ю., Рукк Н.С.. Полезная химия: задачи и история. – М.: Дрофа, 2006.
Артеменко А.И. Удивительный мир органической химии. – М.: Дрофа, 2005.
Артеменко А.И. Применение органических соединений. – М.: Дрофа, 2005.
Бабков А.Б., Попков В.А.- Общая и неорганическая химия: Пособие для старшеклассников и абитуриентов. М.Просвещение, 2004 – 384 с.
ЕГЭ-2008: Химия: реальные задания: / авт.-сост. Корощенко А.С., Снастина М.Г.- М.: АСТ:Астрель, 2008.-94с. – (Федеральный институт педагогических измерений).
Карцова А.А., Левкин А.Н. Органическая химия: иллюстрированный курс: 10(11) класс: пособие для учащихся. – М.: Просвещение, 2005.
Кузьменко Н.Е., Еремин В.В Начала химии. Учеб. пособие для старшеклассников и поступающих в вузы.. – М.: Дрофа, 2006. – 324 с.
Малышкина В. Занимательная химия. Нескучный учебник. – Санкт-Петербург: Трион, 1998.
Степин Б.Д., АликбероваЛ.Ю.. Занимательные задания и эффективные опыты по химии. – М.: Дрофа, 2005.
Ушкалова В.Н., Иоанидис Н.В. Химия: Конкурсные задания и ответы: Пособие для поступающих в ВУЗы. – М.: Просвещение, 2005.
Хомченко И.Г. «Сборник задач и упражнений по химии» (для поступающих в вузы) Москва,: Новая волна, 1999.
Энциклопедический словарь юного химика (Сост. В.А.Крицман, В.В.Станцо.)-М.:Педагогика , 1990.
Материалы на электронных носителях и ИНТЕРНЕТ – ресурсы
1С:репетитор – химия
Виртуальная школа Кирилла и Мефодия. Уроки химии. 10-11 классы. – М.: ООО «Кирилл и Мефодий», 2004
«Образовательная коллекция. Химия для всех - XXI: Решение задач. Самоучитель»
Химия. Мультимедийное учебное пособие нового образца. – М.: ЗАО Просвещение-МЕДИА, 2005
Электронный учебник для подготовки к ЕГЭ
http://school-collection.edu.ru/
http://www.openclass.ru/dig_resources
http://fcior.edu.ru/
http://www.en.edu.ru
http://www.school.edu.ru
www.vidod.edu.ru
http://www.km.ru
http://ceemat.ru/index.htm
Календарно – тематическое планирование
| №п/п |
Дата | Тема урока | Элементы содержания или основные понятия урока. Демонстрация опыта. |
Планируемые результаты | Темы для проектной работы, сообщений и творческие задания |
Дом. задание | ||||||||||
|
| ||||||||||||||||
| Предметные | Личностные Метапредметные | |||||||||||||||
|
1 |
| Органическая химия – химия соединений углерода. Значение органической химии. | Определение органической химии как науки. Формирование органической химии как науки. Особенности органических веществ, их отличие от неорганических веществ. Группы природных, искусственных и синтетических соединений.
Д. Коллекция органических веществ и изделий из них.
|
Знать определение органической химии, что изучает данная наука. Знать различие между органическими и неорганическими веществами, особенностями строения и свойств орг. веществ. Знать значение орг. химии | Устанавливать связь между целью учебной деятельности и её мотивом, между результатом – продуктом учения, Оценивать поступки, прогнозировать оценки одних и тех же ситуаций с позиций разных людей. Уметь искать и выделять необходимую информацию; Учиться ставить и формулировать проблемы, создавать алгоритмы деятельности при решении проблем; Анализировать вещества неорганической и органической природы с целью выделения признаков (существенных, несущественных); Уметь отстаивать свою точку зрения, аргументировать ее , подтверждать аргументы фактами;
Рассматривать учебную задачу на основе соотнесения того, что уже известно и усвоено и того, что еще неизвестно; |
Творческие задания: 1.Природные органические соединения в быту (медицине, с/х, пищевой и легкой промышленности). 2.Синтетические органические соединения в быту. 3.Искусственные органические соединения в быту. | П.1 упр. 3,4,5* | |||||||||
| 2-3
|
| Основные положения теории химического строения А.М. Бутлерова. Изомерия Значение теории химического строения. Электронная природа химических связей в органических соединениях. | Теория строения органических соединений А.М.Бутлерова. Углеродный скелет. Радикалы. Функциональные группы. Гомологический ряд, гомологи. Структурная изомерия. Значение теории органических соединений.
Д. Модели молекул гомологов и изомеров органических соединений
| Знать предпосылки возникновения теории строения орг. веществ, основные положения теории А.М.Бутлерова и их док-ва. Знать значение теории и основные направления её развития. Иметь представление об изомерии и изомерах как одной из причин многообразия орг. в-в. Уметь записывать структурные формулы орг. в-в (полные и сокращенные), определять изомеры. Знать как образуется ковалентная связь, способы её разрыва. Моделировать строение молекул изучаемых веществ. Обобщать знания и делать выводы о закономерностях изменений свойств органических веществ. Уметь: -иллюстрировать примерами основные положения ТХС; -различать структурные и молекулярные формулы, - определять формулы, соответствующие одному веществу, изомерам, гомологам; -составлять структурные формулы гомологов и изомеров простейших органических соединений. | Осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки.
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для критической оценки достоверности химической информации, поступающей из разных источников.
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели. : В дискуссии уметь выдвинуть контраргументы, перефразировать свою мысль (владеть механизмом эквивалентных замен).
Учиться критично относиться к своему мнению, с достоинством признавать ошибочность своего мнения (если оно таково) и корректировать его.
| Творческие задания: А.М. Бутлеров, История теории химического строения органических веществ | П. 2 до слов «Свойства веществ зависят не только от…», упр. 1,2, 4,6*1,9*,11* | |||||||||
| 4. |
|
Природный газ. Строение алканов. Гомологи и изомеры алканов, номенклатура. |
Углеводороды: алканы. Общая формула, гомологический ряд, строение, номенклатура, изомерия, нахождение в природе, физические и химические свойства. Классификация и номенклатура органических соединений. Гомологический ряд, гомологи. Структурная изомерия. Строение алканов. Номенклатура и изомерия.
Д. Горение метана и отношение его к раствору перманганата калия и бромной воде Л. Изготовление моделей молекул алканов
|
Знать основные компоненты природного газа; Знать важнейшие химические понятия: гомологический ряд, пространственное строение алканов; правила составления названий алканов, уметь называть алканы по международной номенклатуре. определять принадлежность органических веществ к классу алканов. Знать/понимать -химические понятия: углеродный скелет; -важнейшие вещества: метан, его применение; -характеризовать: строение и химические свойства метана и этана -объяснять: зависимость свойств метана и этана от их состава и строения. | Оценивать собственную учебную деятельность: свои достижения, самостоятельность, инициативу, ответственность, причины неудач;
Переводить информацию из одной знаковой системы в другую (из текста в таблицу, из аудиовизуального ряда в текст и др.) Использовать знания химии при соблюдении правил использования бытовых химических препаратов; Уметь анализировать, сравнивать, классифицировать и обобщать факты и явления.
Работать по самостоятельно составленному плану, сверяясь с ним и целью деятельности.
Уметь с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации; Планировать учебное сотрудничество с учителем и сверстниками: определять цели, функций участников, способы взаимодействия; постановку вопросов, осуществлять инициативное сотрудничество в поиске и сборе информации;
|
Опорный конспект (схема) «Классификация химических реакций в органической химии» | П. 3, упр5,7,8*; | |||||||||
|
5. | | Получение, свойства и применение алканов. | Химические свойства основных классов органических соединений. Физические и химические свойства алканов. Реакция замещения. Получение и применение алканов.
Д. Горение метана, отношение его к раствору перманганата калия и бромной воде.
|
Знать и понимать определения понятий: реакции горения, окисления, присоединения (галогенирование, гидратация, галогенирование, гидрогалогенирование), замещения. Уметь: составлять уравнения реакций горения, присоединения, замещения. Знать и понимать определения понятий: применение метана на основе его химических свойств; нахождение метана в природе; правила безопасного обращения с природным или сжиженным газом (пропан-бутановой смесью) в быту. | Выстраивать последовательность необходимых операций (алгоритм действий); Корректировать деятельность: вносить изменения в процесс с учетом возникших трудностей и ошибок; намечать способы их устранения; Определять существенные характеристики изучаемого объекта; Проводить самостоятельный выбор критериев для сравнения, сопоставления, оценки и классификации объектов. Анализировать объекты с целью выделения признаков (существенных и несущественных); Устанавливать различие между органическими и неорганическими веществами, особенностями строения и свойств орг. веществ. Выбирать решение из нескольких предложенных, кратко обосновывать выбор В дискуссии уметь выдвинуть контраргументы, перефразировать свою мысль .
|
Опорный конспект по теме. Творческие задания: Способы получения метана, Правила безопасного использования природного газа
| П.3 упр. 9,10,11* | |||||||||
|
6. |
|
Строение алкенов. Гомологи и изомеры алкенов, номенклатура. |
Гомологический ряд алкенов: строение, номенклатура, изомерия, физические свойства. Д: шаростержне вая и масштабная модель этилена; получение этилена из этанола; обесцвечива ние бромной (йодной) воды и раствора перманганата калия; горение; изделия, изготовленные из полиэтилена. Электронный учебник ЛР2. Изготовление моделей молекул алкенов.
|
Осуществлять сравнение алканов и алкенов, самостоятельно выбирая основания и критерии для указанных логических операций; строить классификацию на основе отрицания. Создавать схематические модели с выделением существенных характеристик объекта. Знать и понимать определения понятий: алкены, реакция дегидратации, реакция полимеризации, мономер, полимер, структурное звено, степень полимеризации; общую формулу алкенов; качественные реакции на кратную связь. Уметь определять вероятность принадлежности веществ к классу алкенов по молекулярной формуле; характеризовать особенности строения алкенов; называть алкены; различать изомерные алкены; составлять структурные формулы изомерных алкенов;
| Осознавать свои интересы, находить и изучать в учебниках по разным предметам материал (из максимума), имеющий отношение к своим интересам. Использовать свои интересы для выбора индивидуальной образовательной траектории, потенциальной будущей профессии и соответствующего профильного образования.
Анализировать, сравнивать, классифицировать и обобщать факты и явления. Самостоятельно обнаруживать и формулировать проблему в классной и индивидуальной учебной деятельности.
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели. Уметь взглянуть на ситуацию с иной позиции и договариваться с людьми иных позиций.
|
Творческие задания по теме «Алкены». Опорный конспект. | П. 4, упр. 2-4, 6* | |||||||||
|
7. | | Получение, свойства и применение алкенов. |
Химические свойства: реакция окисления, присоединения. Полимеризации. Применение алкенов и их производных.
Д. Получение этилена, горение, отношение к бромной воде и раствору перманганата калия.
Коллекция «Изделия из полиэтилена»
|
Знать определение непредельных ряда этилена, общую формулу. Уметь объяснять образование σ- и π-связей, их особенности, записывать молекулярные, структурные, электронные формулы, обозначать распределение электронной плотности в молекуле. Уметь называть вещества ряда этилена по систематической номенклатуре и по названию записывать формулы. Знать четыре вида изомерии для этиленовых, уметь составлять формулы различных изомеров, называть их. Знать физические и химические свойства алкенов. Уметь записывать уравнения реакций, доказывающих химические свойства алкенов. Знать практическое применение, способы получения..
| Приводить примеры химических процессов в природе; Находить черты, свидетельствующие об общих признаках химических процессов и их различиях. Делать предварительный отбор источников информации для поиска нового знания, добывать новые знания (информацию) из различных источников и разными способами. Анализировать собственную работу: соотносить план и совершенные операции, выделять этапы и оценивать меру освоения каждого этапа; Находить ошибки, устанавливать их причины; Уметь с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации; Искать свою позицию в многообразии общественных и мировоззренческих позиций, эстетических и культурных предпочтений.
|
| П. 4, упр. 6* | |||||||||
|
8. |
|
Алкадиены. |
Алкадиены, их строение, номенклатура, изомерия, свойства. Получение диенов Исследования С. В. Лебедева. Химические свойства. Натуральный и синтетический каучук. Резина. Каучуковая промышленность.
Д. Разложение каучука при нагревании, испытание продукта разложения на непредельность.
ЛР3. Ознакомление с образцами каучуков. обесцвечивание бромной (йодной) воды и раствора перманганата калия раствором каучука в бензине. Коллекция «Каучук» и «Резина», изделия из мягкой резины и эбонитовая палочка. |
Знать и понимать определения понятий: алкадиены, резина, вулканизация, мономер, реакция дегидрирования; полимер; реакция полимеризации; степень полимеризации; структурное звено; общую формулу алкадиенов; свойства и применение натурального и синтетического каучуков, резины. Уметь определять возможность принадлежности веществ к классу алкадиенов по молекулярной формуле; характеризовать особенности строения алкадиенов; называть алкадиены; составлять структурные формулы изомерных алкадиенов. | Оценивать поступки, прогнозировать оценки одних и тех же ситуаций с позиций разных людей; Учиться замечать и признавать расхождения своих поступков со своими заявленными позициями, взглядами, мнениями; Проводить самостоятельный поиск информации с использованием различных источников; Сопоставлять сравниваемые объекты по одним и тем же выделенным признакам. Самостоятельно осознавать причины своего успеха или неуспеха и находить способы выхода из ситуации неуспеха. |
Натуральный каучук. Получение и применение резины. Утилизация резиновых отходов. | П. 5, упр. 2,3,4* | |||||||||
| 9. |
| Практическая работа «Получение этилена и опыты с ним». |
| Знать лабораторный способ получения этилена, правила по ТБ. Уметь практически получать этилен и доказывать его свойства (непредельность) характерными реакциями. Уметь проводить наблюдения, делать выводы. |
|
|
| |||||||||
|
10. | | Ацетилен и его гомологи. |
Гомологический ряд алкинов: строение, номенклатура, изомерия, физические свойства. Получение алкинов. Химические свойства. Применение алкинов и их производных.
Д. Получение и свойства ацетилена. ЛР4. Изготовление модели молекулы ацетилена.
Д.взаимодействие с бромной (йодной) водой и раствором перманганата калия; горение ацетилена; образцы изделий из поливинилхлорида. |
Знать и понимать определения понятий: алкины, общую формулу алкинов; области применение ацетилена на основе его химических свойств; свойства и применение поливинилхлорида. Уметь определять возможность принадлежности веществ к классу алкинов по молекулярной формуле; характеризовать особенности строения алкинов; называть алкины; различать изомеры; характеризовать химические свойства ацетилена; составлять уравнения реакций, характеризующих генетическую связь между классами углеводородов. | Оценивать собственную учебную деятельность: свои достижения, самостоятельность, инициативу, ответственность, причины неудач; Применять правила делового сотрудничества: сравнивать разные точки зрения; считаться с мнением другого человека; Понимать роль химических процессов, протекающих в природе; Уметь проводить простейшие химические эксперименты. Применять химические знания для организации и планирования собственного здорового образа жизни и деятельности, Способность принимать, сохранять цели и следовать им в учебной деятельности; Уметь контролировать процесс и результаты своей деятельности, Самостоятельно организовывать учебное взаимодействие в группе (определять общие цели, распределять роли, и т.д). |
Применение реакции горения ацетилена. Применение поливинилхлорида на основе его свойств. | П.6, упр. 2,4,6*. | |||||||||
|
11. | | Бензол – представитель ароматических углеводородов. Строение, получение, свойства, применение. |
Строение аренов. Номенклатура, изомерия, физические свойства бензола и его гомологов. Получение аренов. Химические свойства. Применение бензола и его гомологов.
Д. Отношение бензола к раствору перманганата калия и бромной воде.
|
Знать особенности применения аренов; области применения бензола на основе его свойств; правила безопасного обращения со средствами бытовой химии, содержащих бензол. Уметь характеризовать химические свойства бензола; -выделять главное при рассмотрении бензола в сравнении с алканами и непредельными углеводородами
| Постепенно вырабатывать свои собственные ответы на основные жизненные вопросы, которые ставит личный жизненный опыт;
Учиться признавать противоречивость и незавершённость своих взглядов на мир, возможность их изменения.
Различать методы познания окружающего мира по его целям(наблюдение, опыт, эксперимент, моделирование, вычисление); Изучать особенности (качества, признаки) разных объектов в процессе их рассматривания (наблюдения); Анализировать результаты опытов, элементарных исследований; фиксировать их результаты; Уметь с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации;
|
Ядохимикаты и правила безопасного обращения с ним. | П. 7, упр. 2,4. | |||||||||
|
12. | | Нефть и способы ее переработки. |
Нефть, её физические свойства, способы разделения её на составляющие, нефтяные фракции, термический и каталитический крекинг.
Д. Коллекция «Нефть и продукты ее переработки». ЛР5. Обнаружение непредельных соединений в жидких нефтепродуктах.
Д. Растворение парафина в бензине и испарение растворителя из раствора; Плавление парафина и его отношение к воде.
| Знать и понимать определения понятий: природные источники углеводородов, природный газ, попутный нефтяной газ, нефть, фракционная перегонка, ректификация, крекинг, детонационная устойчивость, октановое число, риформинг; состав и применение продуктов фракционной перегонки нефти; физические свойства нефти; условия безопасного обращения с нефтепродуктами. Уметь составлять уравнения реакций крекинга; - проводить поиск химической информации с использованием различных источников. Оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья; Давать оценку влияния химического загрязнения окружающей среды на организм человека и другие живые организмы; | Владеть поиском нужной информации по заданной теме в источниках различного типа. Уметь использовать приобретенные знания и умения в практической деятельности и повседневной жизни для объяснения химических явлений, происходящих в природе, быту и на производстве; Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели. Определять цели, функции участников группы, способы взаимодействия; Уметь разрешать конфликты, выявлять, идентифицировать проблемы, вести поиск и давать оценку альтернативным способам разрешения конфликта, | Состав нефти и ее физические свойства. Происхождение нефти. Открытие нефти и газа в Тюменской области. Экологические аспекты добычи и транспортировки нефти. Правила безопасного обращения с нефтепродуктами. Правила безопасного обращения с природным газом
По желанию – мини-проекты | П. 3 и 8, упр. 4,5,6*,7* | |||||||||
| 13 |
|
Контрольная работа по теме «Углеводороды и их природные источники» |
Классификация и номенклатура органических соединений. Химические свойства основных классов органических соединений. Углеводороды: алканы, алкены, алкины, арены |
Знать: - важнейшие реакции метана, этана, этилена, ацетилена, бутадиена, бензола; - основные способы их получения и применения. Уметь: - определять принадлежность углеводородов к определенному классу; -называть изучаемые в-ва по тривиальной номенклатуре и номенклатуре ИЮПАК; -составлять структурные формулы углеводородов, их изомеров и гомологов; -составлять уравнения реакций, характеризующих генетическую связь углеводородов. | Оценивать собственную учебную деятельность: свои достижения, самостоятельность, инициативу, ответственность, причины неудач; Делать выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; Уметь развернуто обосновывать суждения, давать определения, приводить доказательства
Уметь адекватно воспринимать оценки и отметки; Уметь различать объективную трудность задачи и субъективную сложность; |
|
| |||||||||
|
14. |
|
Единство химической организации живых организмов. Строение молекул, изомерия, номенклатура спиртов. | Спирты, их строение, классификация, номенклатура, изомерия (положение гидроксильных групп, межклассовая, углеродного скелета), физические св-ва. Межмолекулярная водородная связь. Отдельные представители спиртов и их значение. Действие спиртов на организм человека. Глицерин как представитель многоатомных спиртов. |
Знать и понимать определения понятий: функциональная группа, предельные одноатомные спирты, водородная связь, многоатомные спирты, физические свойства метанола, этанола и глицерина; области применения глицерина на основе его свойств; области применения этанола на основе его свойств. Уметь: характеризовать особенности строения предельных одноатомных спиртов; называть спирты; различать изомеры. | Использовать свои интересы для выбора индивидуальной образовательной траектории, потенциальной будущей профессии и соответствующего профильного образования. Формировать умение воспринимать, перерабатывать предъявлять информацию в словесной, образной, символической формах, Корректировать свою деятельность: вносить изменения в процесс с учетом возникших трудностей и ошибок; намечать способы их устранения; | Способы получения этилового спирта. Алкоголизм: медицинский и социальный аспекты.
| П. 9, упр. 1,3, 5-8*, 11*, 13* | |||||||||
|
15. |
|
Химические свойства спиртов и их применение. | Химические свойства этанола. Внутримолекулярная дегидратация Качественная реакция на многоатомные спирты. Применение этанола и глицерина на основе их свойств Алкоголизм, его последствия и предупреждение.
Д. Окисление этанола в альдегид. ЛР6. Свойства этилового спирта. ЛР7. Свойства глицерина.
|
Знать и понимать определения понятий: реакция дегидратации; Уметь: характеризовать химические свойства, объяснять зависимость свойств спиртов от их состава и строения; выполнять химический эксперимент по распознаванию многотомных спиртов. и применение этанола; составлять уравнения реакций, характеризующих генетическую связь между органическими соединениями. Планировать решение учебной задачи: выстраивать последовательность необходимых операций (алгоритм действий);
| Формировать экологическое мышление: умение оценивать свою деятельность и поступки других людей с точки зрения сохранения окружающей среды.
Обобщать понятия – осуществлять логическую операцию перехода от понятия с меньшим объёмом к понятию с большим объёмом. Преобразовывать информацию из одного вида в другой и выбирать удобную для себя форму фиксации и представления информации. Самостоятельно осознавать причины своего успеха или неуспеха и находить способы выхода из ситуации неуспеха. Уметь с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации; Планировать учебное сотрудничество с учителем и сверстниками.
|
Метанол. Этанол. Глицерин. | П. 9, упр. 5,6,7*,8* | |||||||||
|
16. | | Фенолы. Свойства фенола и его применение. | Строение молекулы фенола. Причина, обуславливающая характерные св-ва молекулы фенола. Физические и химические св-ва. Получение и применение. Качественная реакция на фенол. Химическое загрязнение окружающей среды и его последствия.
.Д. Коллекция «Каменный уголь и продукты его переработки»; Д. Качественные реакции на фенол. Взаимодействие с раствором щелочи и бромной водой; Качественная реакция с хлоридом. Д: масштабная модель; физические свойства;
Электронный учебник
|
Знать и понимать определения понятий: фенолы, реакция поликонденсации; особенности строения фенолов; химические свойства фенола; свойства и применение некоторых органических соединений (эпоксидных смол, фенолформальдегидных смол, поликарбонатов) в быту и промышленности. Уметь иллюстрировать положение ТХС органических соединений о взаимном влиянии атомов в молекулах на примере фенола. Знать особенности строения молекулы фенола и на основе этого уметь предсказывать его свойства. Знать основные способы получения и применения фенола; использовать приобретенные знания и умения для безопасного обращения с фенолом и для оценки влияния фенола на организм человека и другие живые организмы. | Свободно пользоваться выработанными критериями оценки и самооценки, исходя из цели и имеющихся критериев, различая результат и способы действий. Планировать свою индивидуальную образовательную траекторию.
Применять методы информационного поиска, в том числе с помощью компьютерных средств; знаково-символические действия, включая моделирование; Осуществлять выбор наиболее эффективных способов решения задач в зависимости от конкретных условий. Оценивать весомость приводимых доказательств и рассуждений. Корректировать деятельность: вносить изменения в процесс с учетом возникших трудностей и ошибок; намечать способы их устранения;
|
| П. 9, упр. 5,6,7*,8* | |||||||||
|
17. |
|
Карбонильные соединения – альдегиды и кетоны. Свойства и применение альдегидов. | Строение, номенклатура, изомерия, физические свойства альдегидов. Способы получения. Реакция Кучерова Отдельные представители альдегидов и их значение. Химические свойства альдегидов. Д. Реакция «серебряного зеркала»; Д. Окисление альдегидов с помощью гидроксида меди (П). | Знать и понимать определения понятий: альдегиды, реакция поликонденсации; качественные реакции на альдегиды. Уметь характеризовать особенности химического строения альдегидов; -называть альдегиды; различать изомеры и гомологи; -составлять уравнения реакций, характеризующих генетическую связь между органическими соединениями. Знать гомологические ряды и основы номенклатуры альдегидов; знать строение карбонильной группы и на этой основе усвоить отличие и сходство альдегидов и кетонов. Знать свойства основных представителей этих классов, их значение в природе и жизни | Осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки.
Преобразовывать информацию из одного вида в другой и выбирать удобную для себя форму фиксации и представления информации.
Представлять информацию в оптимальной форме в зависимости от адресата.
3 Осуществлять логическую операцию установления родо-видовых отношений;
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели. Планировать свою индивидуальную образовательную траекторию.
Учиться критично относиться к своему мнению, с достоинством признавать ошибочность своего мнения (если оно таково) и корректировать его.
|
Состав и применение ацетона. Применение формальдегида. Применение уксусного альдегида. | П. 11, упр. 3,4,6*. | |||||||||
|
18. |
|
Карбоновые кислоты. Получение, свойства и применение одноосновных предельных карбоновых кислот. | Строение, номенклатура, изомерия, физические свойства карбоновых кислот. Карбоновые кислоты в природе. Получение карбоновых кислот. Химические свойства карбоновых кислот. Отдельные представители и их значение. ЛР8. Свойства уксусной кислоты. Д: Получение сложного эфира. Л. Свойства уксусной кислоты | Знать и понимать определения понятий: карбоновые кислоты, предельные одноосновные карбоновые кислоты, реакция этерификации; физические свойства муравьиной и уксусной кислот; правила безопасного обращения с веществами (уксусной эссенцией). Уметь характеризовать особенности строения карбоновых кислот; называть карбоновые кислоты; различать изомеры. Знать гомологические ряды и основы номенклатуры карбоновых кислот; знать строение карбоксильной группы. Знать общие свойства карбоновых кислот, уметь проводить сравнение со свойствами минеральных кислот, их значение в природе и повседневной жизни человека; выполнять химический эксперимент по распознаванию карбоновых кислот.
| Свободно пользоваться выработанными критериями оценки и самооценки, исходя из цели и имеющихся критериев, различая результат и способы действий.
Уметь использовать компьютерные и коммуникационные технологии как инструмент для достижения своих целей. Уметь выбирать адекватные задаче инструментальные программно-аппаратные средства и сервисы.
Уметь становить и формулировать проблемы, самостоятельное создавать алгоритмы деятельности при решении проблем творческого и поискового характера.
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели. Уметь разрешать конфликты- выявлять, идентифицировать проблемы, осуществлять поиск и оценку альтернативных способов разрешения конфликта,
|
Карбоновые кислоты в природе. Безопасное обращение с муравьиной и уксусной кислотами в быту. Применение уксусной кислоты. Применение муравьиной кислоты. | П. 12; упр. 1,3* | |||||||||
|
19. | | Генетическая связь спиртов, фенолов, альдегидов и карбоновых кислот с другими классами органических соединений. | Генетическая связь спиртов, фенолов, альдегидов и карбоновых кислот с другими классами органических соединений. |
Уметь определять: принадлежность веществ к различным классам органических соединений; уметь составлять уравнения реакций, решать задачи
| Осознавать свои интересы, находить и изучать в учебниках по разным предметам материал (из максимума), имеющий отношение к своим интересам.
Выбирать наиболее эффективные способов решения задач в зависимости от конкретных условий;
Преобразовывать объекты из одной формы в пространственно-графическую или знаково-символическую модель, где выделены существенные характеристики объекта, и преобразовывать модели с целью выявления общих законов, определяющих данную предметную область;
Отстаивая свою точку зрения, приводить аргументы, подтверждая их фактами. В дискуссии уметь выдвинуть контраргументы, перефразировать свою мысль (владение механизмом эквивалентных замен).
|
| Индив. задания | |||||||||
|
20. |
|
Сложные эфиры. Жиры. | Строение сложных эфиров. Сложные эфиры в природе и технике. Состав, классификация, свойства, применение и получение жиров. Понятие о мылах.
Д: отношение к воде и орг. растворителям Растворимость жиров в органических и неорганических растворителях Л: свойства эфиров; Сравнение моющих свойств р-ра мыла и стирального порошка. |
Знать и понимать определения понятий: реакция этерификации, сложные эфиры, жиры, масла, мыла, гидролиз; общие формулы сложных эфиров и жиров; способ получения сложных эфиров. Уметь: определять принадлежность веществ к классу сложных эфиров и жиров; характеризовать химические свойства жиров (гидролиз и гидрирование); объяснять моющее действие мыла. Знать строение, получение, свойства и использование в быту сложных эфиров и жиров. | Использовать свои интересы для выбора индивидуальной образовательной траектории, Осуществлять поиск необходимой информации для выполнения учебных заданий; Использовать знаково-символические средства, в том числе модели и схемы для решения учебных задач; Применять химические знания для организации и планирования собственного здорового образа жизни и деятельности. Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели. | Сложные эфиры в природе. Применение сложных эфиров. | П. 13, упр. 1,2,3,4-7* | |||||||||
|
21. | | Углеводы. Глюкоза. | Единство химической организации живых организмов. Углеводы, их классификация. Глюкоза и фруктоза – важнейшие представители моносахаридов. Строение молекулы глюкозы. Химические свойства глюкозы. ЛР10. Свойства глюкозы, реакция «серебряного зеркала»; реакция с гидроксидом меди (11) без нагревания и при нагревании. | Осуществлять сравнение и классификацию, самостоятельно выбирая основания и критерии для указанных логических операций; Работая по предложенному и самостоятельно составленному плану, использовать наряду с основными и дополнительные средства (справочная литература, сложные приборы, компьютер). Уметь с достаточной полнотой и точностью выражать свои мысли. | Знать и понимать определения понятий: углеводы, моносахариды, гидролиз; классификация углеводов; названия и молекулярные формулы глюкозы, фруктозы; физические свойства и биологическое значение глюкозы; нахождение в природе и биологическое значение моносахаридов; области применения глюкозы на основе ее свойств; качественные реакции на глюкозу. |
Углеводы в природе. Их значение в жизни человека. Рибоза и дезоксирибоза. Фруктоза: нахождение в природе, физические свойства и применение. | П. 14. Упр. 1-3,4-6* | |||||||||
|
22. | | Крахмал и целлюлоза. | Полисахариды: крахмал и целлюлоза. Сахароза – важнейший дисахарид. Реакции поликонденсации. Значение углеводов в живой природе и жизни человека.
Д: качественная реакция на крахмал Л: свойства крахмала | Знать и понимать определения понятий: углеводы, полисахариды состав, особенности строения, физические свойства, нахождение в природе, биологическое значение и применение сахарозы и полисахаридов (крахмала и целлюлозы); качественную реакцию на крахмал. Уметь: характеризовать химические свойства и применение крахмала и целлюлозы. Объяснять явления, происходящие в быту, пользуясь приобретенными знаниями. Знать важнейшие свойства крахмала и целлюлозы на основании различий в строении. Пользуясь приобретенными знаниями, объяснять явления, происходящие в быту. Знать значение углеводов в природе и жизни человека. | Оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья; Оценивать экологический риск взаимоотношений человека и природы. Преобразовывать информацию из одного вида в другой и выбирать удобную для себя форму фиксации и представления информации. Представлять информацию в оптимальной форме в зависимости от адресата. Анализировать, сравнивать, классифицировать и обобщать факты и явления. Выявлять причины и следствия простых явлений. Самостоятельно ставить перед собой учебные цели (выдвигать содержательные гипотезы, умеет исследовать способы действия). Корректировать деятельность: вносить изменения в процесс с учетом возникших трудностей и ошибок; намечать способы их устранения; Уметь организовать общение, включающее умение слушать собеседника, уметь сопереживать, решать конфликтные ситуации, работать в группе.
|
| П. 15, упр. 1,2 | |||||||||
| 23 | | Систематизация и обобщение знаний по теме | Кислородсодержащие соединения: одно- и многоатомные спирты, фенол, альдегиды, одноосновные карбоновые кислоты, сложные эфиры, жиры, углеводы. | Знать важнейшие реакции спиртов, фенола, альдегидов, карбоновых кислот, глюкозы. Знать основные способы их получения и области их применения. Определять возможности протекания хим. превращений. | Мотивировать свои действия; выражать готовность в любой ситуации поступить в соответствии с правилами поведения. Понимать роль химических процессов, протекающих в природе; Приобретать опыт самостоятельного поиска, анализа и отбора информации с использованием различных источников и новых информационных технологий для решения познавательных задач. |
| Инд.тест | |||||||||
|
24 | | Контрольная работа по теме «Кислородсодержащие органические соединения и их нахождение в живой природе» | Кислородсодержащие соединения: одно- и многоатомные спирты, фенол, альдегиды, одноосновные карбоновые кислоты, сложные эфиры, жиры, углеводы. | Решение разноуровневых тестов, составленных по типу ЕГЭ. Уметь определять: принадлежность веществ к различным классам кислородсодержащих органических соединений; характеризовать: общие химические свойства различных классов кислородсодержащих веществ. | Оценивать собственную учебную деятельность: свои достижения, самостоятельность, инициативу, ответственность, причины неудач; Проводить рефлексию способов и условий действия, контроль и оценку процесса и результатов деятельности; Делать выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; |
| Индив. задания | |||||||||
|
25. | | Амины. Анилин как органическое основание. | Амины, их классификация и значение. Строение молекулы аминов. Физические и химические свойства
Д. Реакция анилина с бромной водой и соляной кислотой. Д: модели метиламина и анилина; Физические свойства метиламина и анилина: агрегатное состояние, цвет, запах, отношение к воде; взаимодействие с кислотами; Отношение к бромной воде. | Знать и понимать определения понятий: амины, аминогруппа. Уметь: характеризовать особенности строения первичных аминов; называть первичные амины; характеризовать химические свойства аминов; объяснять положение ТХС о взаимном влиянии атомов и групп атомов в молекулах веществ на примере анилина; составлять уравнения реакций, характеризующих генетическую связь между органическими соединениями. Знать классификацию, виды изомерии аминов и номенклатуру. Уметь проводить сравнение свойств аминов и аммиака. Знать основные способы получения аминов и их применение; определять принадлежность веществ к классу аминов. | Вырабатывать в противоречивых конфликтных ситуациях правила поведения, способствующие ненасильственному и равноправному преодолению конфликта. Строить логическое рассуждение, включающее установление причинно-следственных связей. Уметь искать и выделять необходимую информацию; применять методы информационного поиска, в том числе с помощью компьютерных средств. Планировать решение учебной задачи: выстраивать последовательность необходимых операций (алгоритм действий); Оценивать весомость приводимых доказательств и рассуждений. Уметь планировать учебное сотрудничество с учителем и сверстниками, определять цели, функций участников, способы взаимодействия; осуществлять инициативное сотрудничество в поиске и сборе информации.
|
Применение анилина. Н.Н. Зинин | П. 16, упр. 1-2, 3-5* | |||||||||
|
26. | | Аминокислоты. | Строение, номенклатура, изомерия, классификация аминокислот, физические свойства и свойства, обусловленные химической двойственностью. Взаимодействие Д:модели аминоуксусной и аминопропионовой; глицин;упаковки от продуктов питания, содержащие АК (Е620-глутаминовая, Е 621 – глутамат натрия, Е 622-525 глутаматы металлов, Е 640 – глицин, Е641-лейцитин);нейтрализация щелочи АК | Знать и понимать определения понятий: аминогруппа, аминокислоты, амфотерные соединения, реакции поликонденсации, пептидная связь, мономер, полимер, структурное звено, степень полимеризации; Применение и биологическую роль аминокислот. Уметь характеризовать особенности строения аминокислот; характеризовать химические свойства аминокислот. Знать классификацию, виды изомерии аминокислот и основы их номенклатуры; уметь предсказывать их химические свойства. Уметь объяснять применение и биологическую роль аминокислот; определять принадлежность веществ к классу аминокислот. | Использовать свои интересы для выбора индивидуальной образовательной траектории, потенциальной будущей профессии и соответствующего профильного образования.
Уметь осуществлять выбор наиболее эффективных способов решения образовательных задач в зависимости от конкретных условий. Уметь представлять информацию в виде таблиц, схем, опорного конспекта, в том числе с помощью ИКТ.
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели.
Отстаивая свою точку зрения, приводить аргументы, подтверждая их фактами.
| Аминокислоты в продуктах питания. | упр. 1-2,3-5* | |||||||||
|
27. | | Белки. | Понятие о белках: их строении, химических и биологических свойствах. Пептидная связь и полипептиды. Первичная, вторичная и третичная структуры белков.
Д: денатурация белка.
Д. Горение птичьего пера и шерстяной нити.
ЛР12. Свойства белков.
|
Знать и понимать определения понятий: белки, денатурация, гидролиз, реакции поликонденсации, мономер, полимер, структурное звено, пептидная связь, водородная связь, ферменты; качественные реакции на белки. Уметь характеризовать первичную, вторичную и третичную структуру белков, химические свойства и применение белков (гидролиз и денатурация). Знать строение и важнейшие свойства белков; уметь давать характеристику белкам как важнейшим составным частям пищи. Уметь практически осуществлять цветные реакции на белки.
| Осознавать потребность и готовность к самообразованию, в том числе и в рамках самостоятельной деятельности вне школы;
Уметь использовать компьютерные и коммуникационные технологии как инструмент для достижения своих целей. Уметь выбирать адекватные задаче инструментальные программно-аппаратные средства и сервисы. Свободно пользоваться выработанными критериями оценки и самооценки, исходя из цели и имеющихся критериев, различая результат и способы действий. Уметь обосновывать и доказывать собственное мнение, согласовывать усилия по достижению общей цели, ориентироваться на партнера по деятельности;
|
Функции белков. Изучение строения белков. Белок как компонент пищи. Использование денатурации в пищевой промышленности и биотехнологии. | 17 до конца, упр. 6-9 | |||||||||
|
28. | | Генетическая связь между классами органических соединений. | Составление уравнений химических реакций к схемам превращений, отражающих генетическую связь между классами органических веществ. |
Уметь определять: принадлежность веществ к различным классам органических соединений; характеризовать: общие химические свойства органических соединений; уметь использовать приобретенные знания.
| Уметь представлять информацию в виде таблиц, схем, опорного конспекта, в том числе с помощью ИКТ. Анализировать, сравнивать, классифицировать и обобщать понятия, давать определение понятиям на основе изученного на различных предметах учебного материала.
Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели.
| Д. Превращения: этанол → этилен → этиленгликоль → этиленгликолят меди (П); этанол → этаналь → этановая кислота. | Индив. задания | |||||||||
|
29. |
|
Практическая работа «Решение экспериментальных задач на идентификацию органических соединений» | Правила безопасности при работе с едкими, горючими и токсичными веществами. Проведение химических реакций в растворах. Проведение химических реакций при нагревании. Качественные реакции на отдельные классы органических соединений. | Проводить химические опыты и эксперименты и объяснять их результаты. Использовать знания химии при соблюдении правил использования бытовых химических препаратов; Составлять план выполнения химического эксперимента. Знать основные правила ТБ при работе в химическом кабинете. Уметь грамотно обращаться с химической посудой и лабораторным оборудованием. Знать качественные реакции на важнейших представителей органических соединений; уметь выполнять химический эксперимент по распознаванию важнейших ОВ. | Учиться самостоятельно выбирать стиль поведения, привычки, обеспечивающие безопасный образ жизни и сохранение здоровья – своего, а также близких людей и окружающих. Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели.
|
ПР | Отчет, тест | |||||||||
|
30.
31.
32. | | Ферменты. Витамины, гормоны, лекарства. Искусственные и синтетические полимеры. Контрольная работа (годовая) | Ферменты – биологические катализаторы белковой природы. Особенности функционирования ферментов. Роль ферментов в жизнедеятельности живых организмов и народном хозяйстве. Химия и здоровье. Лекарства, ферменты, витамины, гормоны, минеральные воды. Классификация ВМС. Важнейшие представители пластмасс, каучуков и волокон. Д. Разложение пероксида водорода каталазой сырого мяса, картофеля.
Д. Испытание среды раствора аскорбиновой кислоты индикаторной бумагой. ЛР13. Ознакомление с коллекцией пластмасс, волокон и каучуков. | . Знать и понимать определения понятий: -ферменты, энзимы, водородный показатель; особенности действия ферментов по сравнению с неорганическими катализаторами; области применения ферментов в быту и промышленности. витамины, авитаминоз, гиповитаминоз, гипервитаминоз; значение витаминов для жизнедеятельности организма; источники поступления витаминов в организм человека; правила обращения с витаминными препаратами. Уметь использовать полученные знания для безопасного применения лекарственных веществ. Уметь использовать приобретенные знания и умения в практической деятельности и повседневной жизни. Знать и понимать определения понятий: гуморальная регуляция, гормоны; свойства гормонов; физиологическое действие некоторых гормонов (инсулин, адреналин); меры профилактики сахарного диабета. Лекарственные средства, антибиотики, антисептики, анальгетики; применение лекарственных средств, находящихся в автомобильной аптечке; правила безопасного обращения с лекарственными средствами. Уметь применять химические знания для решения повседневных вопросов. | Уметь отделять основную информацию от второстепенной, оценивать достоверность полученной информации, передавать информацию адекватно поставленной цели. Уметь использовать полученные знания для безопасного применения лекарственных веществ. Работать по самостоятельно составленному плану, сверяясь с ним и целью деятельности, исправляя ошибки, используя самостоятельно подобранные средства (в том числе и Интернет). Уметь свободно пользоваться выработанными критериями оценки и самооценки, исходя из цели и имеющихся критериев, различая результат и способы действий. Планировать учебное сотрудничество с учителем и сверстниками, определять цели, функции участников, способы взаимодействия; |
Проблемы, связанные с применением лекарственных препаратов. Применение ферментов в быту. Применение ферментов в промышленности. Механизм действия ферментов. История изучения витаминов. Водорастворимые витамины. Жирорастворимые витамины. Витаминные препараты и правила их приема. | П. 19, упр. 1-4; п. 20. «Витамины», упр. 1-5 (по выбору) | |||||||||
|
33. |
|
Практическая работа Распознавание пластмасс и волокон. | Правила безопасности при работе с едкими, горючими и токсичными веществами. Проведение химических реакций в растворах. Проведение химических реакций при нагревании. Полимеры: пластмассы, каучуки, волокна. Распознавание пластмасс и волокон. | Знать основные правила ТБ при работе в химическом кабинете. Уметь грамотно обращаться с химической посудой и лабораторным оборудованием. Знать важнейшие вещества и материалы: искусственные и синтетические волокна, каучуки, пластмассы; уметь выполнять химический эксперимент по распознаванию важнейших органических веществ; Уметь грамотно обращаться с химической посудой и лабораторным оборудованием. Уметь выполнять химический эксперимент по распознаванию важнейших органических веществ и грамотно объяснять происходящие химические процессы.
| Учиться самостоятельно выбирать стиль поведения, привычки, обеспечивающие безопасный образ жизни и сохранение здоровья – своего, а также близких людей и окружающих. Уметь самостоятельно и мотивированно организовать свою познавательную деятельность (от постановки цели до получения результатов), организовывать и проводить учебно-исследовательскую работу. Выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели. Самостоятельно организовывать учебное взаимодействие в группе (определять общие цели, распределять роли, договариваться друг с другом и т.д.). |
ПР | Отчет, тест | |||||||||
|
34. |
| Систематизация и обобщение знаний по курсу органической химии | Химические свойства основных классов органических соединений. | Итоговое занятие. |
|
| ||||||||||
Дидактический материал: Вводный контроль. Стартовая самостоятельная работа за курс 9 класса «Органическая химия». Вариант №1
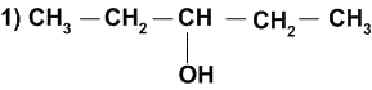
Выпишите формулы изомеров из предложенных ниже веществ:
а) СН3 – СН = СН – СН3, б) СН3 – СН = СН – СН2 – СН3
в) СН2 =СН - СН2 – СН3, г) СН2 = СН
|
СН2 – СН3.
С какими из перечисленных ниже веществ может взаимодействовать этиловый спирт: СаСО3, КОН,СН3СООН,Nа? Составьте уравнения возможных реакций.
Какие из веществ, формулы которых приведены ниже, относятся к органическим кислотам: СН3ОН, С3Н6, СН3СООН, С2Н4, С17Н35СООН, НСООСН3, СН3СОН, С2Н5ОН. По какому признаку вы выбрали эти вещества? Дайте им названия.
Сколько граммов метилового спирта вступило в реакцию с металлическим натрием, если при этом образовалось 8 граммов водорода?
( ответ: 256г.)
Выпишите формулы изомеров из предложенных ниже веществ:
а) СН3 – СН2 – СН2 – СН3, б) СН3 – СН2
|
СН2 – СН3
в) СН3 – СН2 - СН2 г) СН3 – СН – СН3
| |
СН3, СН3.
С какими из перечисленных ниже веществ может взаимодействовать уксусная кислота: Nа2СО3, КОН ,Сu, Мg, Н2О? Составьте уравнения возможных реакций.
Какие из веществ, формулы которых приведены ниже, относятся к спиртам: СН3ОН, С3Н6, СН3СООН, С2Н4, С17Н35СООН, НСООСН3, СН3СОН, С2Н5ОН. По какому признаку вы выбрали эти вещества? Дайте им названия.
Сколько граммов метилового спирта сгорело, если при этом образовался оксид углерода (IV) массой 110г и вода? ( ответ 80 г)
Контроль уровня обучения.
Контрольная работа № 1 по теме № 2 «Углеводороды и их природные источники»
Вариант 1
1. Дополните фразу: Для предельных углеводородов (алканов) типичной является реакция _____________, так как в их молекулах имеются только _______________ связи.
2. Перечислите не менее 3-х областей применения этилена
3. Для 3-метилбутина-1 запишите не менее трех формул изомеров. Дайте название каждого вещества, укажите виды изомерии.
4. Напишите уравнения химических реакций для следующих превращений:
1 2 3
СН3Сl ← СН4 → С2Н2 → C2H2Br2
Укажите условия протекания реакций, дайте названия продуктов реакций
5. Вычислите массу и объем кислорода, необходимого для сжигания 3 моль пропана
Вариант 2
1. Дополните фразу: Для непредельных углеводородов типичной является реакция _____________, так как в их молекулах имеются ______________ связи.
2.. Перечислите не менее 3-х областей применения метана
3. Для 2-метилбутена-1 запишите не менее трех формул изомеров. Дайте название каждого вещества, укажите виды изомерии.
4. Напишите уравнения химических реакций для следующих превращений:
1 2 3
СаС2 → С2Н2 → С6Н6 → C6H5NO2
Укажите условия протекания реакций, дайте названия продуктов реакций.
5. Вычислите массу и объем углекислого газа, образовавшегося при сгорании 5 моль ацетилена
Контрольная работа№2. Кислородсодержащие органические вещества.
1 вариант.
Часть А.
1. Вещество, соответствующее общей формуле СпН2п+1ОН, относится к классу:
А. Спиртов. Б. Фенолов. В. Альдегидов. Г. Карбоновых кислот.
2. Вещество, являющееся изомером пропаналя:
А. Пропановая кислота. Б. Пропанон. В. Пропанол-1. Г. Метилэтаноат.
3. Вещество с формулой СН3-СН-СН2-СООН называется:
СН3
А. 3-метилбутановая кислота. Б. 3-метилбутаналь.
В. 2-метилбутановая кислота. Г. 2-метилпроппаналь.
4. Межклассовыми изомерами являются:
А. Альдегиды и карбоновые кислоты.
Б. Одноатомные спирты и фенолы.
В. Карбоновые кислоты и сложные эфиры.
Г. Простые эфиры и карбоновые кислоты.
5. Вещество, между молекулами которого существует водородная связь:
А. Бутан. Б. Бутанол-1. В. Бутаналь. Г. Метилбутаноат.
6. С помощью какого реактива можно распознать многоатомные спирты:
А. Гидроксид меди(II). Б. Оксид меди(II). В. Аммиачный раствор оксида серебра.
Г. Хлорид железа(III).
7. Сложным эфиром является вещество с формулой:
А. СН3СООН. Б. СН3-СН2-СОСН3. В. НСООС3Н7. Г. СН3-СН2-О-СН3.
8.С каким из веществ муравьиная кислота вступает в реакцию замещения?
А. СаО. Б. Ва(ОН)2. В. Mg. Г. Na2SiO3.
Часть В.
Выполните 2 любых задания:
Составьте структурные формулы одного гомолога и трех изомеров 2-метилпропановой кислоты. Назовите все вещества.
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
С2Н2 → СН3СОН → СН3СООН → СН3СООNa → СН3
Укажите условия реакций, назовите вещества.
Напишите уравнения реакций: а) горения метанола, б) окисления метаналя оксидом серебра, в) взаимодействия пропеновой кислоты с цинком.
Часть С.
Какую массу этилацетата можно получить при взаимодействии этанола массой 16г и уксусной кислоты, если выход продукта составляет 75%?
Контрольная работа№2. Кислородсодержащие органические вещества. 2 вариант.
Часть А.
1. Вещество, соответствующее общей формуле СпН2п+1СООН, относится к классу:
А. Спиртов. Б. Фенолов. В. Альдегидов. Г. Карбоновых кислот.
2. Вещество, являющееся изомером уксусной кислоты:
А. Хлоруксусная кислота. Б. Этанол. В. Диметиловый эфир.
Г. Метилметаноат.
3. Вещество с формулой СН3-СН- СН-СН3 называется:
СН3 ОН
А. 2-метилбутанол-3. Б. Пентанол-2. В. 3-метилбутанол-2. Г. Метилбутанол.
4. Межклассовыми изомерами являются:
А. Альдегиды и карбоновые кислоты.
Б. Одноатомные спирты и фенолы.
В. Карбоновые кислоты и простые эфиры.
Г. Простые эфиры и одноатомные спирты.
5. Вещество, между молекулами которого существует водородная связь:
А. Бутан. Б. Бутановая кислота. В. Бутаналь. Г. Бутилацетат.
6. С помощью какого реактива можно распознать альдегиды:
А. Гидроксид меди(II). Б. Оксид меди(II). В. Аммиачный раствор оксида серебра.
Г. Хлорид железа(III).
7. Сложным эфиром не является вещество с формулой:
А. СН3СООСН3. Б. НСООС3Н7. В. СН3-СН2-СОСН3 Г. СН3-СН2-СООСН3.
8. С каким из веществ вступает в реакцию уксусная кислота?
А. С2Н2. Б. Ва(ОН)2. В. MgCl2. Г. Cu.
Часть В.
Выполните 2 любых задания:
Составьте структурные формулы одного гомолога и трех изомеров 2,3-диметилбутановой кислоты. Назовите все вещества.
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
С2Н4 → СН3СН2ОН → СН3СОН → СН3СООН → СН3СООС2Н5
Укажите условия реакций, назовите вещества.
Напишите уравнения реакций: а) взаимодействия фенола с натрием, б) окисления этаналя гидроксидом меди(II), в) взаимодействия уксусной кислоты с карбонатом натрия.
Часть С. В результате взаимодействия уксусной кислоты массой 90 г с этанолом образовалось 100 г сложного эфира. Вычислите массовую долю выхода эфира.
Самостоятельная работа «Гомологи и изомеры» Вариант №1
Какие вещества – гомологи, какие – изомеры:
а) СН3 – СН = СН – СН3, б) СН2 = С – СН3 в) СН ≡ СН,
|
СН3
г) СН2 – СН2 д) НС ≡ С – СН2 – СН3 е) СН3 – СН2 – СН3
| |
СН2 СН2
ж) СН2 = СН – СН2 - СН3, з) СН3 – СН2 – С = СН2
|
СН3.
Ответ: гомологи б и з, в и д.
изомеры а и б , а и г, а и ж , б и ж.
Какие вещества – гомологи, какие – изомеры:
СН3
|
а) СН3 – С – СН2 – СН3, б) СН3 - СН2 – СН – СН2 – СН3
| |
СН3 СН3
СН3
|
в) СН3 – С – СН3 г) СН3 - СН =С – СН2 – СН2 – СН3
| |
СН3 СН3
д) СН3 - С ≡ С – СН2 - СН3, е) СН3 – С ≡ С = СН – СН3
|
СН3 Ответ: гомологи а и в. изомеры а и б, д и е.
Самостоятельная работа «Алкены». Вариант №1
Какие вещества, формулы которых здесь приведены, относятся к алканам: С8Н16, С4Н10, С7Н16, С2Н2. Составьте их структурные формулы.
Даны вещества, формулы которых:
СН3
|
а) СН3 – СН – СН3 б) СН3 – С – СН2 – СН3, в) СН2 – СН – СН2 – СН3
| | |
СН3 СН3 СН3
СН3 СН3
| |
г) СН3 – С – СН3 д) СН3 – СН – СН – СН3
| |
СН3 СН3.
Назовите вещества по систематической номенклатуре, укажите гомологи и изомеры.
Вариант №2
Какие вещества, формулы которых здесь приведены, относятся к алканам: С6Н14, С5Н10, С4Н6, С3Н8, С7Н14. Составьте их структурные формулы.
Даны вещества, формулы которых:
СН3
|
а) СН3 – СН2 – СН2 – СН3 б) СН3 – СН – СН – СН2 – СН3, в) СН2 – С – СН3
| | | |
СН3 СН3 СН3 СН3
СН3
|
г) СН2 – СН2 – СН2 д) СН3 – С – СН2 – СН3
| | |
СН3 СН2 – СН3 СН3.
Назовите вещества по систематической номенклатуре, укажите гомологи и изомеры.
Самостоятельная работа «Алкены. Каучуки».
Составьте структурные формулы веществ:
а) 2 – метилпентен –2. б) бутен – 1
Закончите уравнения реакций:
tº,Рt
а) СН2 =СН2 + Н2 ——→ б) С2Н4 + О2 →
Расскажите о натуральном каучуке.
1. Составьте структурные формулы веществ:
а) 2 – метилбутен –1. б) 2 – метил, 4 – этилгексен –2
2. Закончите уравнения реакций:
а) СН2 =СН2 + Сl2 ——→ б) СН4 + О2 →
Расскажите об истории получения бутадиенового синтетического каучука С.В. Лебедевым.
Контрольная работа (текущий контроль) по теме «Углеводороды и их природные источники»Вариант №1
Для вещества, формула которого
СН3 – СН – СН – СН2 - СН3
| |
СН3 СН3,
составьте структурные формулы двух гомологов и двух изомеров. Дайте названия всем
веществам по систематической номенклатуре.
С какими из перечисленных веществ: кислород, вода, хлор, хлороводород будет реагировать метан? Напишите уравнения реакций, укажите условия их осуществления.
Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
СН4 → С2Н2 → С6Н6 → С6Н6Сl6.
Массовая доля углерода в углеводороде равна 92,31%, водорода – 7,69%, а его относительная плотность по воздуху равна 0,897. Выведите его молекулярную формулу. ( ответ: С2Н2)
Для вещества, формула которого
СН3 – СН2 – С = СН2
|
СН3,
составьте структурные формулы двух гомологов и двух изомеров. Дайте названия всем веществам по систематической номенклатуре.
С какими из перечисленных веществ: кислород, вода, магний, бромоводород, метан будет реагировать этилен? Напишите уравнения реакций, составьте названия продуктов реакций.
Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
С2Н5ОН → С2Н4 → С2Н5Вr → С4Н10.
Массовая доля углерода в углеводороде равна 82,76%, водорода – 7,24%, а его относительная плотность по воздуху равна 2. Выведите его молекулярную формулу.
( ответ: С4Н10)
Самостоятельная работа по теме «Углеводы». Вариант №1
Что происходит с глюкозой, входящей в состав коровьего молока, при скисании молока? Запишите уравнение реакции.
Как доказать опытным путём, что при производстве дешёвых сортов колбас в качестве наполнителя добавляют крахмал?
Вариант №2
Напишите уравнение химической реакции, протекающей при производстве виноградных вин.
Основным сырьём для промышленного получения глюкозы является крахмал. Какая химическая реакция лежит в основе данного способа получения глюкозы?
Самостоятельная работа по теме «Спирты». Вариант №1
Напишите структурные формулы следующих соединений:
а) 2 – метилпропанол – 1, б) 2.3 – диметилбутанол –2,
в) 2 – метилпентанол –2, г) 2,3,4 – триметилпентанол –2.
Допишите уравнения реакций:
Н2SО4
а) СН2 = СН – СН3 + Н2О → б) СН3ОН ——→ в) С2Н5ОН + Nа →
Вариант №2
Напишите структурные формулы следующих соединений:
а) 3 – метилпентанол – 3, б) 2.2 – диметилпропанол –1,
в) бутанол–2, г) 2 – метилбутанол –2.
Напишите уравнения реакций, с помощью которых можно осуществить превращения:
С2Н5ОNа ← С2Н5ОН → С2Н4
↓
СО2
Самостоятельная работа по теме «Фенолы. Альдегиды».
Вариант №1
1. Для вещества, формула которого
СН3 – СН – СН2 – СН3
|
ОН
Составьте структурные формулы двух изомеров и двух гомологов. Дайте названия
всех веществ по международной номенклатуре.
Как при помощи одного реактива можно распознать уксусный альдегид и глицерин? Напишите одно уравнение реакции ( для альдегида) и укажите условия осуществления реакций.
Вариант №2
На основе электронного строения объясните влияние гидроксильной группы - ОН на бензольное ядро в молекуле фенола.
В двух пробирках находятся водные растворы этиленгликоля и формалина. Составьте план распознавания этих веществ, напишите уравнения реакций.
Итоговая контрольная работа за курс 10 класса.
Вариант №1
1. Для вещества, формула которого СН2 = СН – СН2 – СН3 , составьте структурные
формулы двух его гомологов и двух изомеров. Назовите все вещества по
международной номенклатуре.
2. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме:
СН4 → СН3 Вr → С2Н6 → С2Н4 → С2Н5ОН
Дайте названия исходных веществ и продуктов реакции.
.В трёх пронумерованных пробирках находятся растворы глицерина, уксусной кислоты и формалина. Составьте план распознавания веществ. Напишите уравнения реакций, при помощи которых можно идентифицировать данные вещества.
Выведите молекулярную формулу углеводорода, массовая доля углерода в котором рана 75% , водорода 25%, относительная плотность вещества по кислороду равна 0,5.
( Ответ: СН4)
Вариант №2
Для вещества, формула которого СН3 – СН2 – С ≡ СН, составьте структурные формулы двух изомеров и двух гомологов. Назовите все вещества по международной номенклатуре.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
О О О
⁄⁄ ⁄⁄ ⁄⁄
С2Н5ОН → СН3 – С →СН3 – С →СН3 – С
\Н \ ОН \О – СН3
↓
О
⁄⁄
СН3 – С
\ОNа. Назовите все вещества.
В трёх пронумерованных пробирках находятся водные растворы глюкозы, уксусной кислоты и этиленгликоля. Составьте план распознавания веществ. Напишите уравнения реакций. при помощи которых можно идентифицировать данные вещества.
В углеводороде массовая доля углерода равна 82,76%, водорода 17,24%. Относительная плотность углеводорода по воздуху равна 2. Выведите его молекулярную формулу.
( Ответ: С4Н10)
Итоговая контрольная работа
по органической химии
Вариант I
Для вещества, формула которого Н2С = СН – СН2 – СН3, составьте структурные формулы двух изомеров и двух гомологов. Дайте названия всех веществ.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
CH4 CH3Br C2H6 C2H4 C2H5OH. Укажите условия осуществления реакций. Дайте названия исходным веществам и продуктов реакции.
В трёх пронумерованных пробирках находятся растворы глицерина, уксусной кислоты, формалина. Составьте план распознавания веществ. Напишите уравнения реакций, при помощи которых можно идентифицировать вещества.
Вариант II
Для вещества, формула которого Н3С – СН2 – СН2 – СН2 – СН3, составьте структурные формулы двух изомеров и двух гомологов. Дайте названия всех веществ.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
C2H4 C2H4Br2 C2H2 CH3СОН CH3СОOH. Укажите условия осуществления реакций. Дайте названия исходным веществам и продуктов реакции.
3.В трёх пронумерованных пробирках находятся растворы фенола, этиленгликоля, ацетата натрия. Составьте план распознавания веществ. Напишите уравнения реакций, при помощи которых можно идентифицировать вещества
1. Укажите, какая группа определяет функции:
| 1 вариант: альдегидов | 2 вариант: карбоновых кислот | 3 вариант: спиртов | 4 вариант: сложных эфиров | 5 вариант: фенолов |
|
|
|
|
|
|
2. Выберите общую формулу класса:
| 1 вариант: предельных одноатомных спиртов | 2 вариант: алканов
| 3 вариант: алкинов | 4 вариант: предельных односновных карбоновых кислот | 5 вариант: аренов |
| a) Cn H2n+2O | б) Cn H2nO2 | в) СпН 2п+2 | г) СпН2п-2 | СпН 2п-6 |
3. Из приведенных структурных формул веществ выберите соответствующие формулы. Назовите вещества, формулы которых вы написали.
| 1 вариант карбоновых кислот и алкенов: | 2 вариант: спиртов и алканов | 3 вариант: альдегидов и аренов | 4 вариант: фенолов и алкинов | 5 вариант: сложных эфиров алкадиенов | ||||
|
|
|
| 16)СН2=С-СН2 –СН3 | СН3 | 21)СН == С-СН - СН3 | СН3 | ||||
|
|
|
|
17) С7Н6 |
22)С6Н6 | ||||
|
|
|
| 18) С7Н14 | 23) СН2=СН-СН2-СН3 | ||||
|
|
|
|
19) СН2=СН-СН= СН2 | 2 | ||||
|
|
|
15) С7Н12 | 20) СН3-СН2-СН2-СН2-СН3 |
25) С5Н12 | ||||
4. Даны структурные формулы вещества. Определите, какие из них принадлежат к изомерам:
| 1 вариант: сложных эфиров и алканов | 2 вариант: карбоновых кислот и алкенов | 3 вариант: альдегидов алкинов | 4 вариант спиртов и алкадиенов | 5 вариант: фенолов и аренов | ||||
|
|
|
|
16) СН2=С-СН2 –СН3 | СН3 | 21) СН2=СН-СН -СН= СН2 | ||||
|
|
|
|
17)СН == С-СН - СН3 | СН3 | 22) СН2=С-СН2-СН3 | СН3 | ||||
|
|
|
|
18) СН3-СН2-СН2-СН2-СН3 |
23) С6Н6
| ||||
|
|
|
|
19) СН2=СН-СН2-СН2-СН3 |
24) С7Н8 | ||||
|
|
|
|
20) С5Н12 | 25) СН2=С-СН =СН2 | СН3 | ||||
5. Укажите вещество “X” в цепочке превращений. Составьте уравнения реакций, укажите тип реакций, класс и названия веществ.
| 1 вариант: CH3OH —HCHO — X — HCOOC2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
6. С какими из приведенных веществ: Cu(OH)2, NaOH, Na, H2, CH3OH, CH3COOH, O2, Cl2 при определённых условиях вступают в реакции:
| предельные альдегиды | алканы | предельные одноатомные спирты | фенолы | предельные карбоновые кислоты |
7. Как отличить следующие вещества:
| Глицерин и уксусную кислоту | Этанол и глюкозу | Формальдегид и уксусную кислоту | Крахмал и муравьиную кислоту | Этан и этилен |
8. Определите формулу органического соединения, если:
| В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. | Массовая доля углерода в углеводороде равна 85,71%, водорода – 14,29%. Относительная плотность углеводорода по азоту равна 1. | Массовая доля водорода в углеводороде 7,7%. Молярная масса углеводорода 78 г/моль. | В углеводороде массовые доли углерода и водорода соответственно равны 82,76 и 17,24%. Относительная плотность углеводорода по воздуху равна 2,0. | Относительная плотность алкана по воздуху равна 1,52. |
9*. Вам предложены формулы
| В
| К каким классам соединений можно отнести эти вещества? А) альдегидов; Б) кислот; В) фенолов; Г) спиртов; Д) сложных эфиров; Е) углеводов; Ж) ароматических углеводородов; З) алкенов.
|
КОНТРОЛЬНАЯ РАБОТА ЗА КУРС 10 КЛАССА
Установите соответствие между названиями углеводородов и коэффициентами перед формулами воды в уравнении реакций их горения.
НАЗВАНИЯ УГЛЕВОДОРОДОВ КОЭФФИЦИЕНТЫ
1) толуол (С6Н6СН3) А) 12
2) пентен Б) 14
3) гексан В) 6
Г) 4
Д) 10
2. Установите соответствие между названиями соединений и их принадлежностью к определенным
классам органических веществ.
НАЗВАНИЯ СОЕДИНЕНИЙ КЛАССЫ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
1) формальдегид А) галогенпроизводные углеводородов
2) анилин Б) амины
3) глицерин В) альдегиды
4) дихлорметан Г) спирты
Д) сложные эфиры
3. Установите соответствие между названиями веществ и их формулами.
НАЗВАНИЯ ФОРМУЛЫ
1) пентанол А) С3Н4
2) декан Б) С3Н7СОН
3) бутаналь В) С5Н11ОН
4) пропин Г) С10Н22
4. Установите соответствие между функциональными группами и названиями соединений,
в состав которых они входят.
ФУНКЦИОНАЛЬНЫЕ ГРУППЫ НАЗВАНИЯ СОЕДИНЕНИЙ
1) – NH2 А) нитробензол
2) – NO2 Б) этиламин
3) –ОН В) уксусная кислота
4) – СОН Г) крезол
5) – СООН Д) пентаналь
5. Изобразите структурные формулы вещества:
Вариант 1 Вариант 2
Бутанол-1 масляной кислоты
Напишите формулы двух ближайших гомологов и одного изомера, назовите вещества.
6. В пробирках без этикеток находятся вещества:
Вариант 1: глюкоза, уксусная кислота, белок;
Вариант 2: глицерин, крахмал, шерсть.
Составьте план распознавания этих веществ, напишите уравнения соответствующих реакций.
7. Напишите уравнения химических реакций, соответствующих схеме:
метанол→формальдегид→муравьиная кислота→эфир муравьиной кислоты и
метанола→углекислый газ→карбонат кальция
8. Вам предложены формулы
Вариант 1 Вариант 2
Ванилина эвгенола
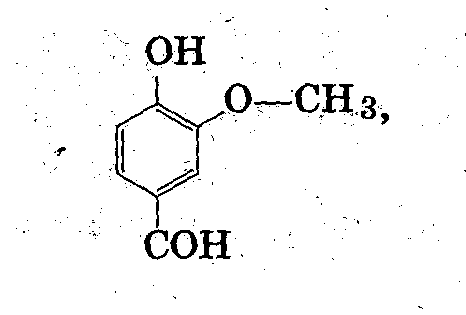

К каким классам соединений можно отнести эти вещества?
А) альдегидов; Б) кислот; В) фенолов; Г) спиртов;
Д) сложных эфиров; Е) углеводов; Ж) ароматических углеводородов;
З) алкенов.
Нормы оценки знаний, умений и навыков учащихся (критерии оценивания уровня подготовки учащихся).
В соответствии с требованиями стандарта по химии и выбранных из федерального списка учебников учитель химии во время проверки и контроля знаний по предмету может ориентироваться на следующие уровни.
Первый уровень - репродуктивный. Выполнение учащимися заданий этого уровня опирается в основном на память. Достижение этого уровня предполагает у учащихся:
- знание названий отдельных химических элементов, веществ и реакций;
- умение устно или письменно описывать химические факты, понятия или явления (реакции);
- понимание роли, значения или применения отдельных химических веществ или реакций;
- применение химической символики - химических знаков, формул и уравнений;
- знание некоторых используемых в химии приборов, умение собирать простейшие из них и использовать при выполнении химического эксперимента.
Для проверки знаний и умений, соответствующих первому уровню, используется репродуктивный вид заданий, предполагающий воспроизведение учащимися отдельных знаний и умений. Проверка первого уровня знаний легко осуществляется формами автоматизированного учета.
Второй уровень - продуктивный. Достижение этого уровня предполагает у учащихся:
- понимание формулировок важнейших химических понятий, законов, теорий и применение их в аналогичных ситуациях;
- умение устанавливать взаимосвязь между составом, строением и свойствами химических веществ;
- умение проводить расчеты по химическим формулам и уравнениям;
- умение самостоятельно проводить химический эксперимент по инструкции учебника или по указанию учителя и фиксировать его результаты.
Для проверки умения применять эти знания в учебной практике используются задания, выполнение которых возможно не только на основе памяти, но и на основе осмысления. Поэтому наряду с психологической операцией воспроизведения широко используются узнавание и явление переноса. Для выполнения таких заданий требуется более напряженная мыслительная деятельность учащихся, чем при выполнении заданий на первом уровне.
Третий уровень - творческий. Достижение этого уровня предполагает у учащихся:
- умение прогнозировать свойства химических веществ на основе знания об их составе и строении и, наоборот, предполагать строение веществ на основе их свойств;
- понимание факторов, позволяющих управлять химическими реакциями (скоростью, направлением, выходом продукта);
- умение проектировать, осуществлять химический эксперимент, а также фиксировать и анализировать его результаты;
- умение ориентироваться в потоке химической информации, определять источники необходимой информации, получать ее, анализировать, делать выводы на ее основе и представлять в соответствующей форме;
- умение осознавать вклад химии в формирование целостной естественно-научной картины мира.
Для проверки знаний, соответствующих третьему уровню, и умения применять их в учебной практике используется рефлективный вид заданий, выполнение которых опирается на репродуктивные знания, но требует глубокого осмысления, владения логическими приемами умственной деятельности (анализ, синтез, обобщение, конкретизация, сравнение, абстрагирование, классификация)
Оценка "5" ставится в случае:
1. Знания, понимания, глубины усвоения обучающимся всего объёма программного материала.
2. Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать межпредметные и внутрипредметные связи, творчески применяет полученные знания в незнакомой ситуации.
3. Отсутствие ошибок и недочётов при воспроизведении изученного материала, при устных ответах устранение отдельных неточностей с помощью дополнительных вопросов учителя, соблюдение культуры письменной и устной речи, правил оформления письменных работ.
Оценка "4":
1. Знание всего изученного программного материала.
2. Умений выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи, применять полученные знания на практике.
3. Незначительные (негрубые) ошибки и недочёты при воспроизведении изученного материала, соблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка "3" (уровень представлений, сочетающихся с элементами научных понятий):
1. Знание и усвоение материала на уровне минимальных требований программы, затруднение при самостоятельном воспроизведении, необходимость незначительной помощи преподавателя.
2. Умение работать на уровне воспроизведения, затруднения при ответах на видоизменённые вопросы.
3. Наличие грубой ошибки, нескольких негрубых при воспроизведении изученного материала, незначительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка "2":
1. Знание и усвоение материала на уровне ниже минимальных требований программы, отдельные представления об изученном материале.
2. Отсутствие умений работать на уровне воспроизведения, затруднения при ответах на стандартные вопросы.
3. Наличие нескольких грубых ошибок, большого числа негрубых при воспроизведении изученного материала, значительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка "1":
Ставится за полное незнание изученного материала, отсутствие элементарных умений и навыков.
Устный ответ.
Оценка "5" ставится, если ученик:
1) Показывает глубокое и полное знание и понимание всего объёма программного материала; полное понимание сущности рассматриваемых понятий, явлений и закономерностей, теорий, взаимосвязей;
2) Умеет составить полный и правильный ответ на основе изученного материала; выделять главные положения, самостоятельно подтверждать ответ конкретными примерами, фактами; самостоятельно и аргументировано делать анализ, обобщения, выводы. Устанавливать межпредметные (на основе ранее приобретенных знаний) и внутрипредметные связи, творчески применять полученные знания в незнакомой ситуации. Последовательно, чётко, связно, обоснованно и безошибочно излагать учебный материал; давать ответ в логической последовательности с использованием принятой терминологии; делать собственные выводы; формулировать точное определение и истолкование основных понятий, законов, теорий; при ответе не повторять дословно текст учебника; излагать материал литературным языком; правильно и обстоятельно отвечать на дополнительные вопросы учителя. Самостоятельно и рационально использовать наглядные пособия, справочные материалы, учебник, дополнительную литературу, первоисточники; применять систему условных обозначений при ведении записей, сопровождающих ответ; использование для доказательства выводов из наблюдений и опытов;
3) Самостоятельно, уверенно и безошибочно применяет полученные знания в решении проблем на творческом уровне; допускает не более одного недочёта, который легко исправляет по требованию учителя; имеет необходимые навыки работы с приборами, чертежами, схемами и графиками, сопутствующими ответу; записи, сопровождающие ответ, соответствуют требованиям.
Оценка "4" ставится, если ученик:
1) Показывает знания всего изученного программного материала. Даёт полный и правильный ответ на основе изученных теорий; незначительные ошибки и недочёты при воспроизведении изученного материала, определения понятий дал неполные, небольшие неточности при использовании научных терминов или в выводах и обобщениях из наблюдений и опытов; материал излагает в определенной логической последовательности, при этом допускает одну негрубую ошибку или не более двух недочетов и может их исправить самостоятельно при требовании или при небольшой помощи преподавателя; в основном усвоил учебный материал; подтверждает ответ конкретными примерами; правильно отвечает на дополнительные вопросы учителя.
2) Умеет самостоятельно выделять главные положения в изученном материале; на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи. Применять полученные знания на практике в видоизменённой ситуации, соблюдать основные правила культуры устной речи и сопровождающей письменной, использовать научные термины;
3) Не обладает достаточным навыком работы со справочной литературой, учебником, первоисточниками (правильно ориентируется, но работает медленно). Допускает негрубые нарушения правил оформления письменных работ.
Оценка "3" ставится, если ученик:
1. усвоил основное содержание учебного материала, имеет пробелы в усвоении материала, не препятствующие дальнейшему усвоению программного материала;
2. материал излагает несистематизированно, фрагментарно, не всегда последовательно;
3. показывает недостаточную сформированность отдельных знаний и умений; выводы и обобщения аргументирует слабо, допускает в них ошибки.
4. допустил ошибки и неточности в использовании научной терминологии, определения понятий дал недостаточно четкие;
5. не использовал в качестве доказательства выводы и обобщения из наблюдений, фактов, опытов или допустил ошибки при их изложении;
6. испытывает затруднения в применении знаний, необходимых для решения задач различных типов, при объяснении конкретных явлений на основе теорий и законов, или в подтверждении конкретных примеров практического применения теорий;
7. отвечает неполно на вопросы учителя (упуская и основное), или воспроизводит содержание текста учебника, но недостаточно понимает отдельные положения, имеющие важное значение в этом тексте;
8) обнаруживает недостаточное понимание отдельных положений при воспроизведении текста учебника (записей, первоисточников) или отвечает неполно на вопросы учителя, допуская одну-две грубые ошибки.
Оценка "2" ставится, если ученик:
1. не усвоил и не раскрыл основное содержание материала;
2. не делает выводов и обобщений.
3. не знает и не понимает значительную или основную часть программного материала в пределах поставленных вопросов;
4. или имеет слабо сформированные и неполные знания и не умеет применять их к решению конкретных вопросов и задач по образцу;
5) или при ответе (на один вопрос) допускает более двух грубых ошибок, которые не может исправить даже при помощи учителя.
Оценка "1" ставится, если ученик:
1) не может ответить ни на один из поставленных вопросов;
2) полностью не усвоил материал.
Примечание.
По окончанию устного ответа учащегося педагогом даётся краткий анализ ответа, объявляется мотивированная оценка. Возможно привлечение других учащихся для анализа ответа, самоанализ, предложение оценки.
Оценка самостоятельных письменных и контрольных работ.
Оценка "5" ставится, если ученик:
1. выполнил работу без ошибок и недочетов;
2) допустил не более одного недочета.
Оценка "4" ставится, если ученик выполнил работу полностью, но допустил в ней:
1. не более одной негрубой ошибки и одного недочета;
2. или не более двух недочетов.
Оценка "3" ставится, если ученик правильно выполнил не менее половины работы или допустил:
1. не более двух грубых ошибок;
2. или не более одной грубой и одной негрубой ошибки и одного недочета;
3. или не более двух-трех негрубых ошибок;
4. или одной негрубой ошибки и трех недочетов;
5) или при отсутствии ошибок, но при наличии четырех-пяти недочетов.
Оценка "2" ставится, если ученик:
1. допустил число ошибок и недочетов превосходящее норму, при которой может быть выставлена оценка "3";
2. или если правильно выполнил менее половины работы.
Оценка "1" ставится, если ученик:
1. не приступал к выполнению работы;
2. или правильно выполнил не более 10 % всех заданий.
Примечание.
1) Учитель имеет право поставить ученику оценку выше той, которая предусмотрена нормами, если учеником оригинально выполнена работа.
2) Оценки с анализом доводятся до сведения учащихся, как правило, на последующем уроке, предусматривается работа над ошибками, устранение пробелов.
Оценка выполнения практических (лабораторных) работ, опытов по предметам.
Оценка "5" ставится, если ученик:
1) правильно определил цель опыта;
2) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений;
3) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью;
4) научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, чертежи, графики, вычисления и сделал выводы;
5) правильно выполнил анализ погрешностей (9-11 классы).
6) проявляет организационно-трудовые умения (поддерживает чистоту рабочего места и порядок на столе, экономно использует расходные материалы).
7) эксперимент осуществляет по плану с учетом техники безопасности и правил работы с материалами и оборудованием.
Оценка "4" ставится, если ученик выполнил требования к оценке "5", но:
1. опыт проводил в условиях, не обеспечивающих достаточной точности измерений;
2. или было допущено два-три недочета;
3. или не более одной негрубой ошибки и одного недочета,
4. или эксперимент проведен не полностью;
5. или в описании наблюдений из опыта допустил неточности, выводы сделал неполные.
Оценка "3" ставится, если ученик:
1. правильно определил цель опыта; работу выполняет правильно не менее чем наполовину, однако объём выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы;
2. или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью учителя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов;
3. опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, анализе погрешностей и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения; или не выполнен совсем или выполнен неверно анализ погрешностей (9-11 класс);
4. допускает грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию учителя.
Оценка "2" ставится, если ученик:
1. не определил самостоятельно цель опыта; выполнил работу не полностью, не подготовил нужное оборудование и объем выполненной части работы не позволяет сделать правильных выводов;
2. или опыты, измерения, вычисления, наблюдения производились неправильно;
3. или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3";
4. допускает две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию учителя.
Оценка "1" ставится, если ученик:
1. полностью не сумел начать и оформить опыт; не выполняет работу; показывает отсутствие экспериментальных умений; не соблюдал или грубо нарушал требования безопасности труда.
Оценка умений проводить наблюдения.
Оценка "5" ставится, если ученик:
1. правильно по заданию учителя провел наблюдение;
2. выделил существенные признаки у наблюдаемого объекта (процесса);
3. логично, научно грамотно оформил результаты наблюдений и выводы.
Оценка "4" ставится, если ученик:
1. правильно по заданию учителя провел наблюдение;
2. при выделении существенных признаков у наблюдаемого объекта (процесса) назвал второстепенные;
3) допустил небрежность в оформлении наблюдений и выводов.
Оценка "3" ставится, если ученик:
1. допустил неточности и 1-2 ошибки в проведении наблюдений по заданию учителя;
2. при выделении существенных признаков у наблюдаемого объекта (процесса) выделил лишь некоторые;
3) допустил 1-2 ошибки в оформлении наблюдений и выводов.
Оценка "2" ставится, если ученик:
1. допустил 3 - 4 ошибки в проведении наблюдений по заданию учителя;
2. неправильно выделил признаки наблюдаемого объекта (процесса);
3. опустил 3 - 4 ошибки в оформлении наблюдений и выводов.
Оценка "1" ставится, если ученик:
Не владеет умением проводить наблюдение.
1




 4)
4)