РАЗБОР И РЕШЕНИЕ ЗАДАНИЯ №20, 21 ОГЭ ПО ХИМИИ
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА И УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
В 20 задании ОГЭ по химии необходимо полностью предоставить решение. Решение 20 задания - составление уравнения химической реакции методом электронного баланса.
Теория к заданию №20 ОГЭ по химии Об окислительно-восстановительных реакциях мы уже с Вами говорили в 14 задании ОГЭ по химии. Теперь рассмотрим метод электронного баланса на типовом примере, но перед этим узнаем, что это за метод и как им пользоваться.
Метод электронного баланса Метод электронного баланса - метод уравнивания химических реакций, основанный на изменении степеней окисления атомов в химических соединениях.
Алгоритм наших действий выглядит следующим образом:
Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции
Выбираем только те элементы, которые поменяли степень окисления
Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
Находим наименьшее общее кратное для переданных электронов
Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель.
Итак, составляем электронный баланс. В данной реакции у нас меняют степени окисления сера и йод.
Сера находилась в степени окисления +6, а в продуктах - -2. Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления.
1 | S+6 + 8ē → S–2
4 | 2I–1 – 2ē → I2
Сера отдала 8 электронов, а йод забрал только два - общее кратное 8, и дополнительные множители 1 и 4!
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Не забываем указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем.
Задания 21. Химические свойства простых и сложных веществ
Решение 20 задания - составление уравнения химической реакции
Алгоритм решения «цепочек превращения» по химии
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Дана схема превращений:
Ca → Х → Ca(OH)2 → Ca3(PO4)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Алгоритм решения «цепочки превращений»
1 шаг. Определитесь с веществом Х. Из простого вещества необходимо перейти к основанию. Мы знаем, что основания можно получить из основных оксидов при взаимодействии с водой. Значит. Вещество Х – основной оксид – СаО.
2 шаг. Перепишите цепочку, которую необходимо решить
Ca → СаО → Ca(OH)2 → Ca3(PO4)2
3 шаг. Пронумеруйте количество реакций для удобства решения
1 2 3
Ca → СаО → Ca(OH)2 → Ca3(PO4)2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции.
4 шаг. Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
1) 2Сa + O2 → 2Ca+2O-2
5 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2-
6 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2- + 2H3+PO43- → Ca32+(PO4)23- + 6H2O
Составляем сокращённое ионное уравнение реакции
4) 3Ca2++ 6OH- + 6H++2PO43- → Ca32+(PO4)23- + 6H2
1. Дана схема превращений: Fe2O3 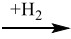 X → FeCl2 → Fe(OH)2
X → FeCl2 → Fe(OH)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
2. Дана схема превращений: Cu(NO3)2 → Cu → X → Cu(OH)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
3. Дана схема превращений: Fe → X → Fe(OH)3 → Fe(NO3)3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
4. Дана схема превращений: Si → SiO2 → Na2SiO3 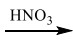 X
X
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
5. Дана схема превращений: Zn(OH)2 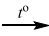 X → ZnCl2 → Zn3(PO4)2
X → ZnCl2 → Zn3(PO4)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.