Урок по теме -
«Количество вещества. Моль. Молярная масса. Молярный объем газов»
Тип урока: комбинированный (комплексного применения знаний и умений.)
В текущем учебном году урок разработан для восьмиклассников.
Цель урока: систематизация знаний учащихся о понятиях «количество вещества», «число Авогадро», «молярная масса», «молярный объем газов», выявить их взаимосвязь и использование при решении экспериментальных задач.
Задачи урока:
воспитывающая: воспитывать взаимовыручку и взаимодействие через групповую форму работы;
развивающие: развивать познавательный интерес к предмету и навыки самооценки знаний, умение логически мыслить, выдвигать гипотезы, делать аргументированные выводы,
обучающая: формировать понятия о молярной массе и единицах ее измерения, показать взаимосвязь понятий: масса, количество вещества, молярная масса, молярный объем газа.
Планируемые результаты:
личностные: формировать умения понимать значимость естественнонаучных и математических
знаний для решения практических задач,
устанавливать связь между целью деятельности и ее результатом, оценивать
собственный вклад в работу группы;
метапредметные: формировать умения планировать, контролировать и оценивать учебные действия
в соответствии с поставленной задачей,
самообразование, самоорганизация, саморазвитие и самоопределение,
сотрудничество в команде (планирование, распределение функций, взаимопомощь, взаимоконтроль);
предметные: установить взаимосвязь понятий: масса, количество вещества, молярная масса,
молярный объем газа.
Ожидаемые результаты.
Ученики знают понятия:
на базовом уровне: «количество вещества», «молярная масса», «молярный объем», «моль», «число Авогадро»;
на повышенном уровне: киломоль, миллимоль.
Ученики умеют:
на базовом уровне: называть количество вещества и молярную массу по обозначениям, указывать единицы измерения, видоизменять расчетную формулу при решении прямых задач;
для повышенного уровня: видоизменять расчетную формулу при решении прямых и обратных задач, производить белее сложные расчёты (например, находить массу вещества, если известен объем или число структурных частиц).
Межпредметные связи: математика, информатика, физика, биология.
Виды учебной деятельности: проводят соответствие между названием величин и их единиц измерения; внимательно прочитывают задачу, оформляют ее решение; работают с весами и измерительным цилиндром, проводят расчеты; доказывают свою точку зрения; решают задачу в программе Microsoft Office Excel.
Характер деятельности: частично-поисковый с элементами исследования.
Методы и формы обучения: объяснительно-иллюстративный с элементами проблемно-поискового изложения; групповая работа по решению задач.
Используемые педагогические технологии: игровые, групповые, ИКТ, проблемно-поисковый (дифференцированный, работа по схеме-алгоритму).
Оборудование: ИД, презентация, весы с разновесами, мерный цилиндр, химический стакан, столовая ложка, фильтровальная бумага, чашка Петри, одноразовые стаканчики, салфетки, кусочки мела, минеральная вода, сахар-рафинад.
В целях повышение качества образования, совершенствования научно-методического обеспечения образовательного процесса используются групповая форма работы, исследовательский метод, которые повышают мотивацию, позволяют выбирать индивидуальный темп, решать творческие задачи, формируют навыки самоорганизации и самообразования, обеспечивают деятельностный и личностно-ориентированный характер образования, который является неотъемлемой частью Федеральных Государственных стандартов второго поколения.
Актуальность и оригинальность:
- возможность каждому школьнику проявить свои возможности, развитие его познавательной самостоятельности и творчества, умений анализировать информацию, выбирать главное и обрабатывать ее на компьютере, развитие коммуникативных УУД, чувства ответственности и причастности к созданию «своего» урока (при этом учитель выступает в роли координатора).
Материалы уроков могут быть использованы на уроках химии, информатики, математики, физики, биологии.
Приемы, методы, формы обучения соответствуют возрастным психологическим и педагогическим особенностям восьмиклассников.
Использование ИКТ на уроках химии позволяет стимулировать познавательную активность детей и участвовать в освоении новых знаний через поиск необходимой информации, развитие умений находить несколько способов решения проблемной задачи
При проведении уроков используются:
интерактивная доска, что позволяет сделать занятия интересными и развивают мотивацию; предоставляют больше возможностей учащимся для участия в коллективной работе, легче воспринимать и усваивать сложные вопросы в результате более ясной, эффективной и динамичной подачи материала. Школьники работают у доски с удовольствием, более творчески, с уверенностью в себе. Учитель может своевременно вносить коррективы, организовать коллективное обсуждение,
электронные модули из базы ФЦИОР:
тест по теме «Количество вещества»,
итоговый тест по теме «Количество вещества» (задания 16-20),
тесты, разработанные с помощью программы для создания тестов «HotPotatoes 6» (авторские).
тесты учебника - навигатора О.С. Габриеляна «Химия. 8 класс».
Технологическая карта урока «Решение задач по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов»
| Технологичес- кие этапы урока | Деятельность учащихся | Деятельность учителя | Задания для учащихся, выполнение которого приведет к достижению запланированных результатов. |
| Организацион-ный момент. 3 мин. | Приветствуют. Решают и проверяют решение задач.
| Приветствует. Для активизации мыслительных процессов проводит «Гимнастику ума» - решение валеологичес-ких задач. Условия и решение – на интерактивной доске. | 1.Среднее содержание железа в организме человека массой 70 кг составляет 5 г. А сколько же этого вещества в моем организме? 2.В поясничном, крестцовом и копчиковом отделах позвоночника позвонков поровну. В грудном отделе их на семь больше, чем в поясничном, а в шейном отделе — на пять меньше, чем в грудном. Сколько позвонков в каждом отделе позвоночника, если всего их 34? 3.Длина кишечника человека в 4 раза превышает длину туловища. Вычислите длину своего кишечника. 4.В России ежегодно умирает 500 000 мужчин среднего возраста. 42% из них умирают из-за болезней, связанных с курением. Сколько человек могли бы продолжать жить, если бы своевременно бросили курить? Задача. Вычислить свой предполагаемый рост по формуле. Дс = 0,54×(ДО + Дм ) – 4,5 Дд = 0,51×(До + Дм) – 7,5 (Дс – длина тела сына, Дд – длина тела дочери, До – длина тела отца, Дм – длина тела матери). |
| Актуализация знаний. 5 мин.
| Отвечают на вопросы.
Один ученик выполняет задание на доске, остальные в тетради. Проводят проверку и самопроверку выполнения задания.
| Какое отношение имеет моль к теме нашего урока? С какими новыми величинами мы познакомились на предыдущих уроках? Давайте их вспомним.
Организует проверку домашнего задания.
| Расскажу сегодня, что ли о зловредной роли моли.
Моль съедает шерсть и мех, просто паника у всех… Ну а в химии – изволь! Есть другое слово «моль». Прост, как небо и трава, моль любого вещества. Но трудна его дорога: в моле так молекул много! 1. ИД (шторка): | Что означает эта запись? | Что является единицей измерения? | | n | Моль | | М | г/моль | | N | | | NА | 6*1023 | | m | г | | Vm | л/моль | | V | л | 2. Составьте формулы, в которых использовались данные величины. Используя данные обозначения, запиши формулы для вычисления: А) массы вещества – Б) числа молекул – В) объема газообразного вещества – |
| Постановка цели и задач урока. 1-2 мин. | Формулируют тему, цель урока. Определяют, какие действия, в какой последователь-ности и с помощью чего надо осуществить. | Сформулируйте тему и цели урока.
|
|
| Первичное закрепление: а) решение типовых задач (в знакомой ситуации). 7 мин. | Решают задачи
Анализируют выполнение задания. Проводят самооценку. | Организует решение задач. Задания на три уровня сложности. Работают в парах. При необходимости оказывает помощь. На основании сформирован-ности умений решать задачи будут организованы группы. | Проблемная ситуация. Все читали или смотрели фильм «Дети капитана Гранта». Записка со стертыми записями пришла к нам. Попробуем восстановить.
| Вещество | Число молекул
N=Na*n | Молярная масса (рассчи- тывается по ПСХЭ) | Число молей
n = 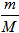
| Масса вещества
m = M*n | | H2 | 30 * 1020 | 2 г/моль | 5моль | 10 г | | Н2SO4 | 60 * 1023 | 98 г/моль | 10 моль | 980г | | FeCl2 | 12 * 1026 | 127 г/моль | 2 моль | 254 г |
|
| Физкультминутка. 3 мин. | Выполняют физкультминутку | Организует проведение физкультминутки. | Точечный массаж для профилактики простудных заболеваний. 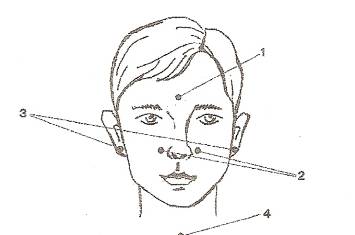
З Точки: 1 – красная точка; 2 – две синие точки; 3 – две желтые точки; 4 – зеленая точка.
ная средство от простуды, Мы здоровыми все будем. Есть волшебные точки у нас- Нажимай их каждый раз. Точку красную найдем, Пальчик кругом поведем. Отдохнули, поворот – Пальчик движется вперед. Точку красную оставим, Пальчик к синенькой приставим. Чтобы носик наш дышал, Насморк деткам не мешал. Покрутили точку эту, Передали эстафету. Точки желтые находим И опять по кругу водим. Стоп, пойдем теперь вперед. Кто быстрей новую точку найдет? Точка зеленая на груди у нас, Находим все дружно ее мы сейчас. Пальчиком водим по кругу мы снова – Из школы домой пойдут детки здоровы. |
| Первичное закрепление: б) в измененной ситуации (конструктивные) 13 мин. | Знакомятся с картами - исследования. Читают их. Выполняют задание. Проводят необходимые расчеты и измерения. Подводят итог своей работе. Оценивают работу свою и товарищей. | Теперь проведём исследование по практическому применению этих величин.
Организуется работа 7 разноуровневых групп. На каждом столе вы видите карту - исследования. Внимательно прочитайте ее, сформулируйте цель работы, проведите необходимые измерения и расчеты. Сделайте вывод.
Организует защиту отчетов групп.
| В каждой группе выбирают: организатора работы - руководит обсуждением, следит за тем, чтобы группа не отвлекалась от выполнения задания, вовлекает в работу всех членов группы, докладчика – рассказывает о результатах работы группы, протоколиста – записывает результаты работы, исследователей – проводят расчеты и необходимые измерения. Карта – исследования № 1 по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов». Мы каждый день употребляем сахар, например, когда пьем чай. Но вы когда-нибудь задумывались: сколько моль сахара содержится в кусочке рафинада? какое количество сахарозы вы выпиваете с чаем? Запишите молекулярную формулу сахара, если известно, что в состав ее молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода. Подсчитайте молярную массу сахарозы. Вспомните правила взвешивания (Приложение 1). На весах взвесьте 1 кусочек сахара рафинада, определите, какое количество сахарозы вы выпиваете с чаем? сколько атомов сахарозы оказывается в вашем организме? Сделайте вывод. Карта – исследования № 2 по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов». В столовой ложке воды – 1 моль воды. Проведите опыт и выясните, сколько молекул воды в стакане. Сделайте вывод. Карта – исследования № 3 по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов». Вспомните правила определения объема жидкости (Приложение 2). В мерный цилиндр отмерьте 12 столовый ложек воды. Определите массу (плотность воды принять равной 1 г\см3) и ответьте на вопрос: какое количество молекул воды содержится в этом объёме? Сделайте вывод. Карта – исследования № 4 по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов». Вспомните правила определения объема жидкости (Приложение 2). В стаканчике находится минеральная вода. Вы можете выпить ее и ответить на вопрос: Сколько молекул минеральной воды вы выпили, если 1 глоток составляет 1 моль вещества. Сделайте вывод. Карта – исследования № 5 по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов». В лаборатории углекислый газ получают при взаимодействии карбоната кальция СаСО3 с соляной кислотой HCl. Получите углекислый газ. Предположим, что вы собрали 2 моль газа. Определите объем газа при нормальных условиях. Сколько молекул углекислого газа содержится в сосуде? Сделайте вывод. Карта – исследования № 6 по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов». Предположим, что за время урока вы исписали кусочек мела. Вспомните правила взвешивания (Приложение 1). Определите массу кусочка мела. Сколько молекул карбоната кальция (СаСО3) осталось на доске. Карта – исследования № 7 по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов». Предположим, что ваше золотое кольцо состоит из чистого золота. Вспомните правила взвешивания (Приложение 1). Определите массу кольца. Сколько атомов золота в нем содержится. Приложение 1. Правила взвешивания. Весы должны быть уравновешены, т. е. стрелка должна быть в нулевом положении. Взвешиваемое вещество помещают на левую чашку весов, а правая предназначена для разновесов. Не кладите вещества непосредственно на чашку весов, а используйте для этого фильтровальную бумагу. Обязательно используйте противовес. Разновесы нельзя брать руками, а специальным пинцетом. Разновесы нужно ставить на чашку весов по порядку, от большей массы к меньшей. После того, как будет достигнуто равновесие, посчитайте общую массу гирь и запишите результаты. Приложение 2. Измерение объёма с помощью мерного цилиндра. Для того чтобы правильно измерить объём жидкости нужно правильно расположить его на столе. Правильно посмотреть на шкалу. Вспомните, как правильно определить цену деления:
а) найти два ближайших штриха шкалы, возле которых написаны значения величины;
б) вычесть из большего значения меньшее и полученное число разделить на число делений, находящихся между ними. Вода у стенок сосуда немного приподнимается (смачивает стенки), а в средней части сосуда поверхность жидкости почти плоская. Глаз следует направлять на деление, совпадающее с плоской частью поверхности. Запишите результаты измерения. |
| Творческое применение и добывание знаний в новой ситуации (проблемные задания). Дополнитель-ные задания | Выполняют творческие задания (по уровням сложности). Знакомят товарищей с результатом работы. |
| Восьмиклассник Костя зашел в магазин и попросил продавщицу продать ему 10 молей поваренной соли. Что ответила Косте продавщица? И что бы ответили вы? В походе мальчики первого отряда убили одну моль и одного комара, а мальчики второго отряда убили один моль комаров. На что была бы похожа палатка второго отряда, если бы комары вели себя как молекулы газа? (один моль комаров – это 6,02∙1023 комаров). Если один комар весит 0,01г, то один моль комаров имеет массу: 6,02 ∙1023∙ 0,01 (г)=6,02∙1015 тонн. Палатку не было бы видно. Впрочем, не видно было бы и всю страну, в которой происходил этот поход - все было бы завалено комарами. |
| Информация о домашнем задании, инструктаж по его выполнению. 3 мин. | Записывают домашнее задание. Задают вопросы. | Знакомит с домашним заданием. На «3» выполнить задания ЭУМ «Тест по теме «Количество вещества», решить две задачи из предложенных, на «4» - «Тест по теме «Количество вещества», решить три задачи, на «5» - выполнить задания ЭУМ «Тест по теме «Количество вещества», решить четыре задачи (по выбору ученика). ЭУМ находится на сайте Е.А. Золотавиной. Творческое задание (по желанию) - составить задачи на определение массы, объема через количество вещества и решите ее | 1. В стратосфере на высоте 20-30 км находится слой озона О3, защищающий Землю от мощного ультрафиолетового излучения Солнца. Предположим, что на каждого жителя Заводоуковска в воздушном пространстве над городом приходится по 10 моль озона. Сколько молекул О3 приходится в среднем на одного заводоуковца. 2. Какое количество хлорида натрия содержится в килограмме поваренной соли? Сколько молекул?
3.Сколько стоит 1 моль поваренной соли (хлорида натрия NaCl), если 1кг стоит – 8 руб.?
4. Каково количество углерода, содержащегося в самом крупном в мире алмазе (аллотропное видоизменение углерода C) Куллинан в 3106 карата, если 1 карат – 0,2 грамма? 5. Тело 8-классника содержит примерно 2*10 27 атомов кислорода. Какое количество элемента кислорода содержится в теле подростка? 6. Взвесили 3,2 г меди и 5,6 г железа. Одинаково ли количество взятых веществ? 7. Какую массу меди необходимо взвесить на весах, чтобы ее количество было равно 0,3 моль? 8. В теле подростка содержится примерно 0,35 моль кровеобразующего элемента железа. Определите число атомов железа, содержащегося в теле подростка. 9. Школьник 13-14 лет имеет объем легких примерно 1,8 л. Сколько молекул кислорода поступает в легкие при полном вдохе, если количество кислорода в этом объеме воздуха составляет 0,0157 моль? 10. Рассчитайте объем, который занимает (при н. у.) порция газа, необходимого для дыхания, если в этой порции содержится 2,69 • 1022 молекул этого газа. Какой это газ? |
| Рефлексия. 4 мин. | Подводят итоги работы (анализируют, выполнили цель и задачи урока). | Чему мы научились на этом уроке? Как вы понимаете слова Алигер? Эти строки раскрывают связь химии с другими естественными науками, причем об этом говорил ещё М.В. Ломоносов более двух веков назад, актуальной является эта мысль и сейчас. Из уроков физики, химии и математики вы узнали, что для изучения окружающего мира недостаточно только наблюдать и описывать явления и предметы, необходимо их характеризовать также количественно. | О, физика – наука из наук! Все впереди! Как мало за плечами! Пусть химия нам будет вместо рук. Пусть станет математика очами. Не разлучайте этих трех сестер Познания всего в подлунном мире, Тогда лишь будет ум и глаз остер И знанье человеческое шире. (отрывок из поэмы М. Алигер “Ленинские горы”)
|

















