Открытый урок по теме : «Окислительно восстановительные реакции и зависимость их от различных факторов».
Класс: 11
Учитель: Еферова Н.И.
Цель урока: Обобщить, систематизировать и расширить знания учащихся об окислительно-восстановительных реакциях, важнейших окислителях и продуктах их восстановления.
Задачи: В ходе исследовательской деятельности учащихся сформировать представление о влиянии различных факторов на процесс окислительно-восстановительных реакций выработать умение составлять окислительно-восстановительные реакции с помощью метода электронного баланса.
В ходе исследовательской деятельности учащихся сформировать представление о влиянии различных факторов на процесс окислительно-восстановительных реакций выработать умение составлять окислительно-восстановительные реакции с помощью метода электронного баланса.
Способствовать формированию информационной, коммуникативной, ценностно - смысловой компетенции
Тип урока: изучение нового материала с использованием новых образовательных технологий, электронных образовательных ресурсов и средств ИКТ.
Оборудование и реактивы, необходимые для проведения занятия: компьютер, проектор с экраном, штатив с пробирками, спиртовки, спички, держатели, цинк, алюминий медь, растворы соляной кислоты, разбавленной и концентрированной азотной и серной кислот, сульфата железа (II), хлорида железа (III), йодид калия, клейстер, раствор перманганата калия, сульфита калия, гидроксида калия.
Технологии, использованные при проведении занятия: проблемное обучение, обучение в сотрудничестве, метод проектов, дифференцированное обучение.
Ход урока.
1. Эмоциональный настрой.
- Добрый день, уважаемые ребята! Если день начинать с улыбки, то можно надеяться, что он пройдет удачно. Давайте сегодняшнее занятие проведем с улыбкой. Главная задача – быть внимательными, активными, находчивыми, а главное – трудолюбивыми. Показывать, что мы знаем и как умеем работать.
2.Актуализация знаний
- Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
Беседа по ранее изученному материалу.
1) Какие реакции называются окислительно- восстановительными?
Окислительно - восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
2) Что такое процесс окисления?
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
3) Какой процесс называется восстановлением?
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
4) Как называются частицы, отдающие электроны?
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
5) Как называются частицы, принимающие электроны?
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
6) Что такое «степень окисления»?
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна (условный заряд атома, который мы приписываем ему в случае принятия или отдачи электронов).
7) Какой метод составления уравнения окислительно-восстановительных реакций вы знаете? Какое правило лежит в основе этого метода?
- Теперь, когда мы повторили основные вопросы прошлых уроков перейдём к изучению нового материала. На уроке класс будет работать в четырёх группах. Работа каждой группы направлена на самостоятельное получение новых знаний путём проведения исследовательской работы с окислительно-восстановительными реакциями».
3. Постановка проблемы урока (Технология проблемного обучения).
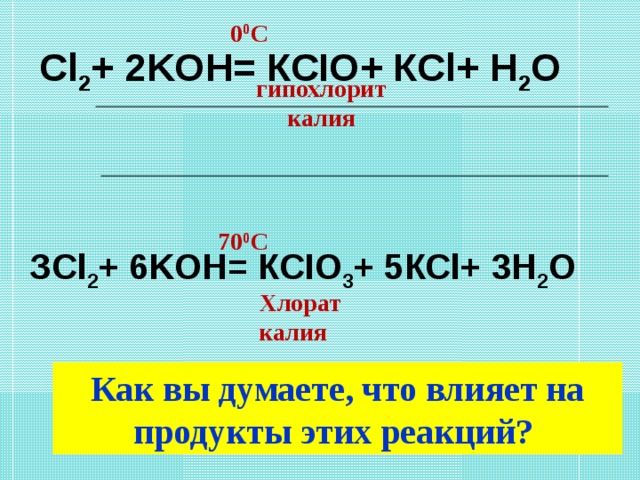
- Известно, что при пропускании хлора через щелочь при температуре близкой к 00С, получается гипохлорит, а при нагревании – хлорат.
Cl2+ 2KOH= КСIО+ КСl+ Н2О
ЗCl2+ 6KOH= КСIО3+ 5КСl+ 3Н2О
-Как вы думаете, что влияет на продукты этих реакций?»
Что разные металлы с азотной кислотой могут давать различные оксиды азота (I, II, IV), азот и аммиак.
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O +NH4NO3
-Почему одно и то же вещество в процессе окислительно-восстановительных реакций может давать различные продукты?
(Учащиеся выдвигают различные предположения. Подвожу их к формулировке к теме урока, которая наиболее полно отражает это влияние)
- Чем мы будем заниматься на уроке?
(На основе экспериментальных данных установить зависимость окислительно-восстановительных реакций от различных факторов).
- Тема нашего урока: «Окислительно восстановительные реакции и зависимость их от различных факторов». (слайд 1)
- Я сегодня вам предлагаю проделать опыты по теме «Зависимость продуктов окислительно-восстановительных реакций от условий их протекания.
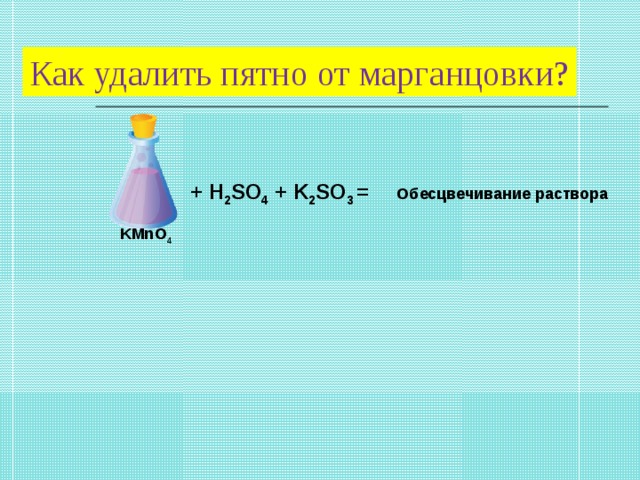
Создание проблемной ситуации: И еще мне нужна ваша помощь, я готовила к уроку раствор перманганата калия («марганцовка»), пролила стакан с раствором на полотенце. Предложите (проделав лабораторные опыты) вещество, с помощью которого можно очистить полотенце.
4. Операционно-исполнительский этап. (Метод проектов. Технология дифференцированного обучения)
- Сегодня на уроке вы работаете в группах. Каждая группа выполнит исследование согласно инструкциям, которые находятся на столах». Но повторим основные моменты по ТБ при работе с кислотами и щелочами.
(Учащиеся объединяются в группы в зависимости от степени подготовленности по предмету).
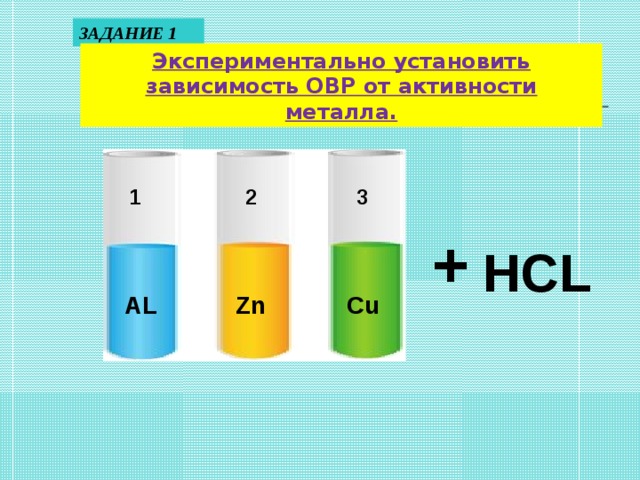
Инструкция группе № 1.
Цель: установить зависимость протекания ОВР от активности реагентов.
В четыре пробирки налить по 2-3 мл раствора соляной кислоты. В пробирки соответственно опустить цинк, алюминий, медь. Какие металлы реагируют с кислотой? Сделать вывод, составить окислительно-восстановительные реакции, используя метод электронного баланса.
(Планируемый результат работы группы: составление ОВР с использованием метода электронного баланса, установление зависимости протекания ОВР от активности реагентов. Особое внимание учащиеся обращают на алгоритм составления ОВР методом электронного баланса).
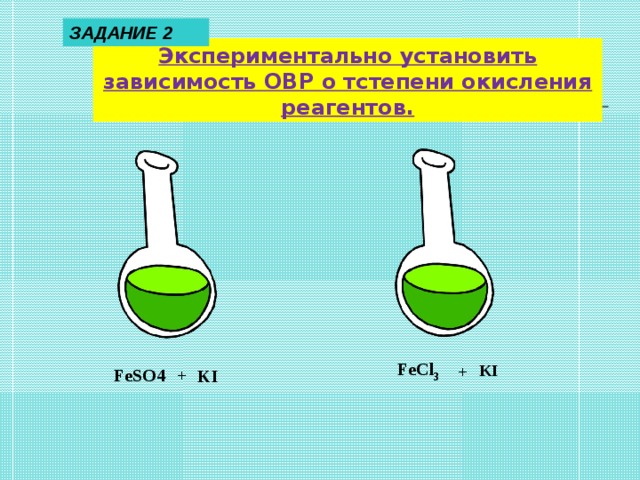
Инструкция группе № 2.
Цель: установить зависимость процессов окисления и восстановления от степени окисления реагентов.
1. В пробирку налить 2-3 мл раствора сульфата железа (II) и туда же добавить иодид калия и крахмальный клейстер. Изменился ли цвет смеси? Идет ли данная реакция?
2. Налить в пробирку 2-3 мл раствора хлорида железа (III) и туда же добавить несколько капель раствора иодида калия и крахмальный клейстер. Что наблюдаете? Как изменится окраска раствора? Запишите уравнение, используя метод электронного баланса по схеме:
 FeCl3+KI FeCl2+I2+KCl
FeCl3+KI FeCl2+I2+KCl
(Планируемый результат работы группы: составление ОВР с использованием метода электронного баланса, установление зависимости процессов окисления и восстановления от степени окисления реагентов; привести примеры практического значения окислителей).
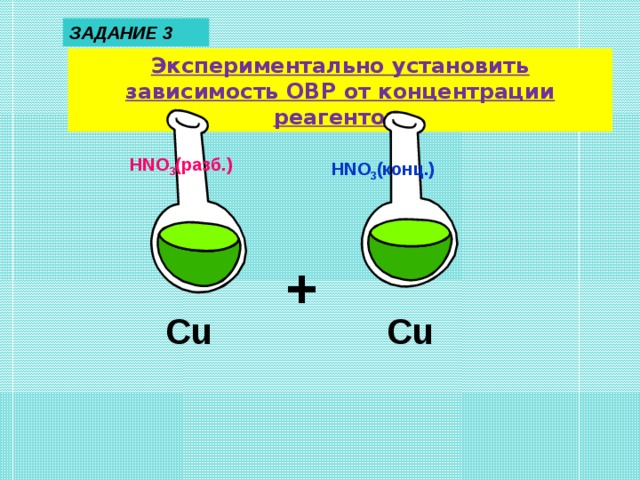
Инструкция группе № 3.
Цель: установить зависимость протекания окислительно-восстановительных реакций от концентрации реагентов.
Положить в две пробирки по кусочку меди. В одну из них прилить 2-3 мл разбавленной азотной кислоты, в другую – концентрированной. При необходимости немного нагреть пробирки, соблюдая правила ТБ. Наблюдать выделение газов, обратить внимание на их цвет. Какой газ образуется в первой пробирке, какой во второй? Сделать вывод, составить окислительно-восстановительные реакции, используя метод электронного баланса.
(Планируемый результат работы группы: составление ОВР с использованием метода электронного баланса, установление зависимости протекания ОВР от концентрации реагента).
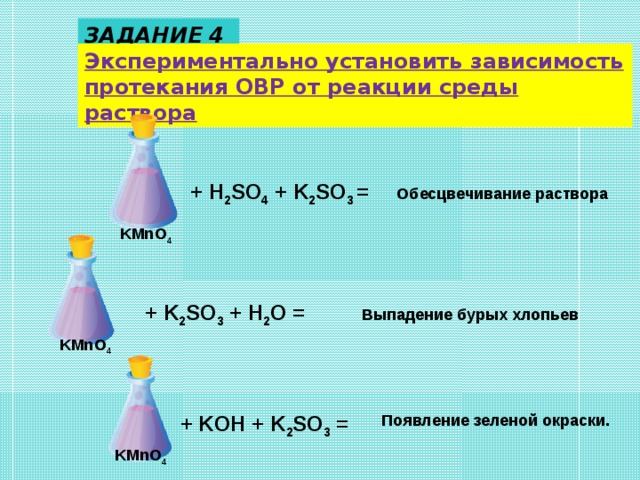
Инструкция группе № 4
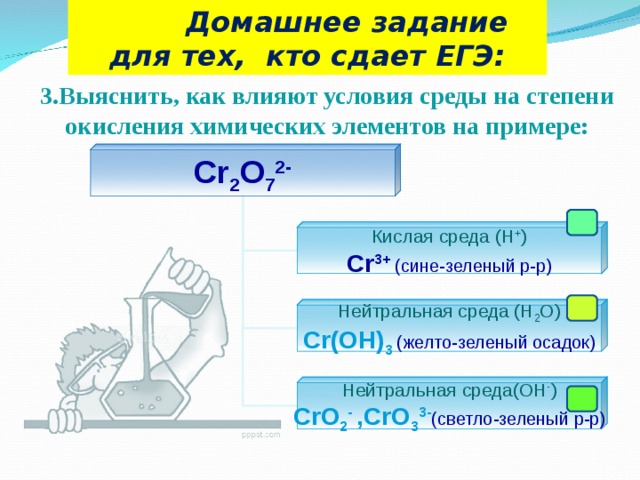
Цель: установить зависимость протекания процессов окислительно-восстановительных реакций в различных средах.
Налить в пробирку 1-2 мл перманганата калия KMnO4, подкислить несколькими каплями раствора серной кислоты и добавить сульфита калия. Наблюдать исчезновение фиолетовой окраски, характерной для ионов MnO4 -. Запишите уравнение, используя метод электронного баланса. Реакция идет по схеме:
KMnO4 + K2SO3 + H2SO4→ MnSO4 + … + … (обесцвечивание раствора)
Налить в пробирку 1-2 мл перманганата калия KMnO4, добавить сульфита калия. Наблюдать через некоторое время выделение из раствора бурых хлопьев MnO2. Запишите уравнение, используя метод электронного баланса. Реакция идет по схеме:
KMnO4 + K2SO3 + H2O→ MnO2↓ + MnSO4 + … (выпадение бурых хлопьев)
Налить в пробирку 1-2 мл перманганата калия KMnO4, 1 -2 мл концентрированного раствора щелочи и добавить 4-5 мл сульфита калия. Наблюдать через некоторое время появление зеленой окраски, характерной для ионов MnO4 2-. Запишите уравнение, используя метод электронного баланса. Реакция идет по схеме:
KMnO4 + K2SO3 + КOН→ K2MnO4 + … + … (появление зеленой окраски).
{\displaystyle {\mathsf {2KMnO_{4}+5K_{2}SO_{3}+3H_{2}SO_{4}\rightarrow 6K_{2}SO_{4}+2MnSO_{4}+3H_{2}O}}}
{\displaystyle {\mathsf {2KMnO_{4}+3K_{2}SO_{3}+H_{2}O\rightarrow 3K_{2}SO_{4}+2MnO_{2}+2KOH}}}
{\displaystyle {\mathsf {2KMnO_{4}+K_{2}SO_{3}+2KOH\rightarrow K_{2}SO_{4}+2K_{2}MnO_{4}+H_{2}O}}}
(Планируемый результат работы группы: составление ОВР с использованием метода электронного баланса, установление зависимости реакций окисления - восстановления от различных сред (кислой, нейтральной, щелочной), определение философского значения ОВР как типичного проявления таких явлений, как переход количественных изменений в качественные, закон единства и борьбы противоположностей).
- Почему одно и то же вещество в процессе окислительно-восстановительных реакций может давать различные продукты?
(Это зависит от активности реагента; от концентрации реагентов; от степени окисления реагентов; от среды раствора).
- Вы проделали лабораторный опыты, а теперь предложите вещество, с помощью которого можно очистить полотенце.
Демонстрационный опыт:
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH = 2Mn (CH3COO)2 +2CH3COOK + 7O2 + 12H2O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO2 + 3H2O2 + 2CH3COOH = Mn(CH3COO)2 + 2O2 + 4H2O (слайд 12)
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно – восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно – восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Домашнее задание: оформить проект, можно приготовить компьютерную презентацию «Зависимость протекания окислительно-восстановительных реакций от различных факторов»
VI. Рефлексия и подведение итогов.
по желанию выбрать себе фразу (несколько фраз), закончить ее (их) самостоятельно.
Сегодня я узнал(а)…______________________________________________________
Было интересно…_______________________________________________________
Было трудно…__________________________________________________________
Я понял(а), что…__________________________________________________________
Теперь я могу…__________________________________________________________
Я научился(ась)…_____________________________________________________
Инструкция группе № 1.
Цель: установить зависимость протекания ОВР от активности реагентов.
В четыре пробирки налить по 2-3 мл раствора соляной кислоты. В пробирки соответственно опустить цинк, алюминий, медь. Какие металлы реагируют с кислотой? Сделать вывод, составить окислительно-восстановительные реакции, используя метод электронного баланса.
Инструкция группе № 2.
Цель: установить зависимость процессов окисления и восстановления от степени окисления реагентов.
1. В пробирку налить 2-3 мл раствора сульфата железа (II) и туда же добавить иодид калия и крахмальный клейстер. Изменился ли цвет смеси? Идет ли данная реакция?
2. Налить в пробирку 2-3 мл раствора хлорида железа (III) и туда же добавить несколько капель раствора иодида калия и крахмальный клейстер. Что наблюдаете? Как изменится окраска раствора? Запишите уравнение, используя метод электронного баланса по схеме:
 FeCl3+KI FeCl2+I2+KCl
FeCl3+KI FeCl2+I2+KCl
Инструкция группе № 3.
Цель: установить зависимость протекания окислительно-восстановительных реакций от концентрации реагентов.
Положить в две пробирки по кусочку меди. В одну из них прилить 2-3 мл разбавленной азотной кислоты, в другую – концентрированной. При необходимости немного нагреть пробирки, соблюдая правила ТБ. Наблюдать выделение газов, обратить внимание на их цвет. Какой газ образуется в первой пробирке, какой во второй? Сделать вывод, составить окислительно-восстановительные реакции, используя метод электронного баланса.
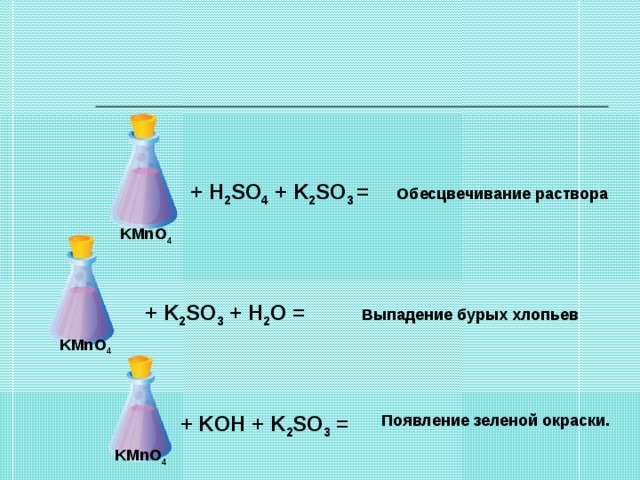
Инструкция группе № 4
Цель: установить зависимость протекания процессов окислительно-восстановительных реакций в различных средах.
Налить в пробирку 1-2 мл перманганата калия KMnO4, подкислить несколькими каплями раствора серной кислоты и добавить сульфита калия. Наблюдать исчезновение фиолетовой окраски, характерной для ионов MnO4 - . Запишите уравнение, используя метод электронного баланса. Реакция идет по схеме:
KMnO4 + K2SO3 + H2SO4→ MnSO4 + … + …
Налить в пробирку 1-2 мл перманганата калия KMnO4, добавить сульфита калия. Наблюдать через некоторое время выделение из раствора бурых хлопьев MnO2. Запишите уравнение, используя метод электронного баланса. Реакция идет по схеме:
KMnO4 + K2SO3 + H2O→ MnO2↓ + MnSO4 + …
Налить в пробирку 1-2 мл перманганата калия KMnO4, 1 -2 мл концентрированного раствора щелочи и добавить 4-5 мл сульфита калия. Наблюдать через некоторое время появление зеленой окраски, характерной для ионов MnO4 2-. Запишите уравнение, используя метод электронного баланса. Реакция идет по схеме:
KMnO4 + K2SO3 + КOН→ K2MnO4 + … + …