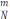Муниципальное казенное общеобразовательное учреждение
Гвазденская средняя общеобразовательная школа
Бутурлиновского муниципального района Воронежской области
Разработка занятия элективного курса
по химии
в 11 классе
Реакции в растворах электролитов
(изучение темы при подготовке обучающихся к сдаче ЕГЭ, базовый уровень)
подготовила
учитель химии
Гайворонская Татьяна Михайловна
с. Гвазда
2016-2017 уч. год
Тема: «Реакции в растворах электролитов»
(изучение темы при подготовке обучающихся к сдаче ЕГЭ)
базовый уровень
Цель:
- подготовить обучающихся к решению заданий по теме «Реакции в растворах электролитов»для сдачи ЕГЭ
Задачи.
Обучающие:
повторить понятия:
- электролиты и неэлектролиты
-сильные и слабые электролиты
- реакции ионного обмена
- качественные реакции на распознавание веществ
- закрепить навыки решения задач на избыток и недостаток, массовую долю растворенного вещества
Ввести понятия:
константа диссоциации(Кд)
водородный показательpH
Развивающие:
- показать в сравнении электролиз расплавов и растворов электролитов
- подвести к пониманию значения определения pHв практической деятельности
-развивать логическое мышление в процессе решения качественных и расчетных задач
Воспитывающие:
- продолжить воспитание уважительного отношения к процессу познания, формирование устойчивых учебных навыков
Этапы занятия
І. Повторение теоретического материала о теме «Реакции в растворах электролитов» в ходе фронтальной беседы
ІІ. Практическая часть
III. Тестирование с выбором правильного ответа по итогам повторения теоретического материала
IV. Анализ ошибок, допущенных учащимися
Виды заданий для учащихся
1.Вопросы для повторения теоретического материала:
1. Электролиты и неэлектролиты
2.Электролитическая диссоциация
3.Механизм диссоциации электролитов с ионной химической связью и полярной ковалентной химической связью
4. Основные положения теории электролитической диссоциации
5. Диссоциация растворов кислот, щелочей, солей
6.Степень электролитической диссоциации. Сильные и слабые электролиты
7. Константа диссоциации (Кд).
8.Ионное произведение воды. Водородный показатель рН и его значение в практической деятельности.
9.Реакции ионного обмена
10.Химические свойства кислот, оснований, солей с точки зрения теории электролитической диссоциации
11. Характерные качественные реакции на определение ионов
ІІ. Задания для практической части занятия
Вариант І
Опытным путем, не используя другие реактивы, определите, в какой из четырех пронумерованных колб находятся растворы следующих веществ: гидроксида бария,сульфата цинка, карбоната натрия, серной кислоты.Запишите уравнения необходимых реакций
Вариант ІІ
Опытным путем определите, в какой из трех пронумерованных колб находятся следующие твердые вещества: карбонат калия, силикат калия, хлорид калия. Запишите уравнения необходимых реакций
Вариант ІІІ
Опытным путем, не используя другие реактивы, определите, в какой из четырех пронумерованных колб находятся растворы следующих веществ: азотной кислоты,карбоната калия, нитрата серебра хлорида бария. Запишите уравнения необходимых реакций
Вариант ІV
В пробирках находятся растворы нитратов марганца (ІІ), стронция, свинца и цинка. Как, используя разбавленные растворы серной кислоты и гидроксида натрия, определить эти соли.
Тесты с выбором правильного ответа по итогам повторения теоретического материала
Вариант І
Укажите вещество, раствор которого проводят электрический ток:
хлорид натрия; 2) сахар; 3)кислород;4) этиловый спирт
Укажите, как протекает диссоциация серной кислоты:
H2SO4 ↔ 2 H+ + SO2-4 2) І.ступень H2SO4 ↔ H+ + H SO-4
ІІ. ступеньHSO-4↔ H+ + SO2-4
Укажите слабый электролит:
гидроксид натрия; 2) угольная кислота; 3) азотная кислота; 4) нитрат натрия
Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между азотной кислотой и гидроксидом бария соответственно равны:
1) 10 и 3; 2) 12 и 3; 3) 10 и 4; 4) 12 и 4
5. Укажите, в каком случае произошла реакция ионного обмена, идущая до конца:
N2 + 3H2→ 2NH3; 3) KCl + NaNO3 → KNO3 + NaCl
CaCl2 + K2CO3 → KCl + CaCO3; 4) CaO + CO2 → CaCO3
6. Вычислите массу гидроксида меди (ІІ), который может полностью прореагировать с 200 г раствора серной кислоты, массовая доля кислоты в котором равна 4,9%
1) 200 г; 2) 4,9 г; 3) 9,8 г; 4) 98 г.
Вариант ІІ
Укажите формулу для определения степени электролитической диссоциации:
ɑ= 
 ; 2) ɑ=
; 2) ɑ= 
 ; 3) ɑ=
; 3) ɑ= 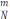
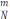 ; 4) ɑ=
; 4) ɑ= 
 , где ɑ - степень электролитической диссоциации; N–общее число исходных молекул, введенных в раствор (расплав), n – число молекул, распавшихся на ионы, m–масса электролита, введенного в раствор.
, где ɑ - степень электролитической диссоциации; N–общее число исходных молекул, введенных в раствор (расплав), n – число молекул, распавшихся на ионы, m–масса электролита, введенного в раствор.
Укажите, как протекает диссоциация гидроксида кальция:
Ca(OH)2↔ Ca2++ 2OH-; 2) І. ступеньCa(OH)2↔ Ca(OH)+ + OH-
ІІ. ступень Ca(OH)+↔Ca2+ + OH-
Укажите сильный электролит:
сероводородная кислота; 2) гидроксид аммония; 3)уксусная кислота;4)гидроксид калия
4. Реакцией ионного обмена, идущей до конца, является взаимодействие
1) сульфата аммония и хлорида бария
2) серной кислоты и нитрата натрия
3) сульфата натрия и соляной кислоты
4) нитрата калия и сульфата натрия
5. В качестве катионов только ионы H+образуются при диссоциации:
1) Ba(OH)2; 2) NaHCO3; 3) H2SO4; 4) K2HPO4
6. Вычислите массовую долю азотной кислоты в растворе, если известно, что кислота, содержащаяся в 200 гэтого раствора, полностью прореагировала с 4г гидроксида натрия.
1) 2%; 2) 3,15%; 3) 31,7%; 4) 3,17%
Вариант ІІІ
1.Степень диссоциации вещества в растворе составляет 95%. Вещество является:
1) сильным электролитом; 2) электролитом средней силы 3) слабымэлектролитом; 4) неэлектролитом
2.Укажите ионы, придающие окраску раствору:
Са2+; 2) Сu2+; 3) SO42-; 4)NO3-
3.Какие ионы содержаться в растворе нитрата бария:
Ba2++ NO32- 2) Ba++ NO3- 3) Ba2++2 NO3-4) 2Ba++ NO32-
4.Укажите, в каком случае произошла реакция ионного обмена, идущая до конца:
Cu(NO3)2 + 2KCl → CuCl2 + 2KNO3;
Na2SO4 + ZnCl2 → ZnSO4 +2NaCl;
LiOH + HNO3 → LiNO3 + H2O;
2ZnS + 3O2 → 2ZnO + 2SO2↑
5.В качестве анионов только ионы ОН- образуются при диссоциации:
Mg(OH)Cl; 2) NaOH; 3) Сu2(OH)2CO3; 4) (NH4)2HPO4
6.Какую массу соли можно получить, если для реакции взять 5,6г гидроксида калия и 6,5 г азотной кислоты:
1) 10,4г; 2) 0,1г; 3) 10,1г; 4) 5,6г
Вариант ІV
1. Укажите ионы, придающие окраску раствору:
1)К+; 2)Zn2+; 3)Ni2+; 4) Cl-
2. Константа диссоциации зависит
А) от температуры, природы электролита, концентрации электролита;
Б)от температуры, природы электролита и растворителя
1) верно только А; 3) верны оба ответа;
2) верно только Б; 4)оба ответа не верны
3. Укажите вещество, с которым не будет реагировать гидроксид натрия
1) раствор хлорида аммония; 3) раствор соляной кислоты;
2) раствор хлорида цинка; 4) раствор 4хлорида калия
4. Уравнение химической реакции, схема которой
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2↑,
можно изобразить в виде сокращенного ионного уравнения:
2H+ + С O32- → H2O + CO2↑;
H+ + OН-→H2O;
CaCO3 + 2H+ → Ca2+ + H2O + CO2↑;
CaCO3→Ca2++ CO2↑
В разбавленном растворе при диссоциации 1 моль сульфата железа (III) образуется
1) 2 моль ионов; 2) 3 моль ионов 3) 4 моль ионов; 4) 5 моль ионов
6. К раствору, в котором находится 43,6 г нитрата алюминия, прилили раствор, содержащий 16 г гидроксида натрия. Рассчитайте массу образовавшегося осадка.
1) 15,6г; 2) 10,4 г; 3)31,2 г; 4)57,75 г
Решение практической части
Вариант I
Из каждой колбы отбираем пробы в 4 пробирки и попарно сливаем содержимое пробирок. Результаты сводятся в таблицу
|
| 1 | 2 | 3 | 4 |
| 1 | - | белый осадок | плотный кристаллический осадок | белый осадок |
| 2 | белый осадок | ![]() - -
| белый осадок | изменений нет |
| 3 | плотный кристаллический осадок | белый осадок | ![]() - -
| газ |
| 4 | белый осадок | изменений нет | газ | - |
| вывод | Ba(OH)2 | ZnSO4 | Na2CO3 | H2SO4 |
Уравнения реакций
(1+2) Ba(OH)2 + ZnSO4 → BaSO4↓ + Zn(OH)2↓
(1+ 3) Ba(OH)2 + Na2CO3→BaCO3↓+ 2NaOH
(1+4)Ba(OH)2 +H2SO4 → BaSO4↓+ 2H2O
(2+3) ZnSO4 + Na2CO3 → ZnCO3↓ + Na2SO4
(3+4) Na2CO3 + H2SO4 → Na2SO4 + СО2↑ + H2O
Вариант IІ
Из каждой колбы отбираем пробы и во все пробы приливаем раствор соляной. В одной из пробирок выделился газ, следовательно, в ней находится карбонат калия. В другой пробирке выпал студенистый осадок, следовательно, в ней - силикат калия. В оставшуюся пробирку приливаем раствор нитрата серебра, выпадает белый творожистый осадок – хлорид серебра
Уравнения реакций
К2CO3 + 2HCl → 2KCl + CO2↑+ H2O
K2SiO3 + 2HCl → 2KCl + H2SiO3↓
KCl + AgNO3 → KNO3 + AgCl↓
Вариант IІІ
Из каждой колбы отбираем пробы в 4 пробирки и попарно сливаем содержимое пробирок. Результаты сводятся в таблицу
|
| 1 | 2 | 3 | 4 |
| 1 | изменений нет | газ | изменений нет | изменений нет |
| 2 | газ | ![]() - -
| осадок | плотный кристаллический осадок |
| 3 | изменений нет | осадок | ![]() - -
| творожистый осадок |
| 4 | изменений нет | плотный кристаллический осадок | творожистый осадок | - |
| вывод | HNO3 | К2CO3 | AgNO3 | BaCl2 |
Уравнения реакций
(1+2) 2HNO3 +К2CO3→ 2KNO3 + CO2↑+ H2O
(2+3)К2CO3 + Ag NO3 → 2KNO3 + Ag2CO3↓
(2+4) К2CO3 + BaCl2 → BaCO3↓+ 2KCl
(4+3) 2Ag NO3 + BaCl2 →Ba(NO3)2 + 2AgCl↓
Вариант IV
Для каждого из опытов отбираем пробы растворов из пробирок
| Реагент | Mn(NO3)2 | Sr(NO3)2 | Pb(NO3)2 | Zn(NO3)2 |
| NaOH | Mn(OH)2↓ розовый, темнеет на воздухе | - | Pb(OH)2↓ белый | Zn(OH)2↓ белый студенистый
|
| Избыток NaOH | - | - | - | Na2[Zn(OH)4] |
| H2SO4 | - | SrSO4↓ белый | PbSO4↓ белый | - |
Уравнения реакций
2NaOH + Mn(NO3)2→ Mn(OH)2↓ + 2Na NO3
2NaOH + Pb(NO3)2→ Pb(OH)2↓ + 2Na NO3
2NaOH + Zn(NO3)2→ Zn(OH)2↓ + 2Na NO3
Zn(OH)2 + 2NaOHизб. → Na2[Zn(OH)4]
H2SO4 + Sr(NO3)2 → SrSO4↓ + 2HNO3
H2SO4 + Pb (NO3)2 → Pb SO4↓ + 2HNO3
Ответы на задания с выбором ответа по итогам повторения теоретического материала
| Вариант | 1 | 2 | 3 | 4 | 5 | 6 |
| I | 1 | 2 | 2 | 1 | 2 | 3 |
| II | 1 | 2 | 4 | 1 | 3 | 2 |
| III | 1 | 2 | 3 | 3 | 2 | 3 |
| IV | 3 | 2 | 4 | 3 | 4 | 2 |
Анализ проведенного занятия
В ходе занятия были обобщены и скорректированы теоретические знания учащихся о теме « Теория электролитической диссоциации».
Фронтальный опрос показал, что все учащиеся владеют теоретическими знаниями о реакциях в растворах электролитов.
В ходе выполнения химического эксперимента учащиеся закрепили знания о качественных реакциях на определение ионов. Продемонстрировали умение выстраивать логические цепочки, анализировать полученные экспериментальные результаты и делать обоснованные выводы.
Однако привыполнении практической и тестовой частей занятия возникли некоторые проблемы.
При выполнении тестового задания учащихся возникли следующие затруднения:
задание на определение ионов, придающих окраску раствору;
задание на определение реакций ионного обмена, идущих до конца (в варианте I за реакции ионного были приняты ответы 1 и 4)
задачу на избыток и недостаток не решил 1 ученик.
При выполнении практической части вызвало задание IV варианта на распознавание амфотерного гидроксида цинка.
Таким образом, в основном поставленные цели и задачи достигнуты, выявлены проблемы, над устранением которых следует поработать на следующем занятии.