XXIX Республиканская научно-практическая конференция молодых исследователей
«Шаг в будущее»
Особенности воздействия кадмия и свинца на синаптосомы головного мозга крыс.
Симпозиум. Естественные науки и современный мир
Секция – Общая биология.
Выполнила ученица:
10 «б» класса
МБОУ «Гимназия №11»
Рашидова Хадиджа Ибнуаббасовна
Руководитель:
Атабаева Инна Гамзатовна,
Учитель биологии
МБОУ «Гимназия №11»
Соавтор:
Дурпалова Издаг Шахмандаровна,
Учитель биологии
МБОУ «Гимназия №11»
Республика Дагестан, город Махачкала
Аннотация
Загрязнение окружающей среды тяжёлыми металлами, постоянная интоксикация человека в условиях неблагоприятной экологической обстановки делает актуальным вопрос о поиске эффективных антитоксикантов при отравлении солями тяжёлых металлов как животных, так и человека. Тяжелые металлы рассматриваются Всемирной Организацией Здравоохранения как наиболее опасные для здоровья людей токсиканты. Токсичность ионов непереходных металлов Pb2+, Hg2+, CH3Hg+ и Cd2+ обусловлена образованием комплексов с аминокислотами и другими биомолекулами, содержащими концевые тиогруппы. (Satarug, 2012).
Информация, касающаяся молекулярных механизмов токсичности тяжелых металлов, довольно фрагментарная, тем не менее, есть данные, демонстрирующие, что отравление тяжелыми металлами вызывает окислительный стресс на клеточном уровне (Cuypers, et al., 2012).
Еще одним аспектом токсического действия тяжелых металлов является их способность активировать процессы перекисного окисления липидов (ПОЛ). Ведущую роль в обезвреживании продуктов ПОЛ играет антиокси-дантная система защиты организма, коими являются селено-зависимые ферменты и селенопротеины. В услови-ях селенодефицита и неблагоприятной экологической обстановки встает во-прос о необходимости применения селенсодержащих препаратов, оказываю-щих гепатопротекторное, нефропротекторное и антитоксическое действие при отравлении различными ксенобиотиками, в том числе тяжелыми метал-лами (Кильметова, и др., 2012).
В настоящее время наиболее распространенными токсикантами окру-жающей среды являются соли ртути, кадмия и свинца, которые при поступ-лении в организм млекопитающих стимулируют окислительный стресс и конкурируют с эссенциальными металлами (цинк, марганец, медь, железо, кальций и др.), что вызывает нарушение функций многих белков и фермен-тов. Поэтому интоксикация тяжелыми металлами в конечном итоге способ-ствует развитию сердечно-сосудистых заболеваний, неврологических нару-шений, поражений печени и почек, а также вызывает канцерогенез (Ikediobi, et al., 2004).
Актуальность темы. Кадмий и свинец являются одними из наиболее токсичных и опасных тяжелых металлов. Как чрезвычайно распространенные во внешней среде токси-ческие вещества они включены в списки приоритетных загрязняющих веществ многими международными организациями, в том числе Всемирной организацией здравоохранения (ВОЗ), Программой ООН по охране окружаю-щей среды (ЮНЕП), Европейской экономической комиссией (Санакин,1999).
Современные эпидемиологические данные убедительно свидетельствуют о том, что неорганический свинец в экологически обусловленных дозах оказывает неблагоприятное влияние на здоровье людей, что проявляется нарушением умственного и физического развития, психофизиологическими нарушениями, снижением интенсивности синтеза гема, развитием анемий, повышением порога слухового восприятия и снижением уровня витамина D в крови (Снакин, 1999; Xinlaras, 1999). Особое внимание уделяется нейроток-сическим эффектам свинца и кадмия, поскольку нарушения когнитивной сферы у детей и взрослых сохраняются даже после снижения содержания тяжелых металлов в крови (Needleman et al., 1990; Grandjean,1993).
В литературе имеются многочисленные сведения о попытках установления критических уровней тяжелых металлов, при которых происходят физиологические, морфологические и другие изменения в организме животных Баранников, 2006; Валова, 2007). Нагрузка организма ионами тяжелых металлов представляет собой стресс, который сопровождается активацией процессов свободнорадикального окисления в тканях, интенсификации ПОЛ в биомембранах и включением систем антиоксидантной защиты, в том числе глутатионовой (Sadiq, et al., 2012).
В связи с этим изучение действия данных токсикантов, поиск и разработка эффективных и доступных средств для лечения и профилактики отравлений человека, вызванных кадмием и свинцом, является актуальной задачей.
Цель работы: установление особенности воздействия кадмия и свинца на синаптосомы головного мозга крыс в условиях инкубации в среде содержащий тяжелые металлы методом собственной и зондовой флуоресценции.
Задачи:
- изучить собственную флуоресценцию мембран синаптосом мозга в контроле и в среде инкубации с различным содержанием ионов кадмия и свинца.
- исследовать спектры флуоресценции мембран синаптосом мозга инкубированных в системе генерации свободных радикалов.
- исследовать полярность и микровязкость в области анулярных и общих липидов мембран синаптосом мозга методом флуоресцентных зондов (АНС, пирен) в контроле и инкубированных с ацетатом свинца
- обработать, анализировать и оформить полученные результаты;
Практическая значимость. Полученные экспериментальные данные о влиянии хлорида кадмия и ацетата свинца на мембраны синаптосом мозга, могут быть использованы в лечебных и профилактических целях при отравлениях тяжелыми металлами.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
В основе токсического действия тяжелых металлов лежит повреждение клеток, сопровождающееся их функциональными, либо структурно-функ- циональными изменения. Разнообразие формирующихся при этом эффектов со стороны целостного организма обусловлено сложностью организации кле-ток, многообразием клеточных форм, составляющих организм. Сформиро-вавшиеся в процессе эволюции особенности структуры и функции отдельных клеточных типов, формирующих различные органы и ткани, настолько суще-ственны, что чувствительность различных клеток к токсикантам может отли-чаться в тысячи раз (Sears, 2013).
Тем не менее, живое объединено общностью фундаментальных свойств, а это позволяет выделить и некоторые общие механизмы, лежащие в основе цитотоксического действия ксенобиотиков. К числу важнейших можно отне-сти следующие:
- нарушение энергетического обмена;
- нарушение гомеостаза внутриклеточного кальция;
- активация свободно-радикальных процессов в клетке;
- нарушение процессов синтеза белка и клеточного деления;
- повреждение клеточных мембран;
- вытеснением необходимых металлов из их активных мест связывания ток-сичным металлом;
- связыванием части макромолекулы, необходимой для нормальной
жизнедеятельности организма (Passada, 1983).
Необходимо отметить, что все эти механизмы тесно связаны друг с дру-гом. Порой один из них является пусковым, но в дальнейшем особую значи-мость для судьбы поврежденной клетки приобретают другие. Очень часто два или несколько из упомянутых механизмов связаны между собой по типу "по-рочного круга".
Первый возможный механизм развития окислительного стресса при ин-токсикации тяжелыми металлами связан с образованием свободных радика-лов. Они запускают окисли-тельный стресс опосредованно за счет вытеснения из белков и ферментов редокс-активных металлов (железа и меди). Тяжелые металлы вытесняют железо из белков, которое за тем участвует в реакции Фентона, приводя к образованию высокоактивного гидроксильного радикала (Cuypers, et al., 2010).
Кроме этого, тяжелые металлы, в частности, кадмий и свинец, в связан-ной или несвязанной формах, участвуют в повреждении митохондрий. (Cannino, et al., 2009).
Ключевым моментом запуска апоптоза является выход цитохрома из митохондриальной мембраны (Cuypers, et al., 2010).
Второй механизм прооксидантного действия тяжелых металлов связан с подавлением антиоксидантной защиты организма. Например, в печеночных клетках крыс тяжелые металлы, в том числе кадмий, ингибируют цитозоль-ную Cu/Zn-СОД [32], ГПО и ГР [34]. Механизм ингибирования Cu/Zn-СОД основан, скорее всего, на вытеснении эссенциальных ионов меди и цинка из активного центра фермента тяжелыми металлами [32], а ингибирование ГПО и ГР - на связывании тяжелых металлов с восстановленным глутатионом (GSH) в активном центре этих ферментов (Miller et al., 1990).
Следовательно, интоксикация тяжелыми металлами приводит, с одной стороны, к запуску свободно-радикального окис-ления, а с другой стороны, к подавлению активности антиоксидантной защи-ты организма, следствием чего является нарушение редокс-баланса в клетках, окислительное повреждение клеточных структур и развитие патологических процессов в различных органах и тканях (печени, почках, сердечно-сосудистой и нервной системах, поджелудочной железе и пр.) (Lopez, et al., 2006).
Кадмий был открыт в 1817 году Ф.Штромейером (Геттинген, Герма-ния). Название элемента произошло от латинского cadmia – цинковая руда. Очевидно, это связано с тем, что он в больших количествах обнаруживается в составе цинковых руд в виде минерала гринокита (CdS).
Значение кадмия для окружающей среды определяется двумя его свой-ствами: 1) сравнительно высоким давлением паров, определяющим легкость его испарения, например, при плавлении или при сгорании углей;
2) высокой растворимостью в воде, особенно при слабокислой реакции среды.
Широкое распространение кадмия в топливах, удобрениях, рудных от-валах способствует постоянному увеличению его содержания в окружающей среде. В результате этого кадмиевое отравление становится основной про-блемой для проживающих в промышленных зонах (Rothbaum, et al., 1986).
Установлено, что примерно 80% кадмия поступает в организм человека с пищей, 20% - через легкие при дыхании и курении (Позняковский, 1996). В одной сигарете содержится 1,5-2,0 мкг кадмия.
Поглощенный кадмий аккумулируется в первую очередь в печени. Кадмий также сорбируется и другими органами. Некоторое количество элемента поступает в кровь. При хроническом воздействии происходит разрушение печени, силь-ная дисфункция почек в связи с протеиноурией (появление белка в моче). За-болевание ведет к смерти. Болезнь сопровождается болями в спине и ногах, как результат декальцификации костей, которая приводит к их ломкости.
Никакой специальной терапии для лечения кадмиевого отравления нет, а хелатирующие агенты, которые используются при отравлении некоторыми другими металлами в целях ускорения их выведения из организма, могут только перераспределить кадмий в почки (что вызовет их разрушение). Обильный прием цинка, кальция, фосфатов, витамина D и белковая диета мо-гут несколько ослабить отравление
Токсичные свойства свинца были известны еще со времен древних гре-ков, где он являлся профессиональным токсикантом для шахтеров, а также применялся в качестве добавки для созревания вина.
Во времена расцвета Римской империи были введены в употребление свинцовые трубы для водопроводов и свинец содержащие сплавы, применяе-мые при изготовлении кухонной посуды и сосудов для питья. В ходе иссле-дований костных тканей из захоронений того времени было выявлено высо-кое содержание свинца, позволяющее сделать вывод о хроническом поступ-ление элемента в организм людей. Ряд исследователей предполагает, что упа-док Римской империи в значительной степени связан со свинцовым отравле-нием многих ее граждан (Дабахов, и др., 2005).
В наше время интерес к элементу поддерживается в связи с загрязнени-ем атмосферы промышленными выбросами, использованием тетраэтилсвинца как добавки к бензину, распространением отравлений свинцом в таких произ-водственных процессах, как эмалирование, изготовление батареек, при использовании детьми свинцовых красок
Среднее содержание свинца в продуктах питания составляет 0,2 мг/кг (Позняковский В.М., 1996). Особо высокое содержание свинца в сельскохозяйственной продукции, выращенной вблизи промышлен-ных центров, крупных автомагистралей (Хэммонд, Фолкс, 1993).
Главным источником загрязнения организма свинцом является пища. Однако, абсорбция свинца невелика по причине образования нерастворимых фосфатов и карбонатов, откладывающихся в костях. Остальной свинец выводится с фекалиями. У взрослых на 95% носителем свинца является скелет, у детей - на 70%. (Эйхлер, 1993).
Исследования на животных показали, что на поглощение свинца через кишечник влияет состав диеты и что поглощение свинца снижается в присутствии кальция, железа. Фосфатов и витамина D. Период полувыведения свинца из организма составляет 10-20 лет.
Острое свинцовое отравление приводит сначала к потере аппетита и рвоте. Главной мишенью свинцового токсикоза является кроветворная и нервная системыНекоторые работы указывают на влияние свинца на целостность мембраны в эритроците (Sadiq, et al., 2012).
Свинец действует на периферическую и центральную нервную систему. При отравлении наблюдается паралич нервов сгибающих и разгибающих ко-нечностей (свинцовый паралич). Нарушение центральной нервной системы вызывает конвульсии и кому с летальным исходом. В опытах на животных даже умеренные дозы свинца вызывало изменение мозговых функций, таких, как возбудимость коры головного мозга. Особо сильное воздействие свинец оказывает на развивающуюся нервную систему детей и новорожденных. Даже при низком уровне поступления свинца в организм у детей может отмечаться гиперактивность, пониженная концентрация внимания, умственные расстрой-ства, сужение поля зрения. При более высоких уровнях воздействия как у де-тей, так и у взрослых отмечается энцефалопатия (Дабахов, и др., 2005).
Синапс: строение, функции
Согласно классическому определению, синапсы представляют собой специализированные функциональные контакты между клетками возбуди-мых тканей. Термин «синапс» ввел Ч. Шеррингтон в 1897.
Синапсы - это структуры, предназначенные для передачи импульса с одного нейрона на другой или на мышечные и железистые структуры. Синап-сы обеспечивают проведение импульса по цепи нейронов, т. е. определяют направление проведения импульса. Только импульс, достигающий нервных окончаний аксона, может с помощью синапсов передать возбуждение на дру-гой нейрон, мышечную или железистую клетку. В зависимости от способа передачи импульса синапсы бывают химическими или электрическими (Brady, et al., 2011).
Ненасыщенные кислоты мозга могут содержать от 1 до 6 двойных свя-зей. Особенностью, липидов мозга является относительно большое содержа-ние длинноцепочечных полиеновых кислот 20:4, 22: 5, 22:6.
Мозг млекопитающих содержит высокий уровень докозогексаеновой кислоты (ДГК); она является главным компонентом жирнокислотного соста-ва фосфолипидов серого вещества мозга человека (Ашмарин, и др., 1996).
Изменения концентрации ДГК в мозге сопровождаются нарушениями познавательной и поведенческой активности животных. Установлено, что при уменьшении содержания ДГК в мозге крыс наблюдается ухудшение зритель-ных и обонятельных функций при выполнении ими обучающих тестов. До-полнительно к ухудшению выполнения задач ассоциативного обучения у та-ких крыс обнаруживаются потеря пространственной памяти и ослабление обоняния. Таким образом, можно заключить, что уменьшение содержания ДГК в мозге затрагивает существенные функции высшей нервной деятельно-сти. В мозге имеются регуляторные механизмы, поддерживающие степень ненасыщенности и специфический жирнокислотный состав липидов (Хухо, 1990).
В синаптосомах велико содержание жирных кислот – С 22:6, а в мие-лине высок процент моноеновых кислот – 18:1. Возможно, что высокое со-держание докозагексаеновой кислоты в синаптосомах необходимо для актив-ного транспорта ионов, так как активность Na+, К+-АТФазы в них зависит от присутствия полиеновых кислот в фосфолипидах. В мозге имеются регуля-торные механизмы, поддерживающие степень ненасыщенности и специфич-ность жирнокислотного состава в липидах (Антонов, 1994).
Флуоресценция
Люминесценция – широко распространенный в природе вид излучения. Она возникает в результате поглощения веществом энергии возбуждения и перехода его частиц из основного в возбужденное состояние. Таким образом, люминесценция – свечение вещества, возникающее в результате электронно-го перехода в этих частицах при их возвращении из возбужденного в основ-ное состояние. Если возбуждение происходило за счет поглощения электро-магнитного излучения в оптической области, то испускание носит название фотолюминесценции (Lakowicz, 2006).
Флуоресценция является мгновенно затухающим свечением: ее длитель-ность составляет ~10-9 с. Спектр люминесценции – это функция распределе-ния излучаемой веществом энергии по длинам волн или частотам. Каждой полосе поглощения первого электронного возбужденного состояния соответ-ствует полоса флуоресценции. Фотолюминесценция возникает за счет погло-щаемой энергии возбуждающего света (Левшин, Салецкий,1994).
Спектры испускания сильно изменяются и зависят как от химической структуры флуорофора, так и от растворителя, в котором флуорофор рас-творен. Спектры некоторых соединений, таких как перилен, имеют четкую структуру, обусловленную отдельными колебательными уровнями энергии основного и возбужденного состояний (Lakowicz, 2006).
Методы флуоресцентного анализа в исследованиях белков применяют-ся для определения изменения вторичной структуры белков под влиянием внешних факторов, под воздействием лекарственных препаратов, для оценки окислительных повреждений белков, для исследования белковой денатура-ции, при диагностике заболеваний, в исследованиях белковых конъюгатов. Динамика конформационных перестроек белковых молекул под действием денатурирующих агентов также изучается методами флуоресцентной спек-троскопии как по собственной триптофановой флуоресценции, так и с помо-щью флуоресцентных зондов и меток (наномаркеров), связывающихся с бел-ками (Суковатая и др., 2008).
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Выделение синаптосом из головного мозга
После декапитации животного (или в процессе хирургического вмеша-тельства) требуемую область мозга быстро иссекают (не более 20 с) и поме-щают в среду выделения (0,32 М сахароза, 1 мМ ЭДТА, 0,01 М Tris HCl, рН 7,4). Ткань гомогенизируют (при 800 об./мин проводят 5 пассов пестика вверх вниз) и центрифугируют, постепенно увеличивая скорость до 1000 g в течение 4 мин. Осадок вновь ресуспендируют, гомогенизируют и осаждают; процедуру повторяют еще раз (супернатанты сохраняют). После последнего центрифугирования супернатанты объединяют и снова центрифугируют 20 мин при 15000 g для получения “грубого” осадка МХ, содержащего синапто-сомы.
Для отделения синаптосом осадок ресуспендируют в среде выделения и наслаивают на градиент сахарозы: 1,2М, 0,8М, 0,32 М сахароза, 50 мкМ ЭДТА, 0,01 М Tris HCl, рН 7,4, и 7,5% центрифугируют при 100000 g с ис-пользованием ультрацентрифуги Beckman Coulter L-90K с использованием бакет ротора SW 32.1 Ti в течение 60 мин. Верхняя полоса – миелин, интер-фаза между 1,2М, 0,8М сахарозы – синаптосомы, а осадок содержит свобод-ные МХ
Методика экспериментов для исследования суммарной и триптофановой флуоресценции
Плазму крови крыс на различных сроках экспозиции исследовались ме-тодом флуоресцентного анализа по спектрам суммарной и собственной трип-тофановой флуоресценции белка.
Исследования проводились с помощью спектрофлуориметра Флюорат-02-Панорама. Спектрально-флуоресцентные характеристики образцов полу-чены при комнатной температуре. Суммарная флуоресценция белков возбуж-далась светом с длиной волны λвозб = 280, триптофановая флуоресценция бел-ка возбуждалась светом с длиной волны λвозб = 295 нм и регистрировались в диапазоне 300 – 500 нм.
Полученные спектры обрабатывались в программе OriginPro 9.0
Методика эксперимента для исследования зондовой флуоресценции
Определение спектральных характеристик взаимодействия эритроци-тов, митохондрий и синаптосом с флуорофорами проводили на спектрофлуо-риметре Флюорат-02-Панорама.
Выбор флуоресцентных зондов осуществлялся, исходя из возможности одновременного сканирования глубинных и поверхностных слоев мембраны. В качестве флуорофоров были выбраны следующие соединения: пирен, 1-анилинонафталин-8-сульфонат (АНС),
Для оценки микровязкостных свойств липидной фазы мембраны эрит-ро-цитов рассчитывали коэффициенты эксимеризации пирена (I470/I370 и I470/I390), равные отношению максимумов интенсивностей флуоресценции эк-симерной формы зонда к мономерной при длинах волн возбуждающего света 280 и 334 нм. Процент индуктивно-резонансного переноса энергии с трипто-фана на пирен, позволяющий судить о белково-липидных взаимодействиях в мембране, рассчитывали по формуле: R=(1-I*330/I330)•100%, где I330 - интен-сивность собственной флуоресценции мембраны при возбуждении светом с длиной волны 280нм в отсутствии пирена, I*330 - интенсивность собственной флуоресценции мембраны при возбуждении светом с длиной волны 280 нм при добавлении пирена. Результаты выражали в условных единицах.
Статистическая обработка результатов
Статистическую обработку результатов осуществляли общепринятыми методами с использованием пакета прикладных программ Statistica 7.0. До-стоверность различий оценивали по непараметрическому критерию Манна-Уитни, с достоверностью Р
Структурно-функциональное состояние синаптосом при действии ионов тяжелых металлов
Полученные нами результаты по собственной и зондовой флуоресцен-ции (АНС, пирен) синаптосом в контроле и при инкубации в растворе с ко-нечной концентрацией 0,05-1 мМоль ацетата свинца (Pb(CH3COO)2), хлорида кадмия (CdCl2) и в системе генерации свободных радикалов (FeSO4 +H2O2) представлены на рис 1-17(ПРИЛОЖЕНИЕ) в таблице 1. (ПРИЛОЖЕНИЕ)
Математическую обработку полученных спектров проводили с помо-щью программного пакета Origin 9.0. Для отсечения «шумов» использовали Фурье фильтрацию. Также получены вторые производные спектров флуорес-ценции для определения характеристики индивидуальных полос флуорофо-ров.
Как видно из рисунков 1-15а(ПРИЛОЖЕНИЕ) при инкубации синаптосом среде содер-жащий тяжелые металлы интенсивность собственной (суммарной и трипто-фановой флуоресценции) снижается. Максимум интенсивности флуоресцен-ции для суммарной находится на 333нм, а типтофановой на 330нм. Следует отметить, что триптофановые остатки в мембранных белках синаптосом ха-рактеризуются гидрофобным состоянием и максимумом флуоресценции рав-ным 330-333нм (рис.1-15а).
Рис.1. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые про-изводные (б) при инкубации в 0,05 мМоль растворе CdCl2
Как видно из рисунков данное расположение максимума не зависит как от длительности экспозиции синаптосом, так и от концентрации ионов.
Рис.2. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые про-изводные (б) при инкубации в 0,1 мМоль растворе CdCl2
Известно, что флуоресценция белков в основном обусловлена аромати-ческими аминокислотами – триптофаном и тирозином. При λвозб = 280 и 295 нм для белков, содержащих триптофан и тирозин, положение максимума спектра флуоресценции не зависит от длины волны возбуждения, то есть спектр флуоресценции определяется только триптофановыми остатками (Burstein, 1973).
Рис.3. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые про-изводные (б) при инкубации в 0,5 мМоль растворе CdCl2
Считается, что тирозин в этой группе белков находится в не флуорес-цирующем состоянии вследствие образования водородной связи между гид-роксилом тирозина и карбоксильными группами соседних пептидных цепей. Аналогичная независимость положения максимума спектра флуоресценции отмечается, как для контроля, так и для инкубированных синоптосом [25].
Рис.4. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые про-изводные (б) при инкубации в 1 мМоль растворе CdCl2
Но в отличие от контрольных образцов, в спектрах суммарной флуо-ресценции синаптосом при действии тяжелых металлов наблюдается слабо различимый пик на 310нм. Данный пик соответствует флуоресценции амино-кислотных остатков тирозина (рис.2-3а, 10-11а).
Рис.5. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.05 мМоль растворе CdCl2
Факт появления в спектре флуоресценции тирозинового возгорания, при увеличении концентрации металлов в среде инкубации, говорит об кон-формационных изменениях структур мембранных белков сиаптосом. Данное предположение подтверждается тем, что при повышении концентрации ионов свинца, пик флуоресценции тирозина становится отчетливей (рис. 10-11а).
Рис.6. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.1 мМоль растворе CdCl2
Рис.7. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.5 мМоль растворе CdCl2
Интересно, что при концентрации ионов кадмия в среде инкубации 0,1-0,5 мМоль и свинца 0,05 мМоль интенсивность суммарной и триптофановой флуоресценции не зависит от времени экспозиции (рис.2-3а, 9а). Тогда как увеличение их концентрации до 0,5-1мМоль сопровождается максимальным падением интенсивности в более чем в 6 раз относительно контроля (рис. 4а, 10-11а).
Во вторых производных спектров суммарной флуоресценции кон-трольных образцов присутствуют 4 отрицательных пика на 310, 320, 330, 352нм. Пик на 310нм соответствует тирозиновым остаткам, а остальные трип-тофановым (рис. 1-4б, 9-11б).
Рис.8. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 1 мМоль растворе CdCl2
Рис.9. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые про-изводные (б) при инкубации в 0,05 мМоль растворе Pb(CH3COO)2
Рис.10. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе Pb(CH3COO)2
Уже при низких концентрациях (0,05мМоль) ионов тяжелых металлов в среде инкубации, во вторых производных спектрах флуоресценции, появляет-ся дополнительный отрицательный пик на 343нм (рис. 1б, 9б). Дальнейшее увеличение концентрации катионов не влияет на динамику отрицательных пиков в спектрах вторых производных флуоресценции (ри.2-4б, 10-11б).
Рис.11. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 1 мМоль растворе Pb(CH3COO)2
Во вторых производных спектров триптофановой флуоресценции в контроле присутствуют 3 отрицательных пика на 330, 345, 360нм. В спектрах флуоресценции синаптосом, инкубированных с ионами кадмия, отрицатель-ные пики обнаруживаются на 330, 340,352нм. Данное расположение отрица-тельных пиков сохраняется и при увеличении концентрации ионов кадмия (5б-8б).
Рис.12. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,05 мМоль растворе Pb(CH3COO)2
Такое расположение индивидуальных полос в спектрах вторых произ-водных предполагает, что действие тяжелых металлов сопровождается изме-нением пространственной структуры белковых молекул, на что указывает ди-намика отрицательных пиков относительно контроля (345→340нм, 360-352нм). Действие ионов кадмия не затрагивает «ядро» белковой глобулы, так как пик гидрофобно-расположенных триптофанилов (330нм) не изменяется в спектрах флуоресценции синаптосом в системе инкубации.
Рис.13. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,1 мМоль растворе Pb(CH3COO)2
В отличие ионов кадмия, действие ионов свинца на синаптосомы при-водит к появлению нового пика в спектрах вторых производных триптофано-вой флуоресценции. Сохраняется пики на 330нм, но появляется новый пик на 350нм, а остальные пики исчезают (12-15б).
Рис.14. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе Pb(CH3COO)2
Рис.15. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 1 мМоль растворе Pb(CH3COO)2
В отличие от действия тяжелых металлов, инкубация синаптосом в сре-де с генерацией свободных радикалов сопровождается снижением суммарной флуоресценции и длинноволновым сдвигом максимума на 337нм относи-тельно контроля (333нм). Наряду с этим во вторых производных практически исчезают основная масса отрицательных пиков за исключением слабовыра-женных на 310, 320, 330нм (рис. 16 а, б). (ПРИЛОЖЕНИЕ)
Рис.16. (ПРИЛОЖЕНИЕ) Суммарная флуоресценция синаптосом крыс (а) и ее вторые произ-водные (б) при инкубации в системе генерации АФК FeSO4 + Н2О2
Изменения в спектрах суммарной флуоресценции синаптосом в системе генерации АФК подтверждается и спектрами триптофановой флуоресценци-ей. Здесь также наблюдается длинноволновой сдвиг 330→336нм и исчезнове-ние во вторых производных отрицательных пиков за исключением пика на 330нм.
Рис.17. (ПРИЛОЖЕНИЕ) Триптофановая флуоресценция синаптосом крыс (а) и ее вторые про-изводные (б) при инкубации в системе генерации АФК FeSO4 + Н2О2
От свойств липидной фазы мембран, таких, как вязкость, поверхност-ный заряд, полярность, зависит работа мембранных ферментов и рецепторов (Shichir, 2014). Например, известно, что инкубация синаптасом в среде со-держащий 0,6 мкмоль кадмия, а свинца 2,1 мкмоль снижает активность NaK-АТФазы на 50% (Vujisi, et al., 2004).
В табл. 1 (ПРИЛОЖЕНИЕ) представлены результаты флуоресценции зонда АНС. При до-бавлении АНС к мембранам синаптосом мозга, инкубированных в среде со-держащей 0,1 мМоль ацетат свинца, интенсивность флуоресценции суще-ственно (30%) возрастает относительно контроля.
Известно, что квантовый выход АНС существенно возрастает с увели-чением центров связывания при деструктивных изменениях в белках и мем-бранах (Владимиров, Добрецов, 1980). В нашем случае такое увеличение цен-тров связывания зонда АНС с поверхностными участками синаптосом наблюдается в результате инкубации с ионами свинца.
На фоне незначительных изменений в полярности и микровязкости мембранных липидов наблюдается отчетливое падение показателя миграции энергии с триптофанов на пирен по сравнению с контрольными значениями (табл.1).
Таким образом, на основании анализа данных литературы и результатов наших исследований можно прийти к заключению, что основным механиз-мом влияния ионов кадмия и свинца на белковые структуры их взаимодей-ствие с сульфгидрильными группами белков. Учитывая неспецифический ха-рактер этих взаимодействий, возможна модификация самого широкого спек-тра белковых молекул. С позиций возможных механизмов нейротоксичности основное внимание уделяется взаимодействию свинца с сульфгидрильными ферментными белками, кальмодулином, тубулином и микротрубочками, про-теинкиназой С, карбоангидразой (Dubrowska-Bouta et al.. 1996).
Данные полученные методом зондовой флуоресценции хорошо согла-суется с обнаруженными при интоксикации тяжелыми металлами в малых дозах явлениями оксидантного стресса, накоплением продуктов перекисного окисления липидов, повреждением биомембран нейроцитов и эндотелия мик-рокапилляров мозга (Singh, 1994; Shafiq-ur-Rehman, et al., 1995).
ГЛАВА 3. ВЫВОДЫ
1. При инкубации синаптосом в среде содержащей тяжелые металлы и в системе генерации АФК, наблюдается существенное снижение интен-сивности суммарной и триптофановой флуоресценции относительно контрольных образцов. При высоких концентрациях тяжелых металлов в среде инкубации интенсивность флуоресценции зависит от времени экс-позиции.
2. Во вторых производных спектров суммарной флуоресценции синапто-сом в контроле и при инкубации с среде с тяжелыми металлами наблю-дается отрицательный пик на 310нм – тирозиновая флуоресценция и ос-новной 333нм указывающий на преобладающий вклад в суммарную флуоресценцию триптофанилов. Инкубация синаптосом в системе гене-рации АФК сопровождается смещением максимума суммарной и трип-тофановой флуоресценции в длинноволновую область на 4 и 6нм соот-ветственно относительно контроля.
3. Инкубация синаптосом в среде содержащий 0.1мМоль ацетата свинца увеличивает связывание флуоресцентного зонда АНС с поврежденной-поверхностью мембран на 30%. Инкубация синаптосом с ацетатом свин-ца сопровождается увеличением микровязкости анулярных и общих мембран синаптосом и падением показателя миграции энергии с белков на пирен.
Список литературы
1. Антонов В. Ф., Смирнова Е. Н., Шевченко Е. В. Липидные мембраны при фазовых переходах. - М.: Наука, 1994
2. Антонов В. Ф..Липиды и ионная проницаемость мембран. Наука, 1982 .149с.
3. Ашмарин И.П., Антипенко А.Е., Ашапкин В.В, Вольский Г.Г., Дамбинова С.А. Нейрохимия. – М.- Изд. – РАМН. – 1996. – 468с.
4. Баранников, В. Д., Кириллов Н. К. Экологическая безопасность сельскохо-зяйственной продукции. - М. : Колос, 2006. -352 с.
5. Безель B.C., Архипова О.Г., Павловская Н.А. Моделирование обмена свин-ца в организме человека. // Гигиена и санитария, 1984, №4: с.46-48.
6. Болдырев А. А. Введение в биохимию мембран. М., 1986. С. 112
7. Болдырев А.А, Ещенко Н.Д, Илюха В.А, Кяйвяряйнен Е.И. Нейрохимия. – Изд. – ДРОФА. -2010. -400с.
8. Бурштейн, Э.А. " Спектры люминесценции ароматических. // Вопр.Мед.Химии J1 - ВМХ 23 (4), 545-549 (1977).
9. Валова, В. Д. Экология. М. : Издательско-торговая корпорация «Дашков и К», 2007. - 352 с.
10. Владимиров Ю.А., Добрецов Г.С. Флуоресцентные зонды в исследовании билогических мембран. -М.: Наука, 1980. —320 с.
11. Дабахов М.В., Дабахова Е.В., Титова В.И. Экотоксикология и проблемы нормирования. Нижегородская гос. с.-х. академия. - Н. Новгород: Изд. ВВАГС, 2005. - 165 с.
12. Кильметова И.Р., Толмачев П.В., Струнин Б.П., Габдразанова С.Ф., Мака-ра Н.С. Влияние композиции «ДАФС-25+Полизон» на функциональ-ное состояние печени // Вестник ветеринарии. - 2012. - Т. 60. - №1. - С. 70-72.
13. Коничев А.С., Севастьянова Г.А. Молекулярная биология. – М.: Акаде-мия, 2003. 400 с.
14. Левшин Л.В., Салецкий А.М. Люминесценция и ее измерения: Молеку-лярная люминесценция. М.: Изд-во МГУ, 1989. 272 с.
15. Левшин.Л.В., Салецкий А.М. Оптические методы исследования молеку-лярных систем. Молекулярная спектроскопия. 1994. 320 с.
16. Леоненко И.И., Александрова Д.И., Егорова А.В., Антонови В.П. Анали-тическое применение эффектов тушения люминесценции // Методы и объ-екты химического анализа. 2012, т.7, № 3 , с. 108-125
17. Лещенко В.Г. Введение в спектральный и люминесцентный анализ. Минск. -2002.- 40с.
18. Позняковский В.М. Гигиенические основы питания и экспертизы продо-вольственных товаров: Учебник.- Новосибирск: Изд-во Новосиб. ун-та, 1996. - 432 с.
19. Снакин В.В. Загрязнение биосферы свинцом: масштабы и перспективы для России. Медицина труда и пром.экология, 19995: 21—27.
20. Хухо Ф. Нейрохимия: Основы и принципы: Пер. с англ. -М.: Мир, 1990. - 384 с
21. Хэммонд П.Б., Фолкс Э.К. Токсичность иона металла в организме чело-века и животных. Некоторые вопросы токсичности ионов металлов.- М.: Мир, 1993.- С. 131-165.
22. Эйхлер В. Яды в нашей пище.- М.: Мир, 1993. - 189 с.
23. Brady S., Siegel G., Albers W., Price D. Basic Neurochemistry, Eighth Edition: Principles of Molecular, Cellular, and Medical Neurobiology. – 2011. -1120p.
24. Cannino G., Ferruggia E., Luparello C., Rinaldi A.M. Cadmium and mito-chondria // Mitochondrion. - 2009. - V. 9. - P. 377–384.
25. Cuypers A., Plusquin M., Remans T., Jozefczak M., Keunen E., Gielen H., Opdenakker K., Nair A.R., Munters E., Artois T.J. Cadmium stress: An oxida-tive challenge // Biometals. - 2010. - V. 23. - P. 927–940.
26. Graciano J.C., Lolacono N.L., Moulton T. et al. (1992) Controlled study of me-so-2,3-dimercaptosuccinicacid for the management of childhood lead intoxica-tion. J. Pediatr., 120: 133—139.
27. Dubrowska-Bouta В., Struczynska L., Rafalowska U. Effect of acute and chron-ic lead exposure on the level of sulfhydryl groups in the brain // Acta Neurobi-ol. Exp. (Warsz). 1996. -233-236p.
28. Ikediobi C.O., Badisa V.L., Ayuk-Takem L.T., Latinwo L.M., West J. Re-sponse of antioxidant enzymes and redox metabolites to cadmium-induced oxi-dative stress in crl-1439 normal rat liver cells // Int. J. Mol. Med. - 2004. - V. 14. - P. 87–92.
29. Lakowicz, Joseph R. Principles of Fluorescence Spectroscopy. 3rd ed. 2006, XVI, 954 p.
30. Lopez E., Arce C., Oset-Gasque M.J., Canadas S., Gonzalez M.P. Cadmium induces reactive oxygen pecies generation and lipid peroxidation in cortical neu-rons in culture // Free Radic. Biol. Med. - 2006. - V. 40. - P. 940–951.
31. Marchetti C. Role of Calcium Channels in Heavy Metal Toxicity // ISRN Toxi-cology. - 2013. - 9 p.
ПРИЛОЖЕНИЕ
Рис.1. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,05 мМоль растворе CdCl2
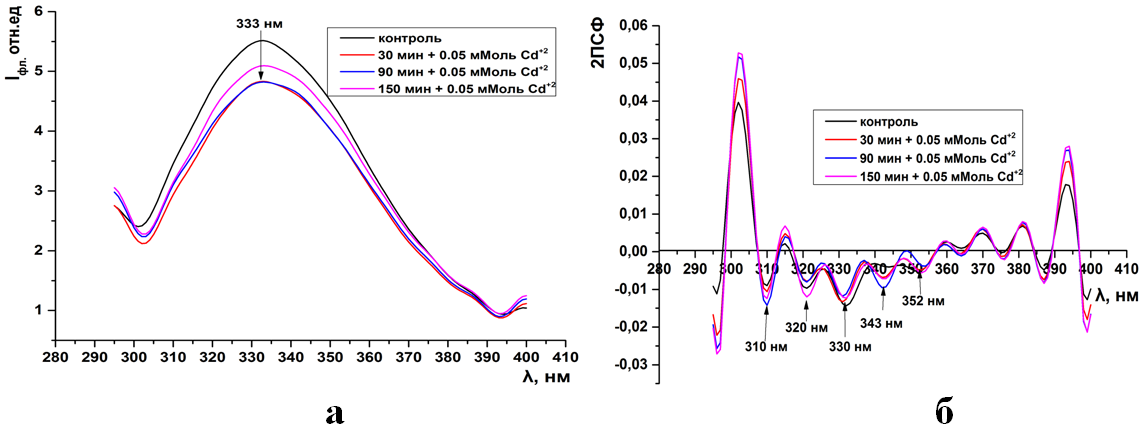
Рис.2. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,1 мМоль растворе CdCl2
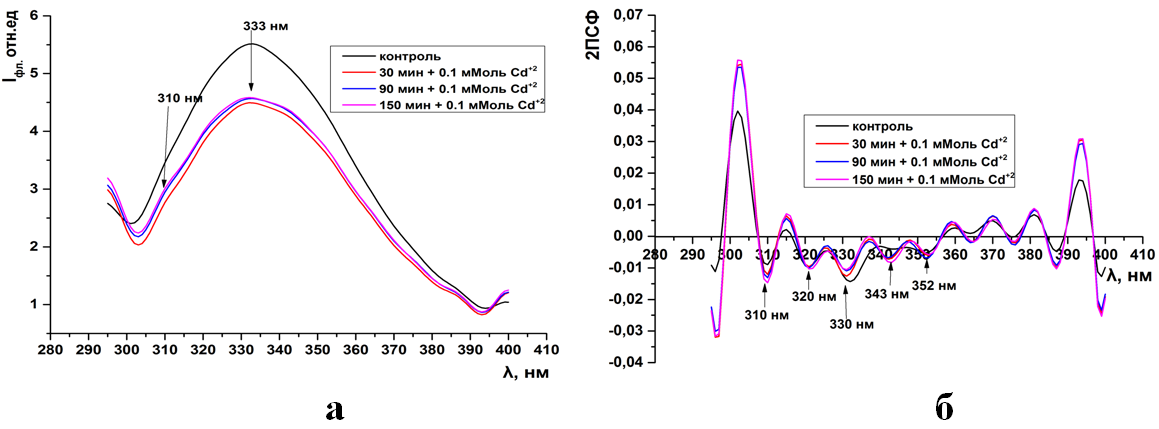
Рис.3. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе CdCl2
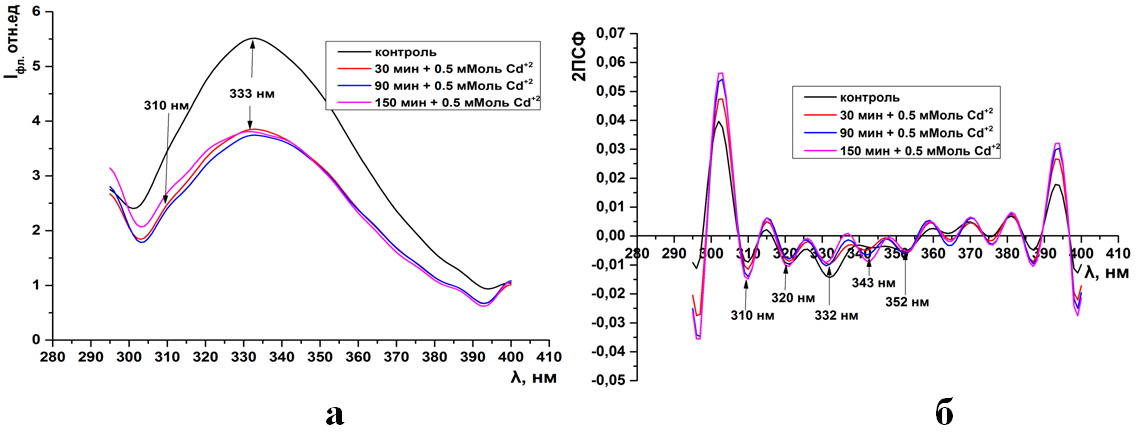
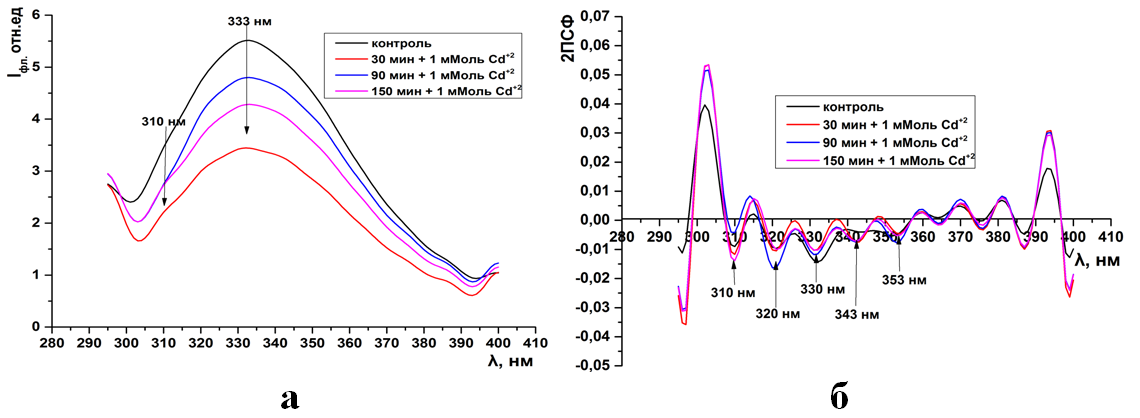
Рис.4. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 1 мМоль растворе CdCl2
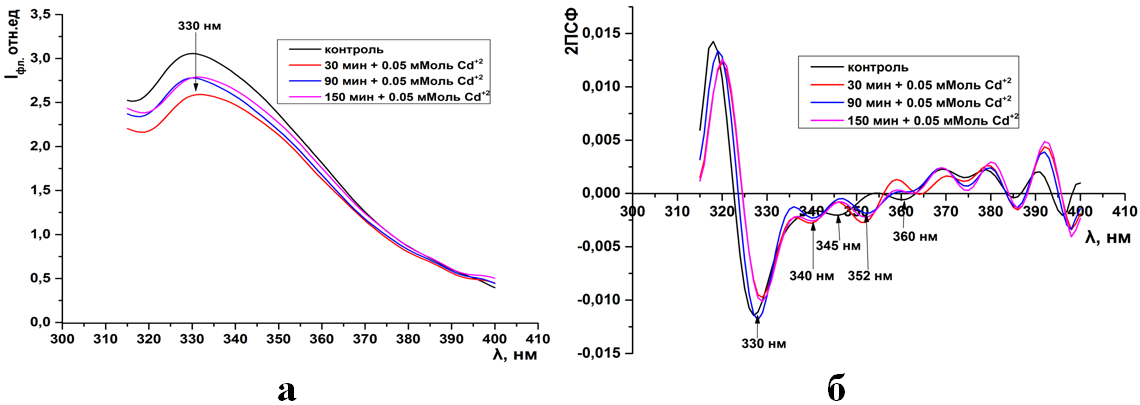 Рис.5. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.05 мМоль растворе CdCl2
Рис.5. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.05 мМоль растворе CdCl2
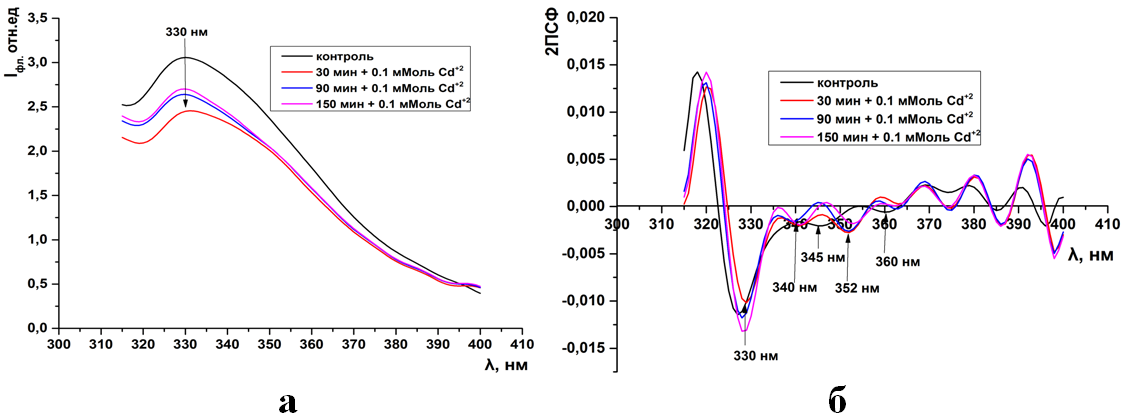
Рис.6. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.1 мМоль растворе CdCl2
Рис.7. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.5 мМоль растворе CdCl2
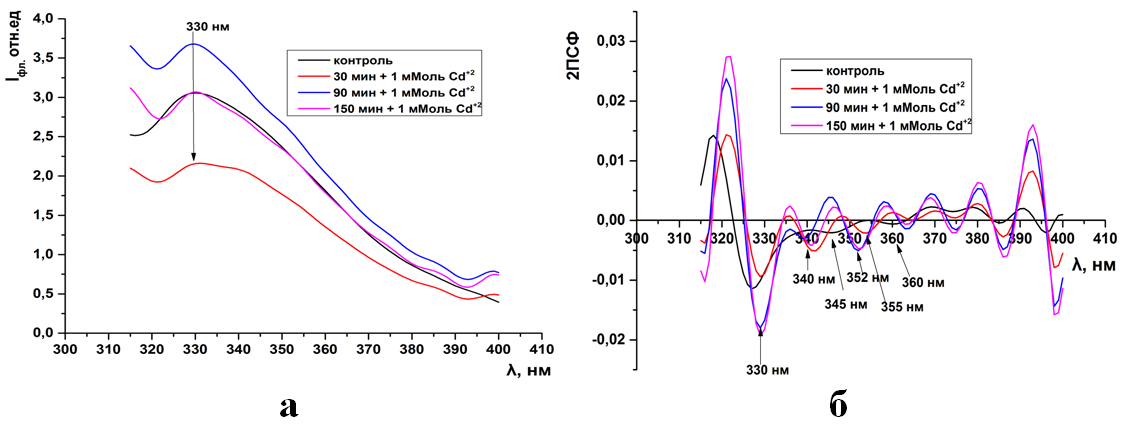
Рис.8. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 1 мМоль растворе CdCl2
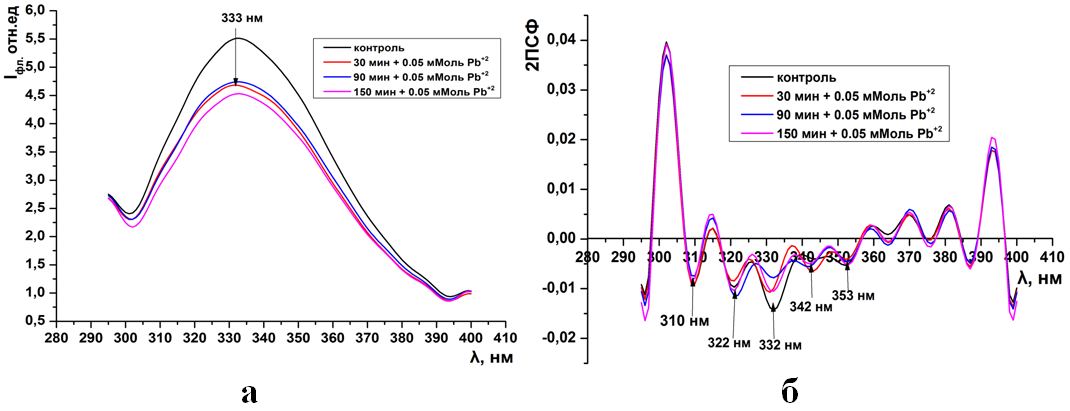
Рис.9. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,05 мМоль растворе Pb(CH3COO)2
Р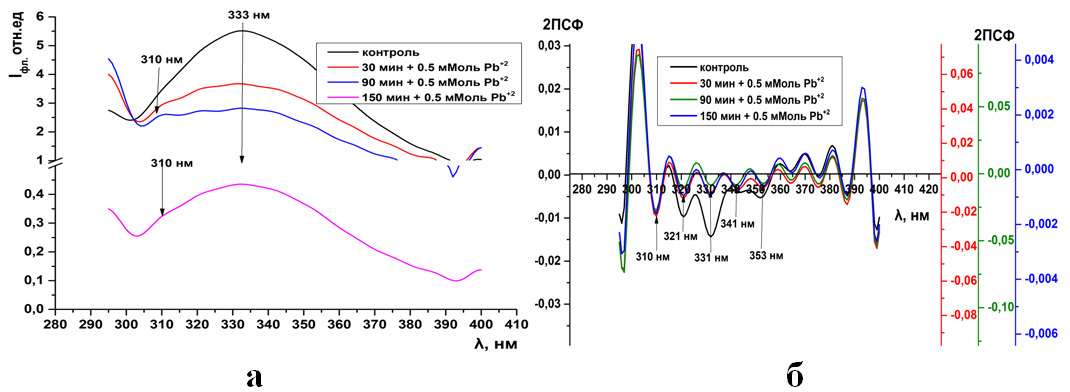 ис.10. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе Pb(CH3COO)2
ис.10. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе Pb(CH3COO)2
Уже при низких концентрациях (0,05мМоль) ионов тяжелых металлов в среде инкубации, во вторых производных спектрах флуоресценции, появляется дополнительный отрицательный пик на 343нм (рис. 1б, 9б). Дальнейшее увеличение концентрации катионов не влияет на динамику отрицательных пиков в спектрах вторых производных флуоресценции (ри.2-4б, 10-11б).
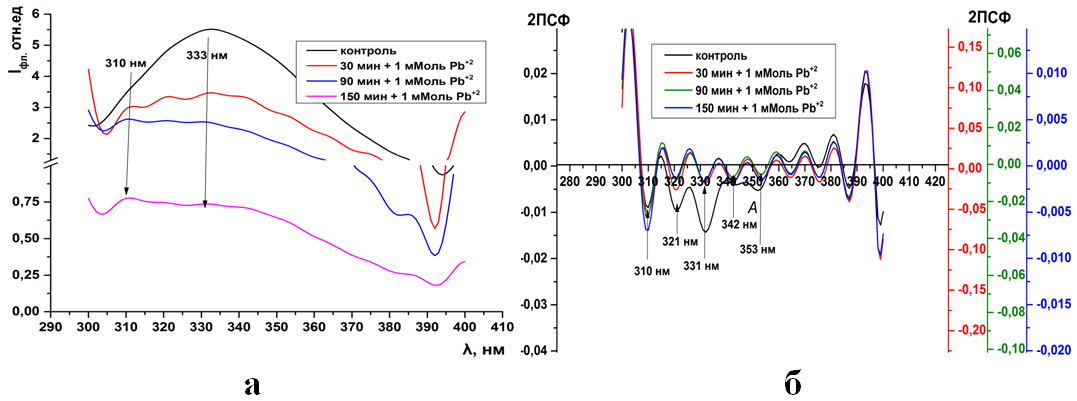
Рис.11. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 1 мМоль растворе Pb(CH3COO)2
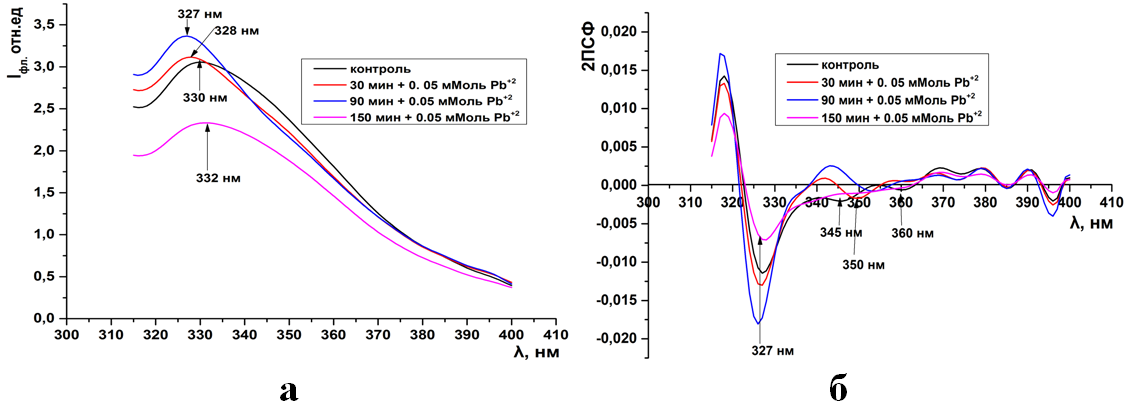
Рис.12. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,05 мМоль растворе Pb(CH3COO)2
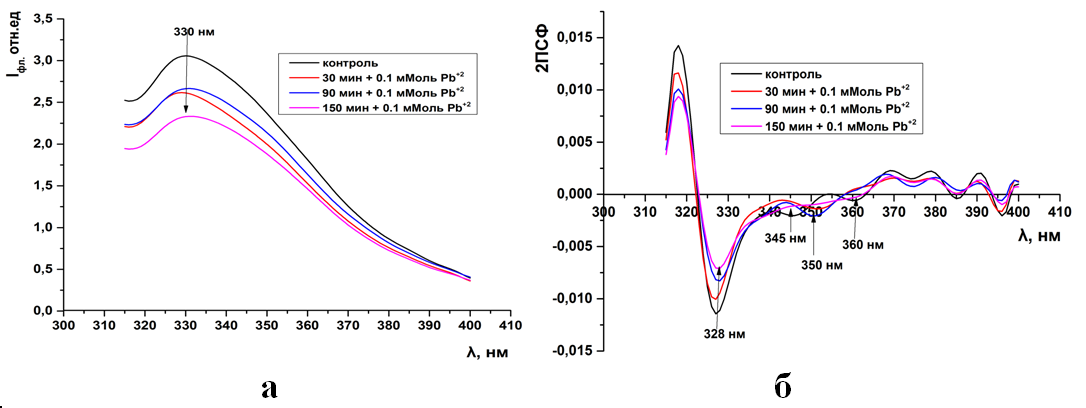
Рис.13. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,1 мМоль растворе Pb(CH3COO)2
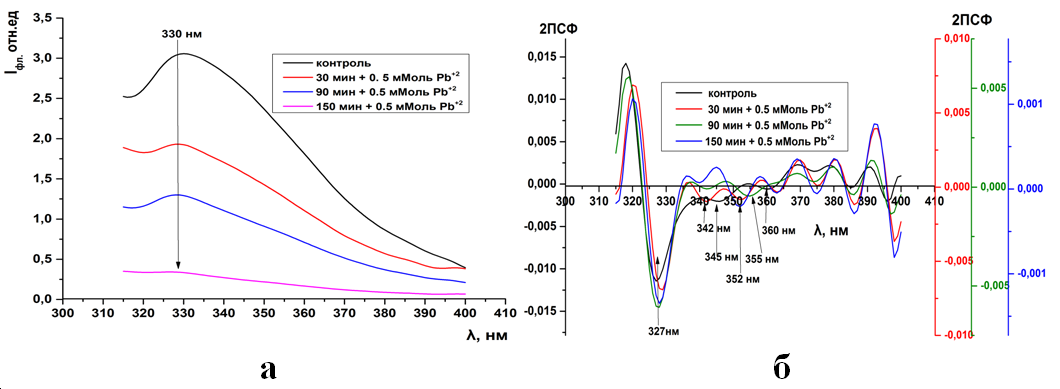
Рис.14. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе Pb(CH3COO)2
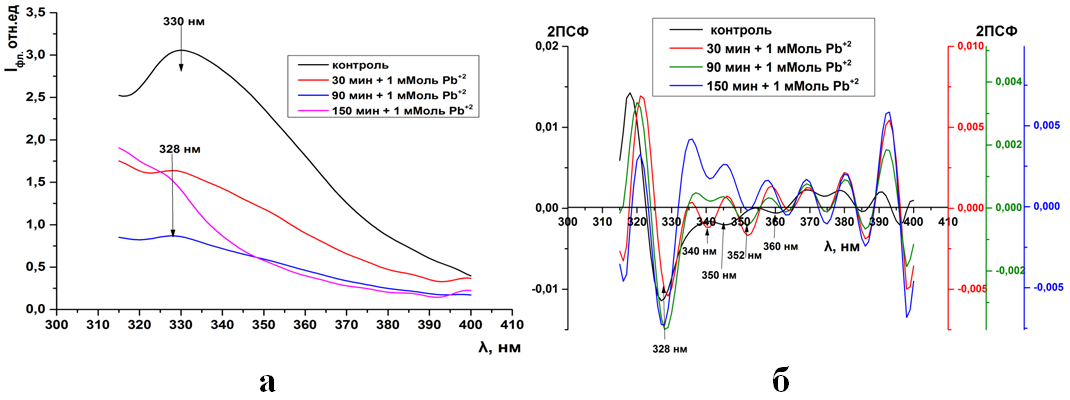
Рис.15. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 1 мМоль растворе Pb(CH3COO)2
В отличие от действия тяжелых металлов, инкубация синаптосом в среде с генерацией свободных радикалов сопровождается снижением суммарной флуоресценции и длинноволновым сдвигом максимума на 337нм относительно контроля (333нм). Наряду с этим во вторых производных практически исчезают основная масса отрицательных пиков за исключением слабовыраженных на 310, 320, 330нм (рис. 16 а, б).
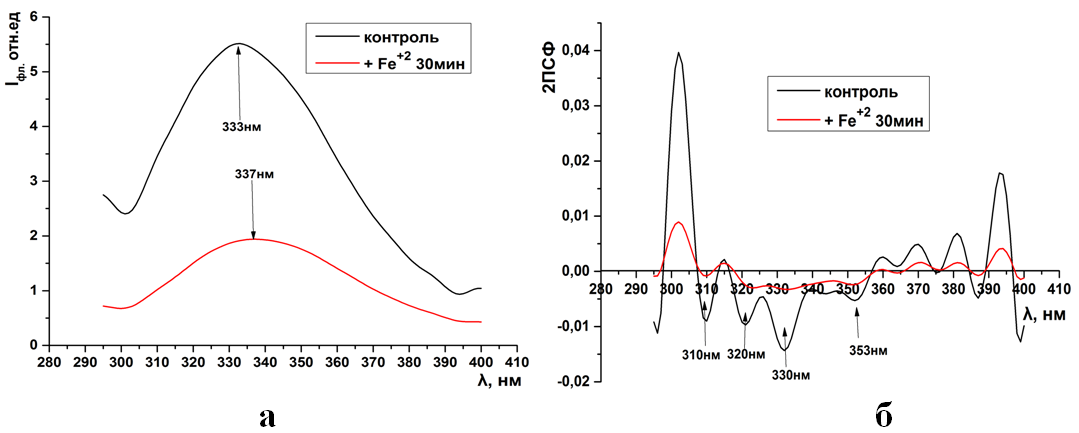
Рис.16. Суммарная флуоресценция синаптосом крыс (а) и ее вторые производные (б) при инкубации в системе генерации АФК FeSO4 + Н2О2
Изменения в спектрах суммарной флуоресценции синаптосом в системе генерации АФК подтверждается и спектрами триптофановой флуоресценцией. Здесь также наблюдается длинноволновой сдвиг 330→336нм и исчезновение во вторых производных отрицательных пиков за исключением пика на 330нм.
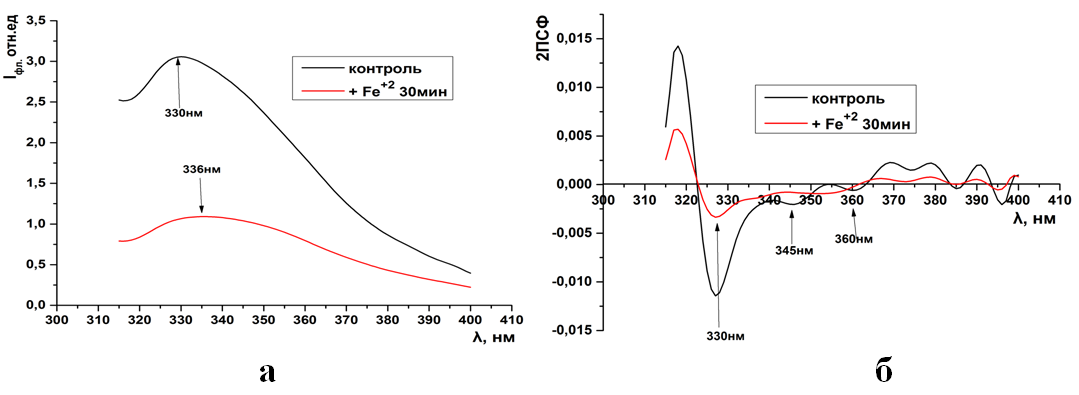
Рис.17. Триптофановая флуоресценция синаптосом крыс (а) и ее вторые производные (б) при инкубации в системе генерации АФК FeSO4 + Н2О2
Таблица 1
Показатели собственной и зондовой флуоресценции синаптосом в контроле и при инкубации в 0,1 мМоль растворе Pb(CH3COO)2
| Мембранная структура | λв=280 суммарная | λв=295 триптофановая | АНС λв=365 λфл=470 | λв=280 (пирен) | λв=334 (пирен) | Величина миграции энергии, % |
| I470/I390 микровязкость анулярных липидов | I370/I390 полярность анулярных липидов | I470/I390 микровязкость общих липидов | I370/I390 полярность общих липидов |
| Синаптосомы | 5,5 | 3,0 | 0,2 | 0,56 | 0,65 | 0,61 | 0, 64 | 80,9 |
| Синаптосомы + 0,1 мМоль Pb+2 | 4,5 | 3,0 | 0,29 | 0,45 | 0,56 | 0,50 | 0, 52 | 69,3 |











 Рис.5. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.05 мМоль растворе CdCl2
Рис.5. Триптофановая флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0.05 мМоль растворе CdCl2


 ис.10. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе Pb(CH3COO)2
ис.10. Суммарная флуоресценция синаптосом мозга крыс (а) и ее вторые производные (б) при инкубации в 0,5 мМоль растворе Pb(CH3COO)2
















